パンくず
製品について 有効性と安全性
「禁忌を含む注意事項等情報」等はこちらをご参照ください。 |
※ 本試験は、ゾレア皮下注用(凍結乾燥製剤)で実施されました。現在の承認内容とは異なる用法及び用量での成績が含まれますが、承認時に評価された資料であるため紹介します。ゾレア皮下注シリンジ(注射剤)とゾレア皮下注用(凍結乾燥製剤)との同等性については総合製品情報概要を参照してください。
ゾレアの臨床成績
1.第Ⅲ相国際共同検証試験(E2306試験)1)2)
1)社内資料:特発性の慢性蕁麻疹患者を対象とした国際共同検証試験(E2306試験)(2017年3月24日承認、CTD2.7.6-4.1.1)(承認時評価資料)〔20170085〕
2)Hide, M. et al.: J Dermatol Sci. 2017; 87(1): 70-78〔20170808〕
本試験にノバルティスは資金提供を行いました。本論文の著者にノバルティスより講演料/コンサルタント料を受領している者が含まれます。
著者にノバルティスとアドバイザリー契約をしている者が含まれます。著者のうち4名は、ノバルティスの社員です。
(1)試験デザイン
目的
ヒスタミンH1受容体拮抗薬で効果不十分な特発性の慢性蕁麻疹患者を対象に、ゾレアの有効性をプラセボと比較して検証し、併せて安全性を評価する。
対象
ヒスタミンH1受容体拮抗薬で効果不十分な特発性の慢性蕁麻疹患者218例(ゾレア300mg群73例、ゾレア150mg群71例、プラセボ群74例)
試験方法
多施設共同、無作為化、二重盲検、プラセボ対照、並行群間比較試験
投与方法
ゾレア群は、オマリズマブ(遺伝子組換え)として1回300mg又は150mgを4週間隔(1日目、4週後、8週後)で皮下投与し(投与期)、投与期の完了又は中止にかかわらず全ての患者が追跡調査期に移行した。
主要評価項目
12週における週間そう痒スコア*1のベースラインからの変化量(検証的な解析項目)
副次評価項目
12週における、UAS7*1のベースラインからの変化量、週間膨疹スコア*1のベースラインからの変化量、UAS7が6以下の患者割合、週間最大膨疹の長径スコアのベースラインからの変化量、週間そう痒スコアでMIDが認められた患者割合、UAS7=0の達成割合、DLQI総合スコアのベースラインからの変化量
解析計画
主解析は、FAS(無作為化され、治験薬を1回以上投与された患者)での主要評価項目に対する解析とした。有効性の主要評価項目である12週における週間そう痒スコアのベースラインからの変化量の解析には、反復測定混合モデルを用い、国、投与群、週、及び投与群と週の交互作用を固定効果、患者を変量効果、ベースライン時のスコアを共変量として含めた。補助的解析として、PPSを対象とした解析、及び12週のそう痒スコアが欠測の場合に異なる補填方法を用いた解析を実施し、主解析の結果の頑健性を評価した。12週におけるUAS7 が6以下となった患者の割合、12週における週間そう痒スコアでMIDが認められた患者割合、並びに12週におけるUAS7=0の達成割合に対しては、ロジスティック回帰モデルを用いて検定し、モデルには、国及び投与群を要因、ベースライン時のスコアを共変量として含めた。12週におけるUAS7のベースラインからの変化量、12週における週間膨疹スコアのベースラインからの変化量、12週における週間最大膨疹の長径スコアのベースラインからの変化量、12週におけるDLQI総合スコアのベースラインからの変化量は、主要評価項目と同様に解析した。ただし、DLQI総合スコアは週の代わりに来院をモデルに含めた。主要評価項目は、プラセボ群とゾレア150mg群、プラセボ群とゾレア300mg群の各対比較を有意水準両側2.5%にて行い、有意であった場合には下位の副次評価項目について検定が実施された。主要・副次評価項目の計16の帰無仮説に対する検定の多重性は可変的なゲートキーピング法を用いて調整した。
なお、日本人被験者を対象に、主要評価項目(12週における週間そう痒スコアのベースラインからの変化量)並びに副次評価項目のうち12週における週間膨疹スコアのベースラインからの変化量について、全体集団と同様の解析を行った。副次評価項目のうち12週におけるUAS7=0の達成割合は、カテゴリカル変数に対して12週における被験者数と割合を算出して評価した。
投与スケジュール
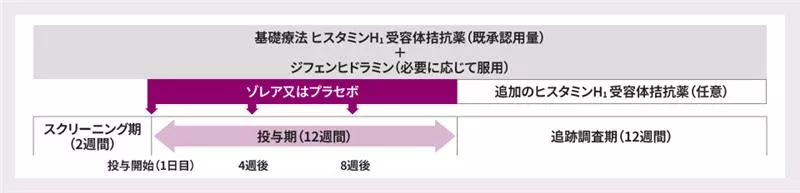
注:本剤の用法及び用量は『特発性の慢性蕁麻疹(既存治療で効果不十分な患者に限る)に対しては、通常、成人及び12歳以上の小児にはオマリズマブ(遺伝子組換え)として1回300mg を4週間毎に皮下に注射する』であるため、有効性に関してはゾレア150mg 群を割愛した。
*1 スコアの定義
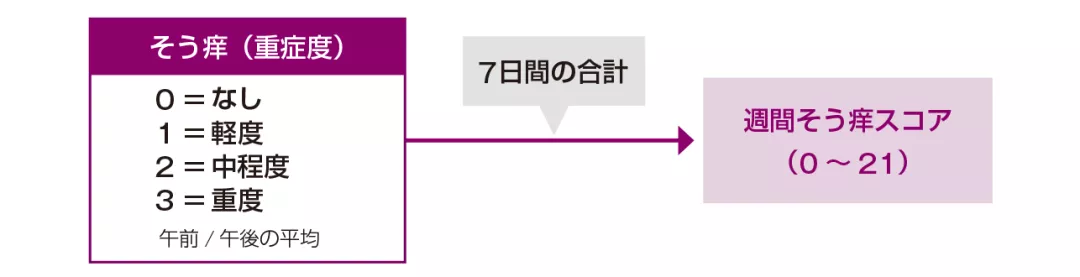
| 〈参考〉ゾレアの臨床試験における週間そう痒スコアの算出方法 | |
1日2回測定した平均値が1日のスコアとなり、7日間合計した値が週間スコアとなります。 | Image
|
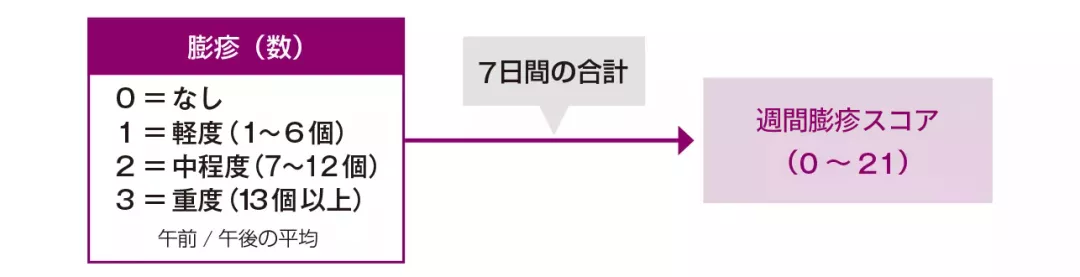
| 〈参考〉ゾレアの臨床試験における週間膨疹スコアの算出方法 | |
| 1日2回測定した平均値が1日のスコアとなり、7日間合計した値が週間スコアとなります。 | Image
|
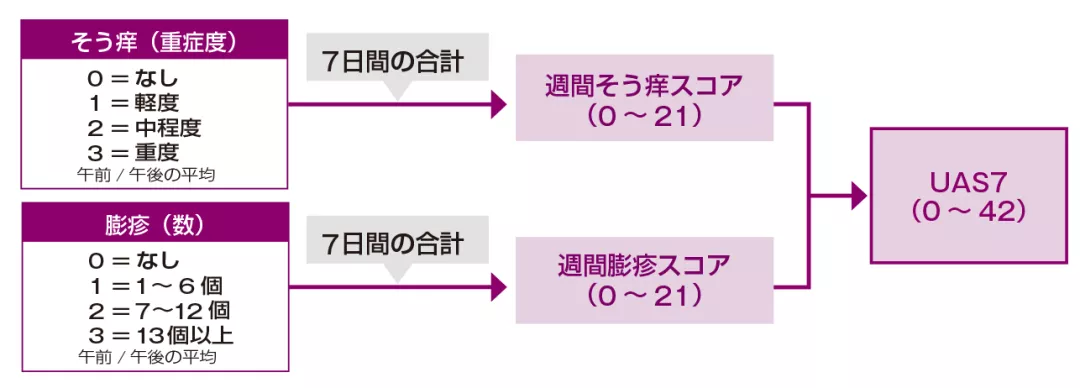
| 〈参考〉ゾレアの臨床試験におけるUAS7(Urticaria Activity Score7)の算出方法 | |
| ゾレアの臨床試験では当局からの指示により1日2回測定後、2回の平均値をその日のスコアとし、その合計を週間スコアとしていました。 | Image
|
Zuberbier, T. et al.: Allergy. 2014; 69(7): 868-887
4. 効能又は効果(抜粋)
○特発性の慢性蕁麻疹(既存治療で効果不十分な患者に限る)
5. 効能又は効果に関連する注意(抜粋)
〈特発性の慢性蕁麻疹〉
5.3 食物、物理的刺激等の蕁麻疹の症状を誘発する原因が特定されず、ヒスタミンH1受容体拮抗薬の増量等の適切な治療を行っても、日常生活に支障をきたすほどの痒みを伴う膨疹が繰り返して継続的に認められる場合に本剤を追加して投与すること。
6. 用法及び用量(抜粋)
〈特発性の慢性蕁麻疹〉
通常、成人及び12歳以上の小児にはオマリズマブ(遺伝子組換え)として1回300mgを4週間毎に皮下に注射する。
| 承認の範囲内の症例群のみに限定し、一部改変しています(ゾレア150mg群は承認外の用法及び用量のため削除しています)。 |
(2)12週における週間そう痒スコア*2のベースラインからの変化量[ 主要評価項目:検証的な解析結果 ]
12週における週間そう痒スコアのベースラインからの変化量(最小二乗平均値)は、プラセボ群に比べてゾレア300mg群で優越性が検証された(p<0.001、反復測定混合モデル)。
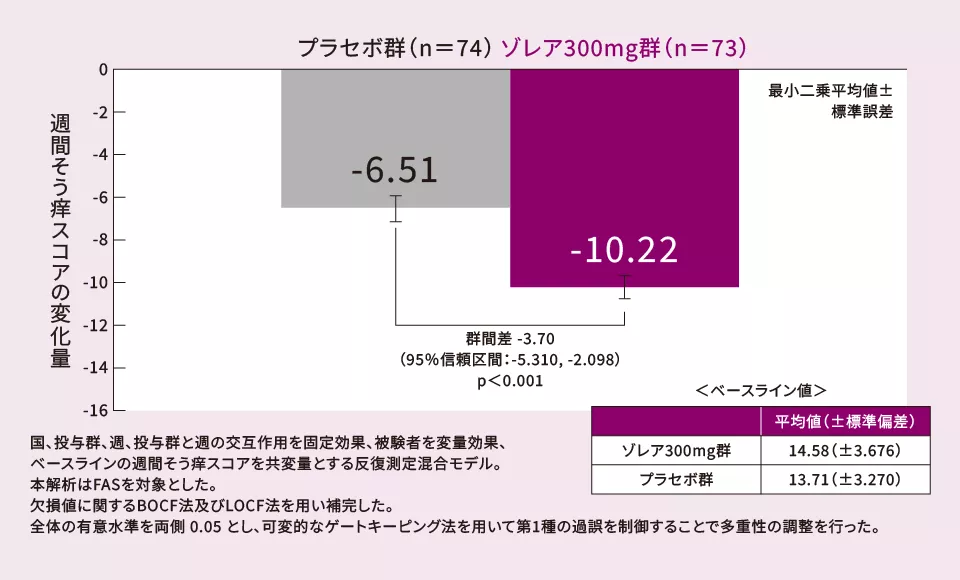
*2 週間そう痒スコアの定義
1週間のそう痒スコア(1日 0~3)を累計したスコア。
(3)12週における週間膨疹スコア*3のベースラインからの変化量[ 副次評価項目 ]
12週における週間膨疹スコアのベースラインからの変化量(最小二乗平均値)は、プラセボ群とゾレア300mg群の間に有意な差が認められた(p<0.001、多重性調整あり、反復測定混合モデル)。
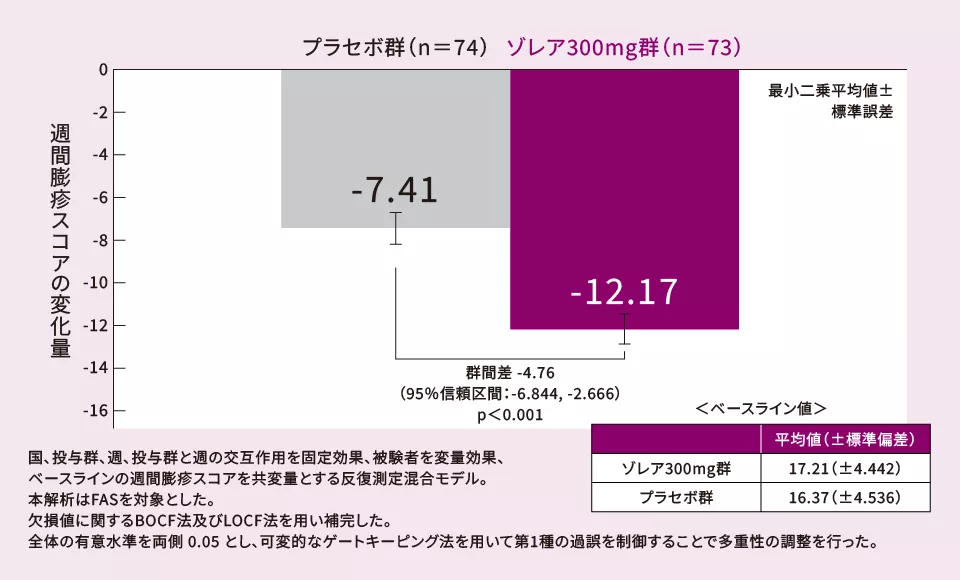
*3 週間膨疹スコアの定義
1週間の膨疹スコア(1日 0~3)を累計したスコア。
(4)12週におけるUAS7*4=0の達成割合[ 副次評価項目 ]
12週におけるUAS7=0の達成割合は、プラセボ群に比べてゾレア300mg群で有意に多かった(p<0.001、多重性調整あり、ロジスティック回帰モデル)。
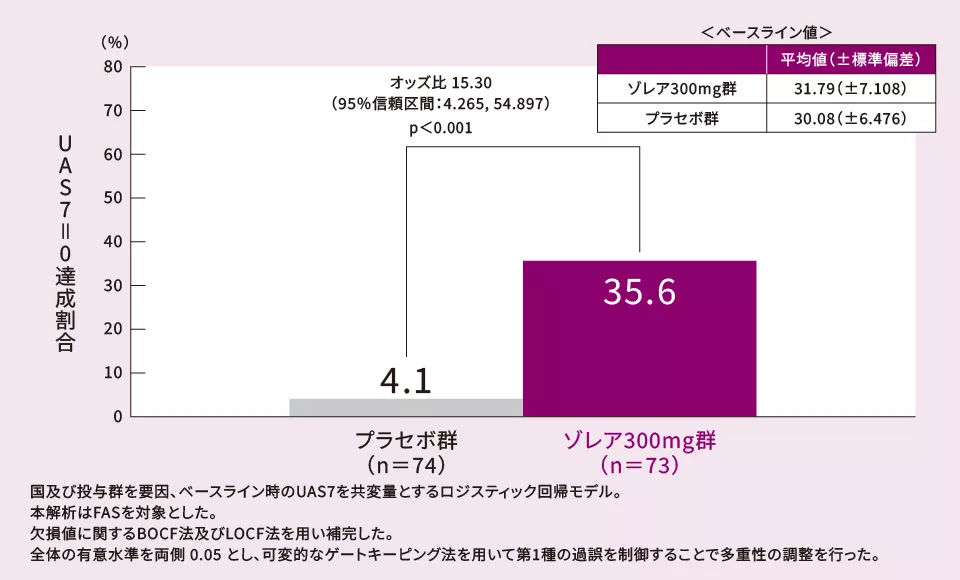
*4 UAS7の定義
7-day Urticaria Activity Score:1週間のそう痒スコア及び膨疹スコアを累計したスコア。
UAS7=0の状態とは
- 1週間のうち、蕁麻疹症状(痒み及び膨疹)が観察されていない状態。
(5)安全性
本試験における有害事象発現率はゾレア300mg群で54.8%(40/73例)、ゾレア150mg群で57.7%(41/71例)、プラセボ群で55.4%(41/74例)であった。いずれかの投与群で4%以上に発現した主な有害事象は、ゾレア300mg群で鼻咽頭炎9例(12.3%)、湿疹5例(6.8%)、咽頭炎、頭痛、慢性特発性蕁麻疹各3例(4.1%)であった。ゾレア150mg群で鼻咽頭炎7例(9.9%)、蕁麻疹4例(5.6%)、咽頭炎、上気道感染、頭痛、湿疹各3例(4.2%)であった。プラセボ群で鼻咽頭炎12例(16.2%)、頭痛5例(6.8%)、接触性皮膚炎3例(4.1%)であった。
本試験における副作用発現率はゾレア300mg群で9.6%(7/73例)、ゾレア150mg群で8.5%(6/71例)、プラセボ群で12.2%(9/74例)であった。いずれかの投与群で2例以上に発現した副作用は、ゾレア300mg群の頭痛2例(2.7%)であった。
重篤な有害事象はゾレア300mg群で4.1%(3/73例)、ゾレア150mg群で4.2%(3/71例)であった。内訳は、ゾレア300mg群では肺炎、慢性胆嚢炎、糖尿病、ゾレア150mg群では四肢外傷性切断、脊髄損傷、肺炎及び喘息であった。また、投与中止に至った有害事象はゾレア150mg群で1.4%(1/71例、咽頭浮腫)であり、死亡例は報告されなかった。
参考:日本人部分集団[ サブグループ解析 ]
| 承認の範囲内の症例群のみに限定し、一部改変しています(ゾレア150mg群は承認外の用法及び用量のため削除しています)。 |
プラセボ又はゾレア300mg又は150mgを4週間隔で3回皮下投与した。12週後の週間そう痒スコア*5のベースラインからの変化量、週間膨疹スコア*6のベースラインからの変化量及びUAS7=0の達成割合を次表に示す。
*5 1週間のそう痒スコア(1日0~3)を累計したスコア。
*6 1週間の膨疹スコア(1日0~3)を累計したスコア。
| ゾレア 300mg群 | プラセボ群 | 群間差[95%信頼区間] | |
| 週間そう痒スコアの ベースラインからの変化量 [最小二乗平均値] | -9.54 (35例) | -5.17 (36例) | -4.37 [-6.77, -1.97]*7 |
| 週間膨疹スコアの ベースラインからの変化量 [最小二乗平均値] | -12.06 (35例) | -5.77 (36例) | -6.29 [-9.41, -3.17]*7 |
| UAS7 =0の達成割合 | 31.4% (11/35例) | 2.8% (1/36例) |
|
*7 投与群、週、投与群と週の交互作用を固定効果、被験者を変量効果、ベースライン値を共変量とする反復測定混合モデル。
製品について
疾患について

