パンくず
ベオビュ 加齢黄斑変性(AMD)
母集団薬物動態/薬力学モデルによるシミュレーション[日本人を含む国際共同第Ⅲ相試験(HAWK:C001試験)及び海外第Ⅲ相試験(HARRIER:C002試験)(外国人データ)]14)
14)社内資料:目標適応症に対する有効性(中心窩下脈絡膜新生血管を伴う加齢黄斑変性)[20250007] 承認時評価資料
有効性
(1)最高矯正視力スコアのベースラインからの変化量
〔注目する有効性評価項目:48週及び36~48週の平均値〕
48週の最高矯正視力スコアのベースラインからの変化量(平均値±標準誤差)は、新たな用法※1(推定値:HAWK試験/HARRIER試験)で7.2±0.56文字/7.7±0.62文字、既承認の用法※2(実測値:HAWK試験/HARRIER試験)で7.2±0.79文字/7.5±0.57文字で、その差(推定値-実測値:HAWK試験/HARRIER試験)は0.0±0.68文字/0.2±0.60文字でした。
36~48週の最高矯正視力スコアのベースラインからの平均変化量(平均値±標準誤差)は、新たな用法※1(推定値:HAWK試験/HARRIER試験)で7.0±0.54文字/7.4±0.57文字、既承認の用法※2(実測値:HAWK試験/HARRIER試験)で7.2±0.73文字/6.9±0.57文字で、その差(推定値-実測値:HAWK試験/HARRIER試験)は-0.2±0.64文字/0.5±0.57文字でした。
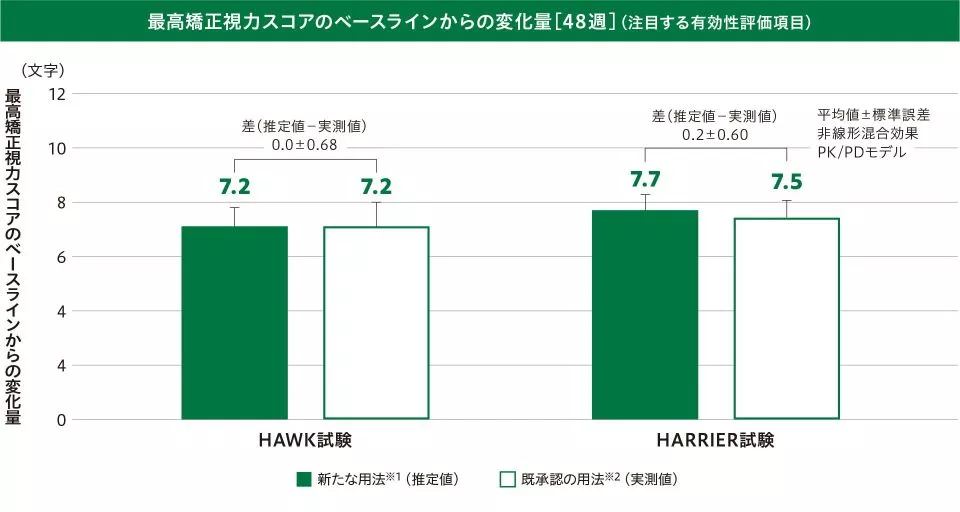
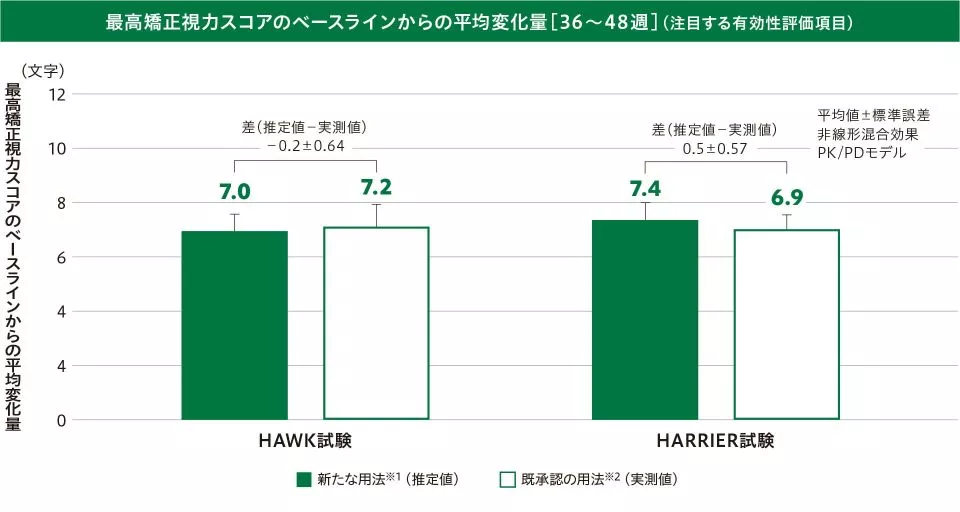
※1 ベオビュ6mgを6週ごとに2回導入投与後、疾患活動性が認められる場合には3回目の導入投与を行い、維持投与として疾患活動性に応じて12週ごとまたは8週ごと投与
※2 ベオビュ6mgを4週ごとに3回導入投与後、維持投与として疾患活動性に応じて12週ごとまたは8週ごと投与
(2)中心サブフィールド厚のベースラインからの変化量
〔注目する有効性評価項目:48週及び36~48週の平均値〕
48週の中心サブフィールド厚のベースラインからの変化量(平均値±標準誤差)は、新たな用法※1(推定値:HAWK試験/HARRIER試験)で-182.0±6.28μm/-188.8±6.23μm、既承認の用法※2(実測値:HAWK試験/HARRIER試験)で-170.9±7.51μm/-189.8±8.23μmで、その差(推定値-実測値:HAWK試験/HARRIER試験)は-11.1±6.92μm/1.0±7.30μmでした。
36~48週の中心サブフィールド厚のベースラインからの平均変化量(平均値±標準誤差)は、新たな用法※1(推定値:HAWK試験/HARRIER試験)で-174.4±6.34μm/-181.1±6.44μm、既承認の用法※2(実測値:HAWK試験/HARRIER試験)で-170.1±7.56μm/-187.4±8.09μmで、その差(推定値-実測値:HAWK試験/HARRIER試験)は-4.3±6.98μm/6.3±7.31μmでした。
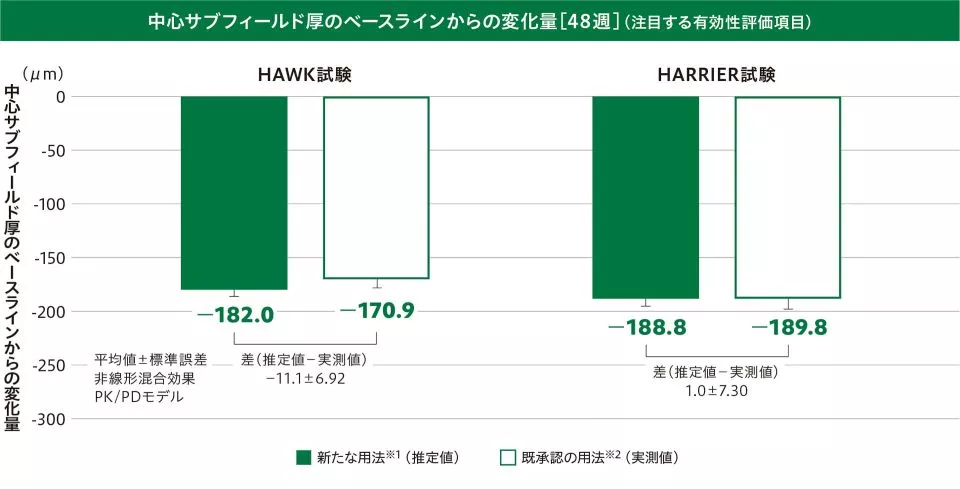
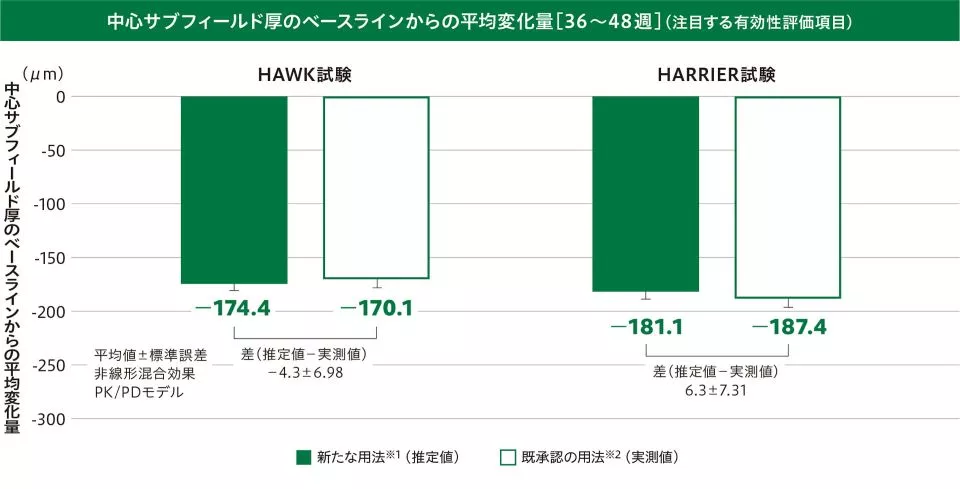
※1 ベオビュ6mgを6週ごとに2回導入投与後、疾患活動性が認められる場合には3回目の導入投与を行い、維持投与として疾患活動性に応じて12週ごとまたは8週ごと投与
※2 ベオビュ6mgを4週ごとに3回導入投与後、維持投与として疾患活動性に応じて12週ごとまたは8週ごと投与
(3 )投与継続状況
12週間隔投与を維持した患者の割合(注目する有効性評価項目:48週)
48週(シミュレーションの終了時点)までベオビュ6mgの12週間隔投与を維持した患者の割合(推定値)は約50%(標準誤差:約2%)、臨床試験の実測値はHAWK試験で55.6%、HARRIER試験で51.1%でした。
