Dette nettstedet er kun for helsepersonell som lege, offentlig godkjent sykepleier og farmasøyt


Tidlig brystkreft
Kisqali i kombinasjon med en aromatasehemmer, er indisert til adjuvant behandling av pasienter med hormonreseptor (HR)-positiv, human epidermal vekstfaktorreseptor 2 (HER2)-negativ tidlig brystkreft med høy risiko for tilbakefall. (Seleksjonskriterier pkt 5.1)
Hos pre- eller perimenopausale kvinner, eller menn, skal aromatasehemmeren kombineres med en luteiniserende hormonfrigjørende hormon (LHRH)-agonist.1
Personen på bildet er ikke en virkelig pasient.
1. Preparatomtale Kisqali, avsnitt 4.1, 5.1
Seleksjonskriterier1
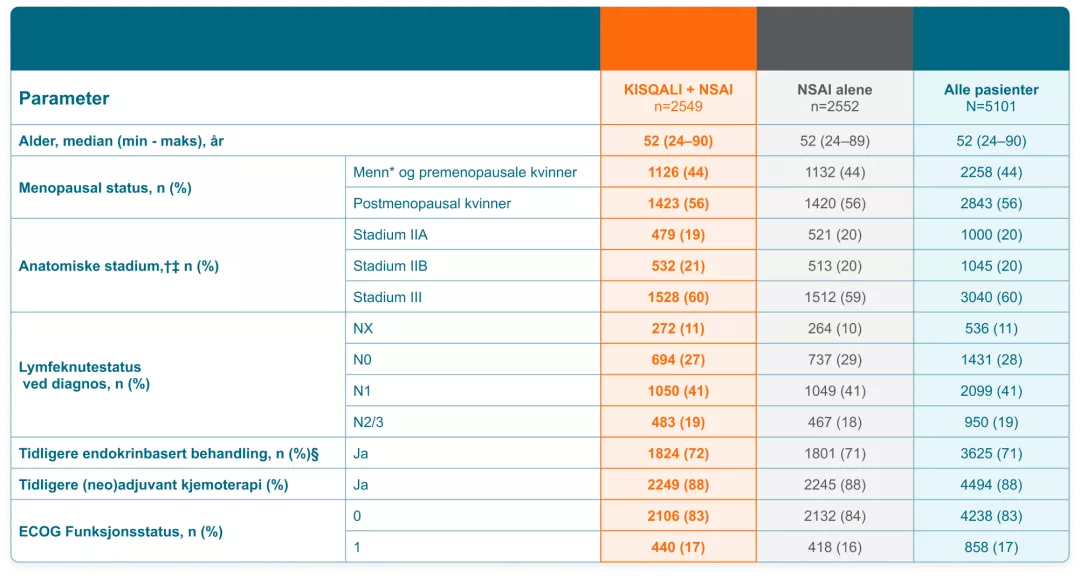
Kisqali ble evaluert i en randomisert, åpen, klinisk fase IIImultisenterstudie ved behandling av pre-/postmenopausale kvinner og menn med HR-positiv, HER2-negativ tidlig brystkreft, med anatomisk stadium II eller III uavhengig av lymfeknutestatus, med høy risiko for tilbakefall i kombinasjon med en aromatasehemmer (aromatasehemmer, letrozol eller anastrozol) versus aromatasehemmer alene, som var:
- Anatomisk stadium IIB-III, eller
- Anatomisk stadium IIA som enten er:
- Lymfeknutepositiv eller
- Lymfeknutenegativ, med:
- Histologisk grad 3, eller
- Histologisk grad 2, med enhver av følgende kriterier:
- Ki67 ≥ 20 %
- Høyrisiko ved testing av gensignatur
1: Preparatomtale Kisqali, avsnitt 5.1
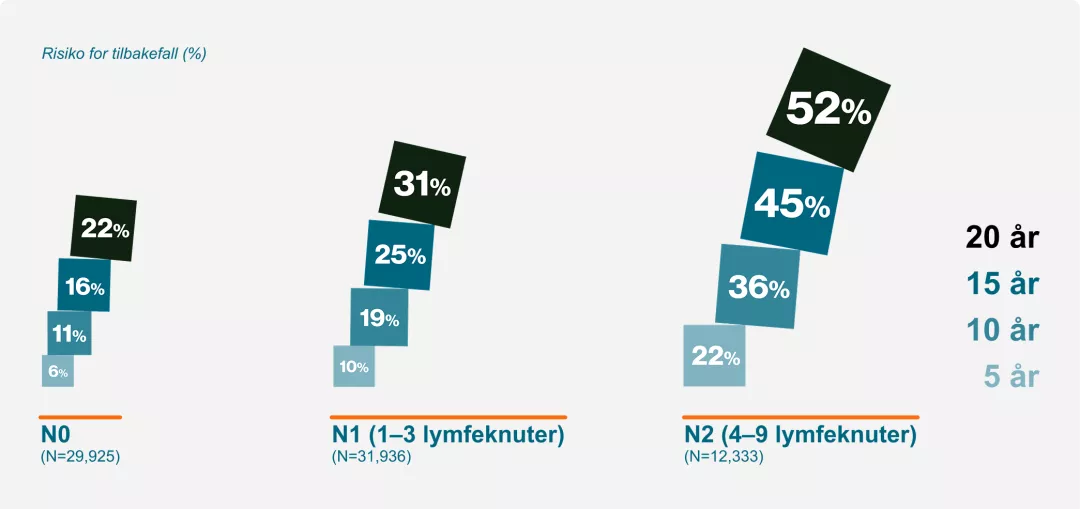
Risiko for metastatisk tilbakefall etter endokrin behandling er tilstede uavhengig av lymfeknutestatus1
Tilpasset fra Pan, et al, 2017.
Meta-analyse 88 studier fra EBCTCG på kvinner med ER+ brystkreft (T1 eller T2), som var kreftfrie etter fem år med endokrinbasert behandling.
1. Pan H, Gray R, Braybrooke J, et al. 20-Year Risks of Breast-Cancer Recurrence after Stopping Endocrine Therapy at 5 Years. N Engl J Med. 2017;377(19):1836-1846.

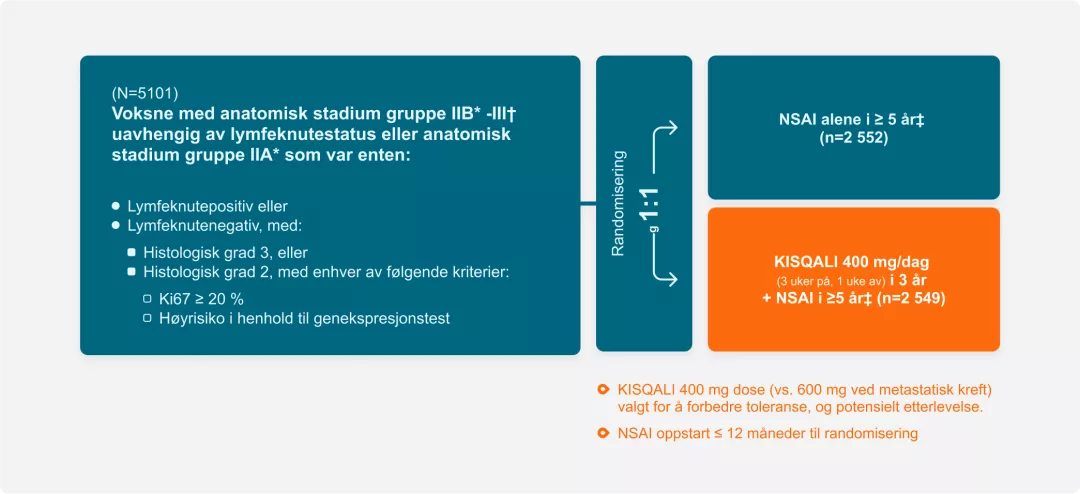

Studiedesign NATALEE1
Primært endepunkt
iDFS brukt STEEP kriterier
Sekundært endepunkt
- Tilbakefallsfri overlevelse
- DDFS
- OS
- HR-QoL
- Sikkerhet og toleranse
- Farmakokinetikk
Anatomisk stadium IIA inklusive N0 (grad 2 med ytterligere
risikofaktorer, f.eks. Ki-67 ≥20% eller
genekspresjonsanalyse Oncotype DX Breast Recurrance
Score ≥26), eller grad 3 og N1. Anatomisk stadium IIB
inklusive N0 eller N1. Innrullering av pasienter med stadium
II ble stoppet ved 40 %.
† Anatomisk stadium III inklusive N0, N1, N2 eller N3.
‡ Menn og premenopausale kvinner fikk også goserelin.
DDFS: Distant Disese Free Survival
OS: Overall Survival
NSAI: Non Steroid Aromatase Inhibitor
1. Slamon DJ, Fasching PA, Hurvitz S, et al. Rationale and trial design of NATALEE: a Phase III trial of adjuvant ribociclib + endocrine therapy versusendocrine therapy alone in patients
with HR+/HER2- early breast cancer. Ther Adv Med Oncol. 2023; 29;15:17588359231178125
Pasientpopulasjon i NATALEE-studien1

Kisqali kan brukes av HR+/HER2- pasienter med økt risiko for tilbakefall1*
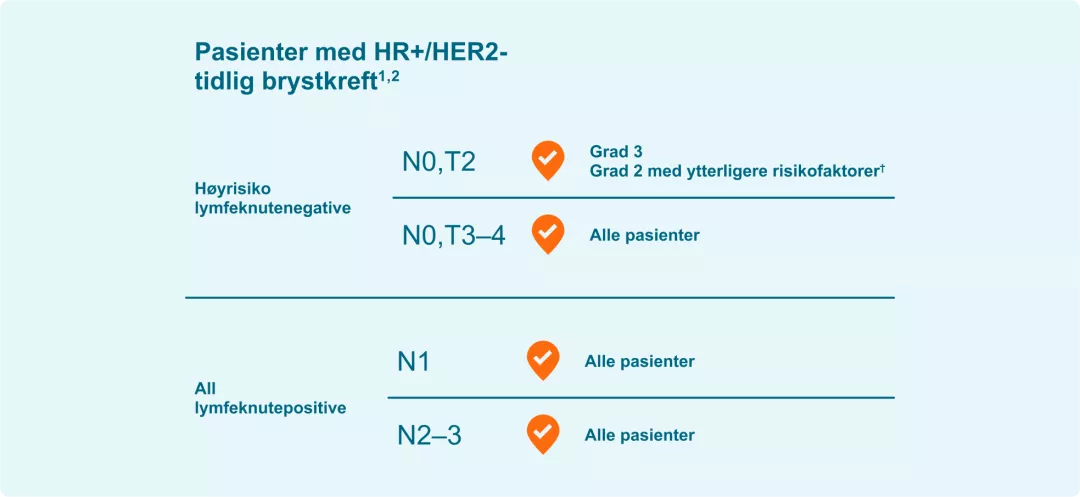

† Grad 3 eller grad 2 tilleggs risikofaktorer, slik som Ki-67 score ≥ 20 % eller definert som en Oncotypre DX Breats Recurrence Score på ≥26 eller Prosigna/PAM50, MammaPrint eller EndoPredict Epclin høy-risiko score.2
Referanser:
1: Preparatomtale Kisqali
2: Slamon DJ, Fasching PA, Hurvitz S, et al. Rationale and trial design of NATALEE: a Phase III trial of adjuvant ribociclib + endocrine therapy versusendocrine therapy alone in patients
with HR+/HER2- early breast cancer. Ther Adv Med Oncol. 2023; 29;15:17588359231178125
Hvordan er pasientpopulasjonene forskjellige?
Studiepopulasjonen i NATALEE og monarchE (kohort 1)1,2,3
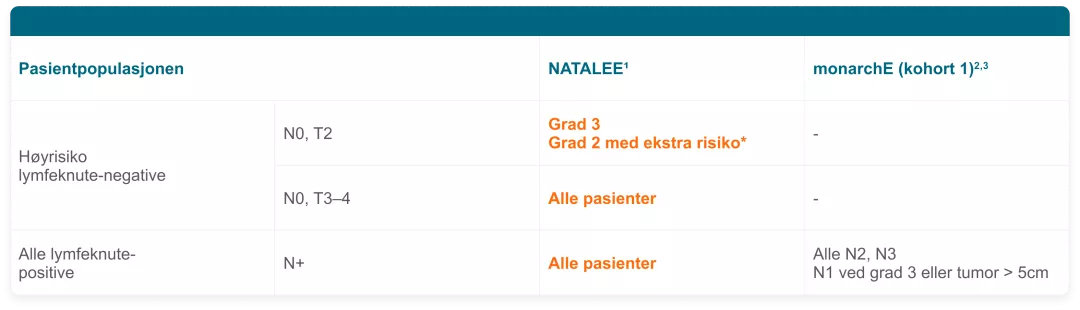

I mangel av head-to head forsøk, er sammenligning på tvers av studiene ikke tillatt.
* Ytterligere risikofaktorer, slik som: Ki-67-score ~20%, genekspresjonsanalyse med
Oncotype DX Breast Recurrence Score på ~26, eller høy-risiko score fra Prosigna/PAM50,
MammaPrint, eller EndoPredict/EPclin.
† monarchE cohort 2 inkluderte pasienter med N1 og Ki-67 ≥20%.2 Disse pasienter er ikke
inkludert i indikasjon.3
1: Slamon DJ, Fasching PA, Hurvitz S, et al. Rationale and trial design of NATALEE: a Phase III trial of adjuvant ribociclib + endocrine therapy versusendocrine therapy alone in patients
with HR+/HER2- early breast cancer. Ther Adv Med Oncol. 2023; 29;15:17588359231178125.
2: Harbeck N, Penault-Llorca F, Cortes J, et al. Breast cancer. Nat Rev Dis Primers. 2019;5(1):66. 3. Preparatomtale Verzenios (abemaciclib)
3: Preparatomtale Verzenios (abemaciclib)
Obligatorisk sikkerhetsinformasjon – kun for helsepersonell
Kisqali® (ribosiklib) er indisert til behandling av:
• Tidlig brystkreft: I kombinasjon med en aromatasehemmer til adjuvant behandling av pasienter med hormonreseptor (HR)-positiv, human epidermal vekstfaktorreseptor 2 (HER2)-negativ tidlig brystkreft, med høy risiko for tilbakefall. Se SPC pkt. 5.1 for seleksjonskriterier. Hos pre- eller perimenopausale kvinner, eller hos menn, skal aromatasehemmer kombineres med en luteiniserende hormonfrigjørende hormon (LHRH)-agonist.
• Avansert eller metastatisk brystkreft: I kombinasjon med aromatasehemmer eller fulvestrant til behandling av kvinner med HR-positiv, HER2-negativ lokalavansert eller metastatisk brystkreft, som innledende endokrinbasert behandling, eller hos kvinner som tidligere har fått endokrin behandling. Hos pre- eller perimenopausale kvinner skal endokrin behandling kombineres med en LHRH-agonist
Dosering:
• Tidlig brystkreft: 400 mg én gang daglig i 21 dager, deretter 7 dager pause (28-dagers syklus).
• Avansert/metastatisk brystkreft: 600 mg én gang daglig i 21 dager, deretter 7 dager pause (28-dagers syklus). Se SPC for detaljer om dosejustering ved bivirkninger.
Kontraindikasjoner: Overfølsomhet for innholdsstoffene, peanøtter eller soya.
Vanligste bivirkninger: Nøytropeni, infeksjoner, kvalme, fatigue, diaré, leukopeni, unormale leverfunksjonstester.
Forsiktighetsregler:
• Levertoksisitet: Ta leverfunksjonstest før oppstart, og overvåk under behandling.
• QT-forlengelse: EKG ved oppstart og dag 14 i første syklus. Bruk unngås ved eksisterende eller signifikant risiko for utvikling av QTc-forlengelse, og en forlengelse kan gi behandlingsavbrudd, dosereduksjon eller seponering.
• Lungesykdom: Vær oppmerksom på tegn til interstitiell lungesykdom/pneumonitt.
• Interaksjoner: Ribosiklib metaboliseres hovedsakelig via CYP3A4, og dosejustering kan være nødvendig.
Finansiering: Reseptgruppe C, H-resept: L01E F02_1. Vilkår (216). 2 Godkjent av Beslutningsforum for både tidlig og avansert/metastatisk brystkreft. Se SPC pkt. 5.1 for seleksjonskriterier.
Veiledende priser: 21 stk (blister): kr 17 772, 42 stk (blister): kr 35 509, 63 stk (blister): kr 53 246.
Se felleskatalogen for mer informasjon.
