Dette nettstedet er kun for helsepersonell som lege, offentlig godkjent sykepleier og farmasøyt
5-årsdata
5-årsdata fra NATALEE-studien bekrefter vedvarende klinisk nytte av Kisqali (ribosiklib) i kombinasjon med aromatasehemmer NSAI, med forbedret sykdomsfri overlevelse og en positiv trend i totaloverlevelse for pasienter med HR+/HER2− tidlig brystkreft.
Under årets ESMO-kongress i Berlin (17.–21. oktober) ble 5-årsdataene fra NATALEE-studien presentert.1 Disse dataene gir verdifull innsikt i langtidseffekten av ribosiklib (Kisqali) i kombinasjon med endokrin behandling for pasienter med HR+/HER2- tidlig brystkreft. Kisqali ble 25.august 2025 godkjent for hele NATALEE-populasjonen (se SPC seleksjonskriterier 5.1) av Beslutningsforum for HR+/HER2− tidlig brystkreft med høy risiko for tilbakefall.2,3 Ribosiklib brukes sammen med endokrin behandling (NSAI) for å redusere risikoen for tilbakefall hos pasienter med høyrisikofaktorer (f.eks. lymfeknuteinvolvering, stor tumor, høy Ki-67).3
Studiedesign og pasientpopulasjon
NATALEE-studien er en fase III, randomisert, åpen studie som evaluerer adjuvant behandling med ribociclib (Kisqali) kombinert med ikke-steroide aromatasehemmere (NSAI) hos pasienter med HR+/HER2− tidlig brystkreft.1,3 Studien inkluderte både lymfeknute-negative og lymfeknute-positive pasienter med høy risiko for tilbakefall. 1,3
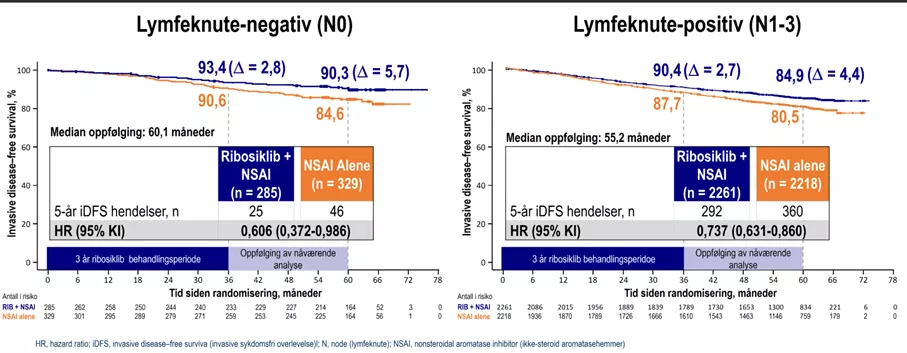
Figur 1: Invasiv sykdomsfri overlevelse (iDFS) etter lymfeknutestatus hos pasienter med HR+/HER2- tidlig brystkreft behandlet med ribociclib + NSAI versus NSAI alene. Venstre panel viser lymfeknute-negativ (N0) kohorte med median oppfølging på 60,1 måneder; høyre panel viser lymfeknute-positiv (N1–3) kohorte med median oppfølging på 55,2 måneder. Femårs iDFS-rater var høyere med ribociclib + NSAI sammenlignet med NSAI alene i begge grupper (N0: 93,4 % vs. 90,3 %, HR 0,606 [95 % KI: 0,372–0,986]; N1–3: 90,4 % vs. 84,9 %, HR 0,737 [95 % KI: 0,631–0,860]). Den blå linjen representerer ribociclib + NSAI, og den oransje linjen NSAI alene. Den grå boksen indikerer 3-årig behandlingsperiode med ribosiklib. Figur utarbeidet av Novartis etter Crown et al.1
Hovedfunn
• Langvarig beskyttelse mot tilbakefall: Ribosiklib kombinert med aromatasehemmer (NSAI) ga 28 % relativ risikoreduksjon for tilbakefall eller død sammenlignet med kontrollgruppen som kun fikk aromatasehemmer (HR: 0,716; 95 % KI: 0,618–0,829). Etter 5 år var 85,5 % sykdomsfrie i ribosiklib-gruppen mot 81,0 % i kontrollgruppen – en absolutt forbedring på 4,5 %. Effekten var stabil på tvers av ulike undergrupper og gjaldt en bred gruppe pasienter med høy risiko for tilbakefall.
• Unik effekt for pasienter uten spredning til lymfeknuter (N0): Ribosiklib er den eneste CDK4/6-hemmeren som har vist dokumentert klinisk nytte for pasienter med høyrisiko brystkreft uten spredning til lymfeknuter (N0). Dette er viktig fordi også disse pasientene kan ha betydelig risiko for tilbakefall, spesielt hvis svulsten har aggressive egenskaper.
• Redusert risiko for fjernspredning: Ribosiklib reduserte risikoen for fjernmetastaser (DDFS) med 30 % sammenlignet med kun NSAI (HR: 0,709; 95 % KI: 0,608–0,827), noe som betyr at flere pasienter kan leve uten at sykdommen sprer seg til andre organer.
• Tegn til økt totaloverlevelse (OS): Selv om oppfølgingstiden foreløpig er relativt kort (5 år), ser en fortsatt numerisk trend for forbedret totaloverlevelse (OS) til fordel for ribosiklib + NSAI (HR, 0,800; 95 % KI, 0,637–1,003; nominell P=0,026) Risikoen for å død var med andre ord 20 % lavere i ribosiklib-gruppen sammenlignet med NSAI. Med de nåværende 300 registrerte hendelsene er OS-dataene fortsatt under modning. Det blir spennende å følge utviklingen av Kaplan-Meier-kurvene de neste årene, ettersom lengre oppfølging kan gi enda tydeligere resultater. (Figur 2).
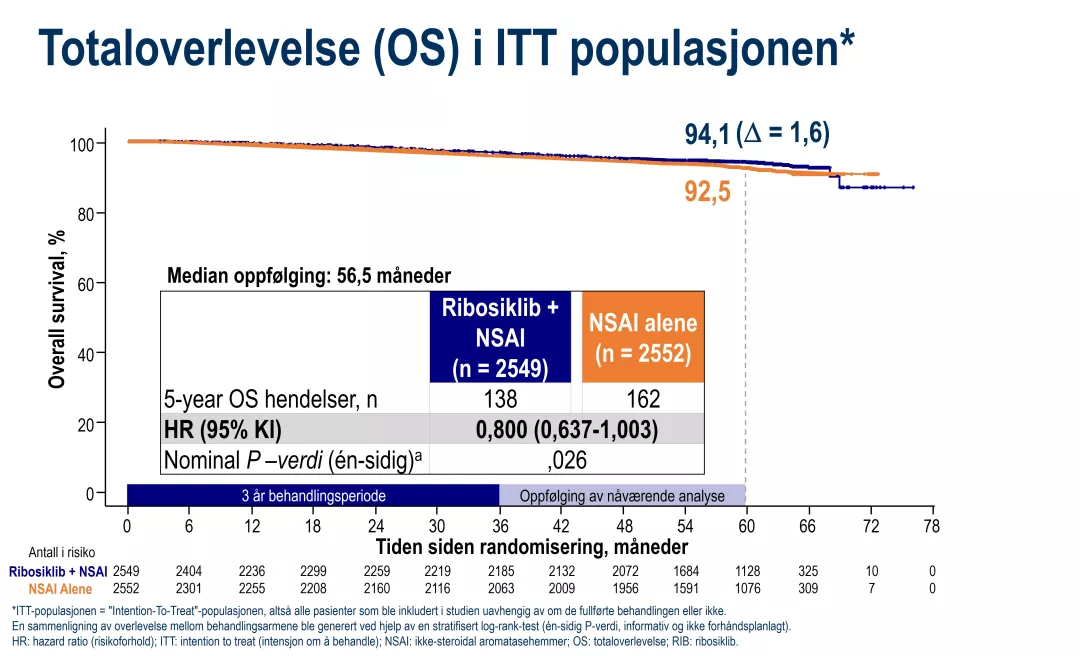
Figur 2: Totaloverlevelse OS. Figur utarbeidet av Novartis etter Crown et al.1
Subgruppeanalyser og klinisk betydning
Ribosiklib + NSAI viser effekt også hos pasienter med lymfeknute-negativ sykdom med biologisk høy risiko (f.eks. høy Ki-67, grad 3, Oncotype DX). Studien gir støtte til bruk av ribosiklib som adjuvant behandling for bredere pasientpopulasjoner enn tidligere studier som MonarchE. Ribosiklib har en forutsigbar sikkerhetsprofil, med håndterbare og stort sett reversible bivirkninger. Ingen nye sikkerhetssignal ble identifisert, Andelen pasienter som utviklet sekundære.
Klinisk vurdering og implikasjoner
Beslutningsforum for Nye Metoder godkjente 25. august 2025 Kisqali (ribosiklib) for adjuvant behandling av HR+/HER2- tidlig brystkreft for hele NATALEE-populasjonen, i tråd med seleksjonskriteriene beskrevet i SPC pkt. 5.1. Denne beslutningen gir norske pasienter med høy risiko for tilbakefall tilgang til en målrettet CDK4/6-hemmer som har vist vedvarende iDFS-fordel både hos lymfeknute-negative og -positive pasienter. Implementering av Kisqali i klinisk praksis forventes å redusere risikoen for invasivt tilbakefall og forbedre langtidsprognosen i denne pasientgruppen.
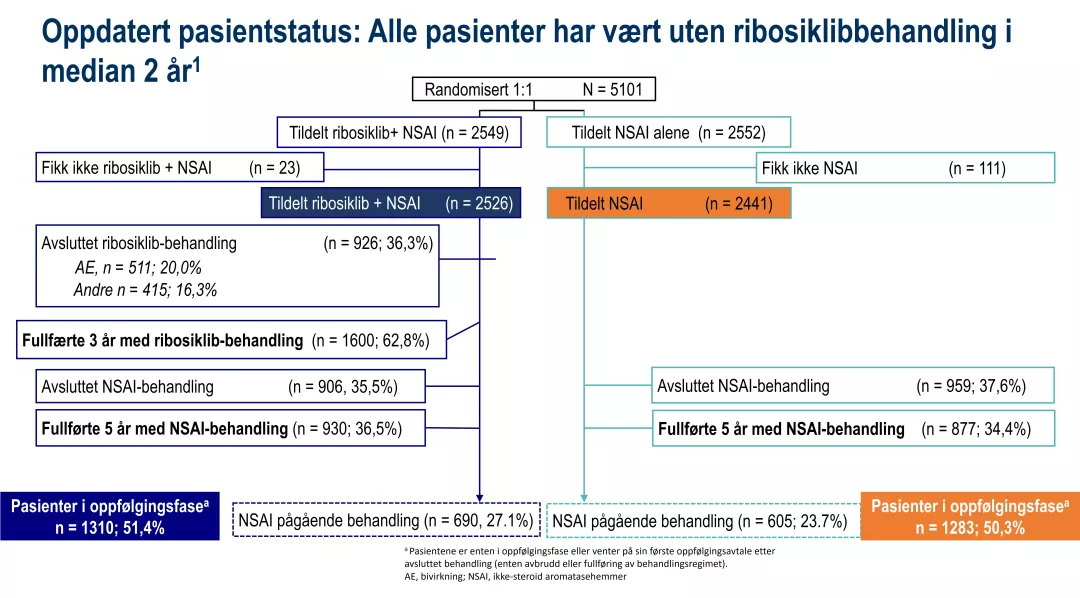
Pasientdisposisjon i NATALEE
Andelen pasienter som fullførte 5 år med NSAI-behandling var noe høyere i ribosiklib + NSAI-armen (36,5 %) sammenlignet med NSAI alene (34,4 %). Ved tidspunkt for analyse hadde 27,1 % fortsatt pågående NSAI-behandling i kombinasjonsarmen, mot 23,7 % i NSAI alene-armen. Avslutning av NSAI-behandling forekom i tilsvarende grad i begge grupper (ribosiklib + NSAI: 35,5 %; NSAI alene: 37,6 %).
Det var med andre ord ikke flere som avsluttet NSAI-behandling i kombinasjonsarmen – faktisk noe færre. Dette indikerer at tillegg av ribosiklib ikke fører til økt frafall fra NSAI-behandling sammenlignet med NSAI alene. Videre hadde seponering av ribosiklib ingen negativ innvirkning på fullføringsgraden for NSAI, noe som understøtter god tolerabilitet og gjennomførbarhet av kombinasjonsbehandlingen i klinisk praksis.1
Kisqali - Ledende klinisk nytte dokumentert av ESMO-MCBS
Kisqali har oppnådd den høyeste vurderingen (A) på European Society for Medical Oncology – Magnitude of Clinical Benefit Scale (ESMO-MCBS) for tidlig brystkreft.6 I avansert HR+/HER2- brystkreft har Kisqali den høyeste rangeringen blant CDK4/6-hemmere, med score 4 av 5 for førstelinjebehandling av premenopausale pasienter.7 Videre har Kisqali i kombinasjon med enten letrozol eller fulvestrant, som den eneste blant CDK4/6-hemmere, fått en score på fire av fem for postmenopausale pasienter med HR+/HER2- avansert brystkreft behandlet i førstelinje.8
Referanser:
1: Crown J, Stroyakovskii D, Yardley DA, Huang CS, Fasching PA, Bardia A, et al. Adjuvant ribociclib plus nonsteroidal aromatase inhibitor therapy in patients with HR-positive/HER2-negative early breast cancer: 5-year follow-up of NATALEE efficacy outcomes and updated overall survival. ESMO Open. 2025;10:105858.
2: Crown J, Stroyakovskii D, Yardley DA, Huang CS, Fasching PA, Bardia A, et al. Adjuvant ribociclib plus nonsteroidal aromatase inhibitor therapy in patients with HR-positive/HER2-negative early breast cancer: 5-year follow-up of NATALEE efficacy outcomes and updated overall survival. Supplementary appendix. Figure S1. ESMO Open. 2025;10:105858.
3: European Medicine Agency. Preparatomtale (SPC) Kisqali (ribosiklib). Tilgjengelig fra: https://www.ema.europa.eu/no/documents/product-information/kisqali-epar-product-information_no.pdf
4: European Society for Medical Oncology (ESMO). ESMO MCBS scorecards; NATALEE [Internett]. Lugano (CH): ESMO; [sitert 2025 Oktober]. Tilgjengelig fra: https://www.esmo.org/guidelines/esmo-mcbs/esmo-mcbs-scorecards
5: European Society for Medical Oncology (ESMO). ESMO-Magnitude of Clinical Benefit Scale (ESMO-MCBS) Booklet. Version 1.1. Lugano: ESMO; 2017. Tilgjengelig fra: ESMO-MCBS Booklet
6: European Society of Medical Oncology (ESMO). ESMO MCBS scorecards; NATALEE. Hentet Oktober 2025. Tilgjengelig fra: https://www.esmo.org/guidelines/esmo-mcbs/esmo-mcbs-for-solid-tumours/esmo-mcbs-scorecards/scorecard-468-1
7: European Society for Medical Oncology. Magnitude of Clinical Benefit Scale Scorecard. Hentet oktober 2025. Tilgjengelig fra: https://www.esmo.org/guidelines/esmo-mcbs/esmo-mcbs-for-solid-tumours/esmo-mcbs-scorecards?scorecard=158-1
8: European Society for Medical Oncology. Magnitude of Clinical Benefit Scale Scorecard. Hentet oktober 2025. Tilgjengelig fra: https://www.esmo.org/guidelines/esmo-mcbs/esmo-mcbs-for-solid-tumours/esmo-mcbs-scorecards?scorecard=9-1
Obligatorisk sikkerhetsinformasjon – kun for helsepersonell
Kisqali® (ribosiklib) er indisert til behandling av:
• Tidlig brystkreft: I kombinasjon med en aromatasehemmer til adjuvant behandling av pasienter med hormonreseptor (HR)-positiv, human epidermal vekstfaktorreseptor 2 (HER2)-negativ tidlig brystkreft, med høy risiko for tilbakefall. Se SPC pkt. 5.1 for seleksjonskriterier. Hos pre- eller perimenopausale kvinner, eller hos menn, skal aromatasehemmer kombineres med en luteiniserende hormonfrigjørende hormon (LHRH)-agonist.
• Avansert eller metastatisk brystkreft: I kombinasjon med aromatasehemmer eller fulvestrant til behandling av kvinner med HR-positiv, HER2-negativ lokalavansert eller metastatisk brystkreft, som innledende endokrinbasert behandling, eller hos kvinner som tidligere har fått endokrin behandling. Hos pre- eller perimenopausale kvinner skal endokrin behandling kombineres med en LHRH-agonist
Dosering:
• Tidlig brystkreft: 400 mg én gang daglig i 21 dager, deretter 7 dager pause (28-dagers syklus).
• Avansert/metastatisk brystkreft: 600 mg én gang daglig i 21 dager, deretter 7 dager pause (28-dagers syklus). Se SPC for detaljer om dosejustering ved bivirkninger.
Kontraindikasjoner: Overfølsomhet for innholdsstoffene, peanøtter eller soya.
Vanligste bivirkninger: Nøytropeni, infeksjoner, kvalme, fatigue, diaré, leukopeni, unormale leverfunksjonstester.
Forsiktighetsregler:
• Levertoksisitet: Ta leverfunksjonstest før oppstart, og overvåk under behandling.
• QT-forlengelse: EKG ved oppstart og dag 14 i første syklus. Bruk unngås ved eksisterende eller signifikant risiko for utvikling av QTc-forlengelse, og en forlengelse kan gi behandlingsavbrudd, dosereduksjon eller seponering.
• Lungesykdom: Vær oppmerksom på tegn til interstitiell lungesykdom/pneumonitt.
• Interaksjoner: Ribosiklib metaboliseres hovedsakelig via CYP3A4, og dosejustering kan være nødvendig.
Finansiering: Reseptgruppe C, H-resept: L01E F02_1. Vilkår (216). 2 Godkjent av Beslutningsforum for både tidlig og avansert/metastatisk brystkreft. Se SPC pkt. 5.1 for seleksjonskriterier.
Veiledende priser: 21 stk (blister): kr 17 772, 42 stk (blister): kr 35 509, 63 stk (blister): kr 53 246.
Se felleskatalogen for mer informasjon.
