パンくず
「警告・禁忌を含む注意事項等情報」等はこちらをご参照ください。
国際共同第Ⅲ相試験 C12302/APPLY-PNH試験
社内資料:国際共同第Ⅲ相試験(C12302/APPLY-PNH試験)(承認時評価資料)
Peffault de Latour R, et al. N Engl J Med. 2024; 390(11): 994-1008.(本研究はノバルティスから資金提供及び支援を受けた。著者の中にはノバルティスの社員が含まれる。)
試験概要
試験デザイン
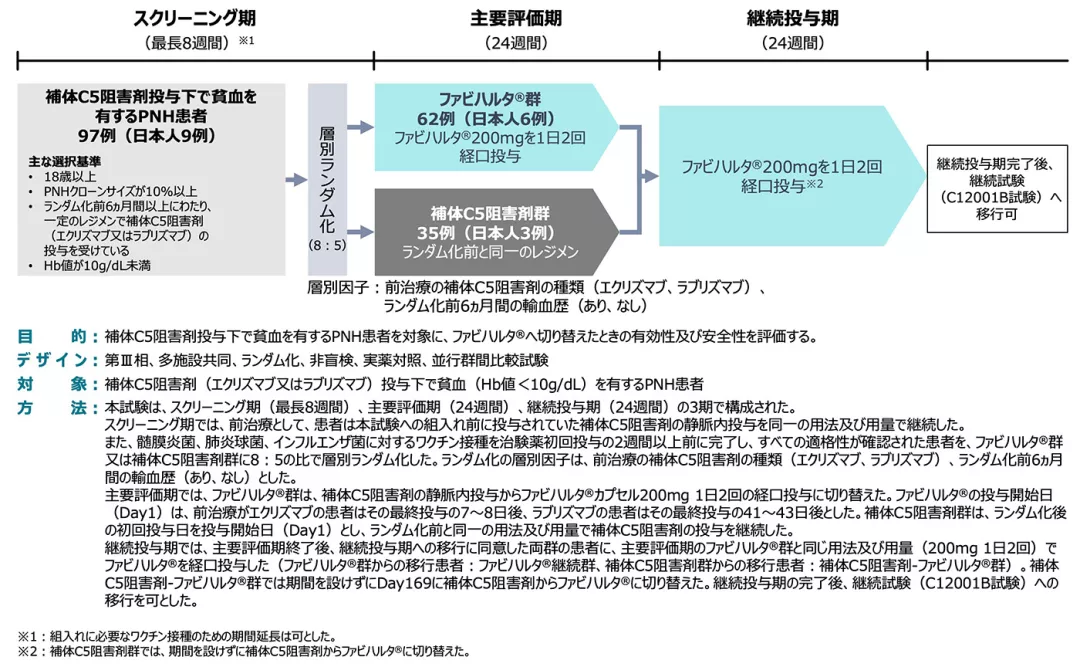
評価項目

解析計画

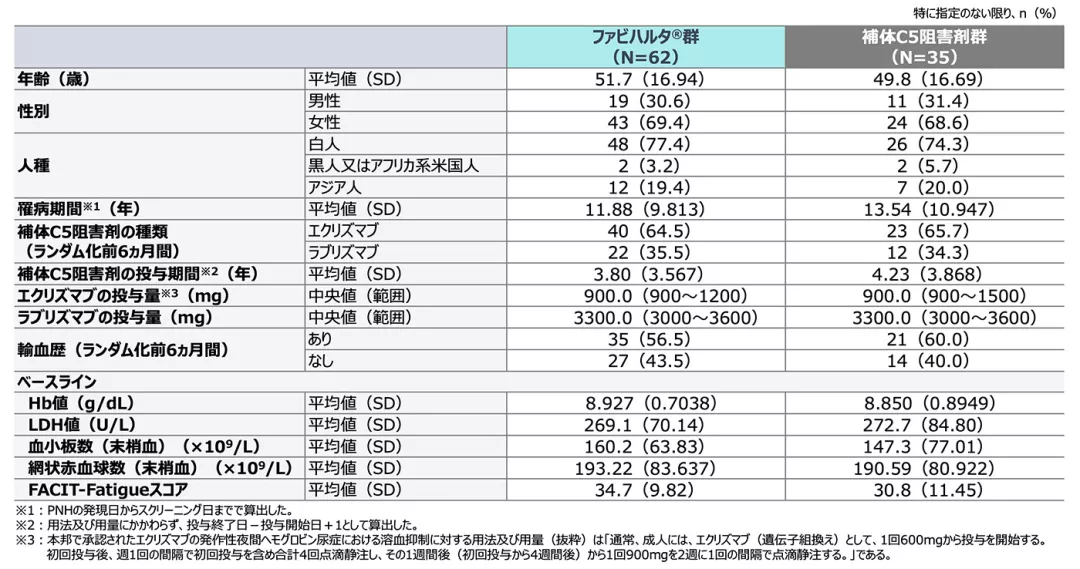
患者背景
患者背景(FAS):
有効性
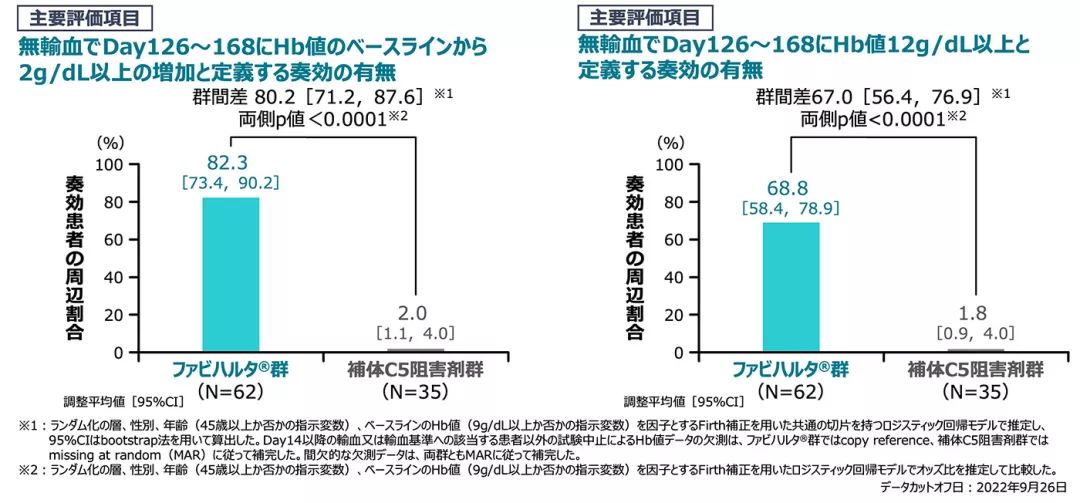
【主要評価項目】[検証的解析結果]
無輸血でDay126~168にHb値がベースラインから2g/dL以上の増加と定義する奏効の有無(主要評価期、FAS)
【主要評価項目】[検証的解析結果]
無輸血でDay126~168にHb値12g/dL以上と定義する奏効の有無(主要評価期、FAS)
無輸血でDay126~168にHb値が2g/dL以上増加した患者の周辺割合*の群間差は80.2%であり、ファビハルタ®群の補体C5阻害剤群に対する優越性が検証されました[両側p値<0.0001]。
無輸血でDay126~168に、Hb値12g/dL以上の患者の周辺割合の群間差は67.0%であり、ファビハルタ®群の補体C5阻害剤群に対する優越性が検証されました[両側p値<0.0001]。
*奏効確率の集団平均値。共変量の調整や欠測値の補完が考慮された奏効患者の割合と解釈した。
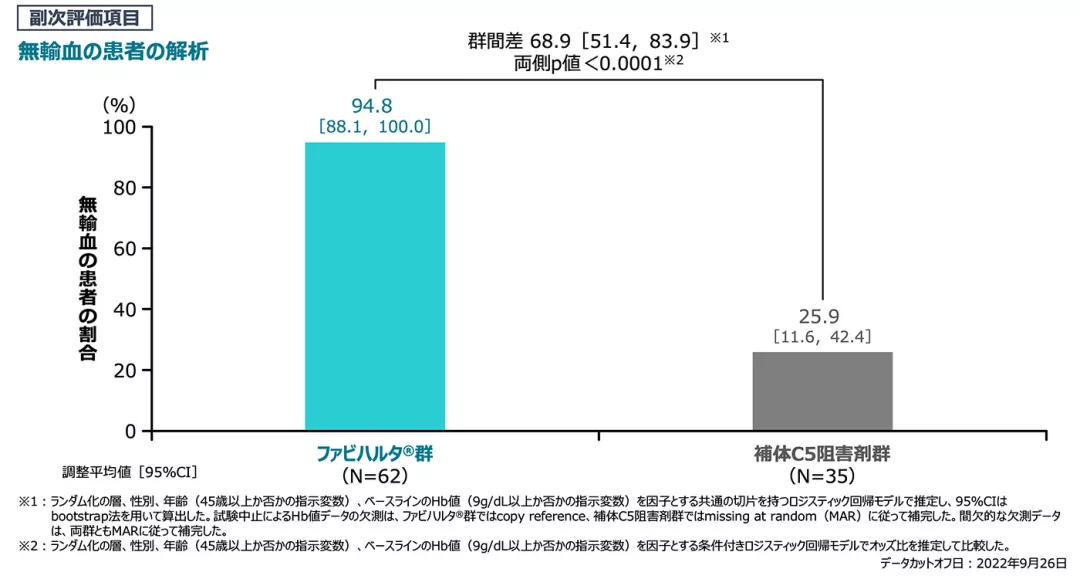
【副次評価項目】[検証的解析結果]
輸血回避(無輸血)(主要評価期、FAS)
無輸血の患者の周辺割合のモデルに基づく推定群間差は68.9%であり、ファビハルタ®群の補体C5阻害剤群に対する優越性が検証されました[両側p値<0.0001]。
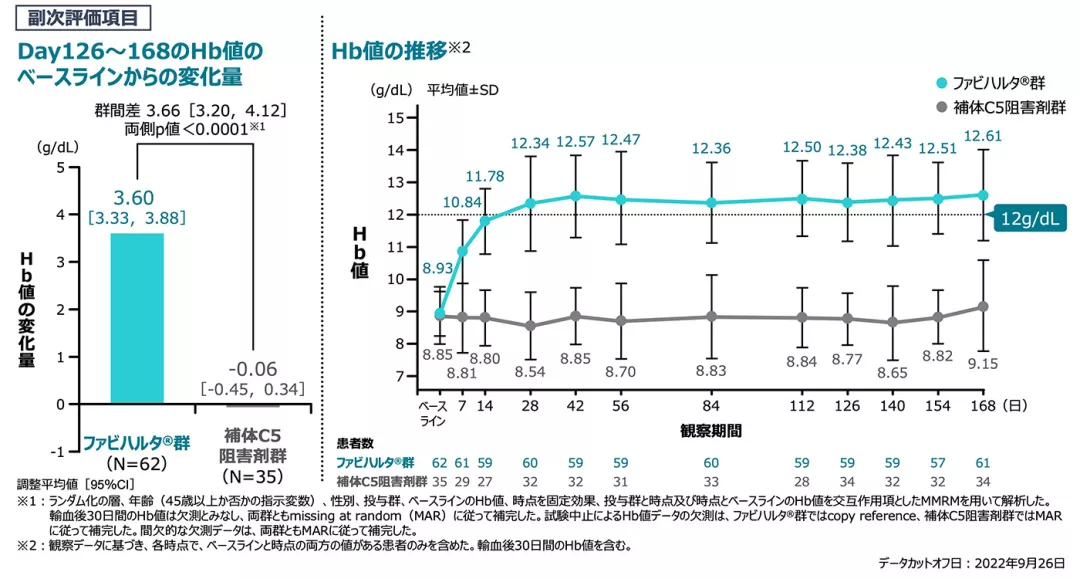
【副次評価項目】[検証的解析結果]
Hb値のベースラインからの変化量(主要評価期、FAS)
Day126~168のHb値のベースラインからの変化量の調整平均値の群間差は+3.66g/dLであり、ファビハルタ®群の補体C5阻害剤群に対する優越性が検証されました[両側p値<0.0001]。
【副次評価項目】[検証的解析結果]
FACIT-Fatigueスコアのベースラインからの変化量(主要評価期、FAS)
Day126~168のFACIT-Fatigueスコアのベースラインからの変化量の群間差は+8.29であり、ファビハルタ®群の補体C5阻害剤群に対する優越性が検証されました[両側p値<0.0001]。
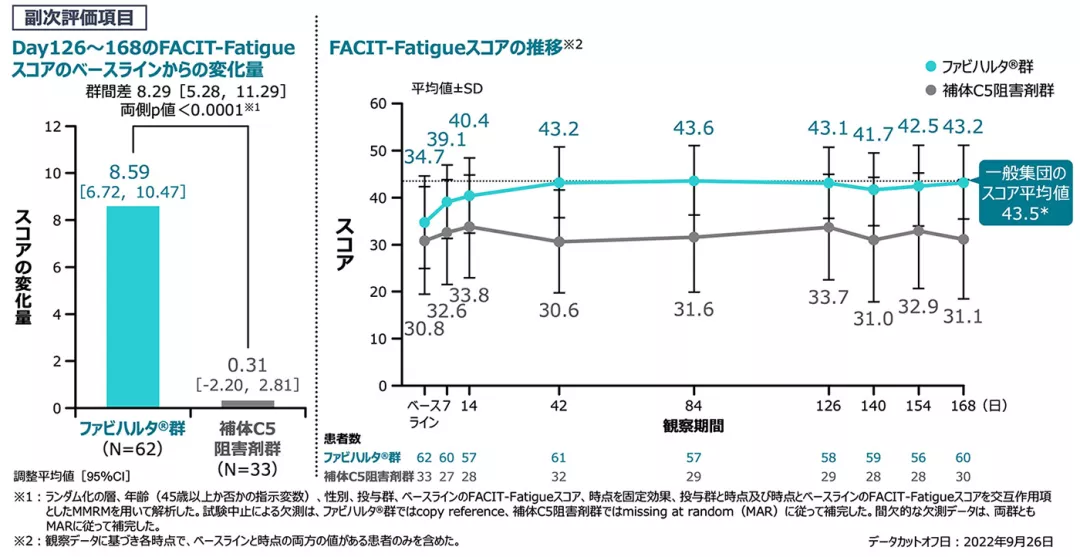
【副次評価項目】[検証的解析結果]
LDH値の対ベースライン比(主要評価期、FAS)
Day126~168のLDH値の対ベースライン比※1の調整幾何平均値の群間比は0.99であり、ファビハルタ®群の補体C5阻害剤群に対する優越性は検証されませんでした[両側p値=0.8361※1]。
ベースラインのLDH(観察値)の平均は、ファビハルタ®群で269.1U/L、補体C5阻害剤群で272.7U/Lでした。
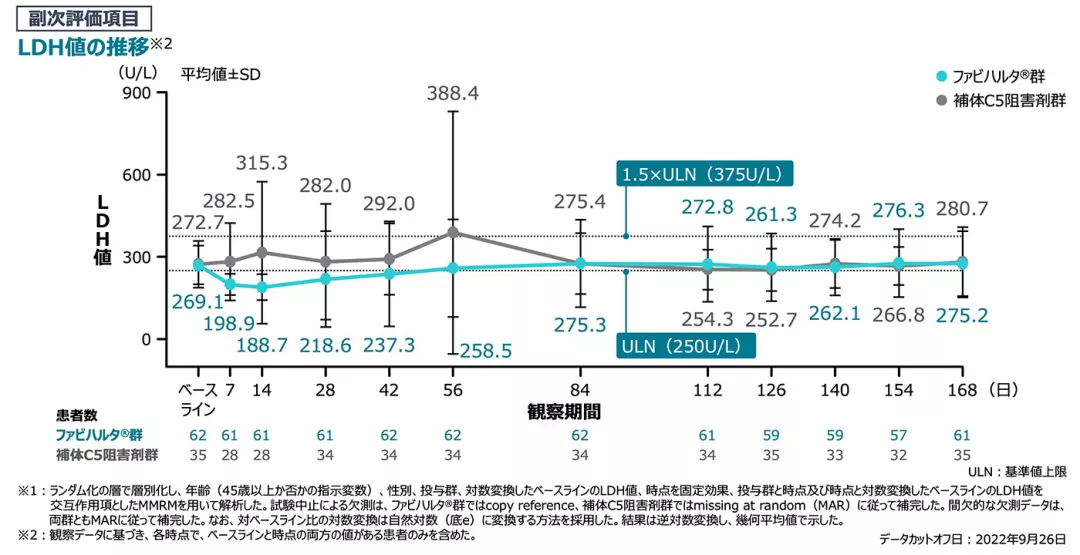
【副次評価項目】[検証的解析結果]
臨床的BTHの発現(主要評価期、FAS)
臨床的BTHは、Day1~168にファビハルタ®群で62例中2例、補体C5阻害剤群で35例中6例に発現しました。
Day1~168の臨床的BTHの調整年間発現率の群間比は0.10であり、ファビハルタ®群の補体C5阻害剤群に対する優越性が検証されました[両側p値=0.01183]。

安全性
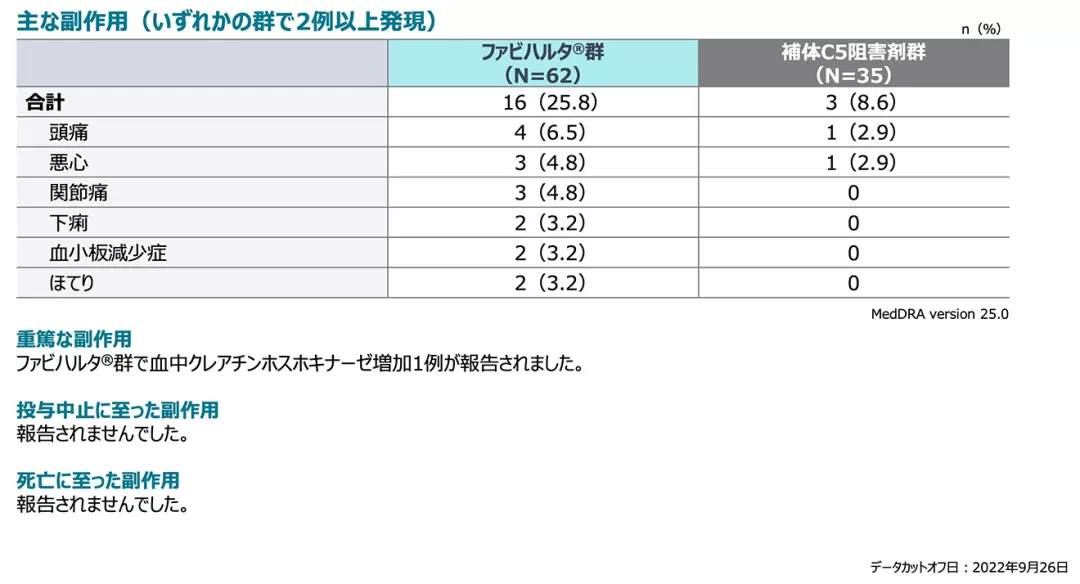
副作用(主要評価期、SAF)
副作用の発現率は、ファビハルタ®群25.8%(16/62例)、補体C5阻害剤群8.6%(3/35例)でした。
重篤な副作用はファビハルタ®群で血中クレアチンホスホキナーゼ増加1例が報告されました。投与中止に至った副作用、死亡に至った副作用は報告されませんでした。
より詳細な情報を知りたい方はこちら
Web面談予約
デジタルコミュニケーターとのWeb面談予約は24時間お申し込みが可能
製品に関する情報
会員限定コンテンツ
