パンくず
ベオビュ 増殖糖尿病網膜症(PDR)
日本人を含む国際共同第Ⅲ相試験(CONDOR:D2301試験)23、24)
23)社内資料:国際共同第Ⅲ相試験(D2301試験)[20250006] 承認時評価資料
24)社内資料:国際共同第Ⅲ相試験(D2301試験)[20250145] 承認時評価資料
安全性
治験薬の曝露状況
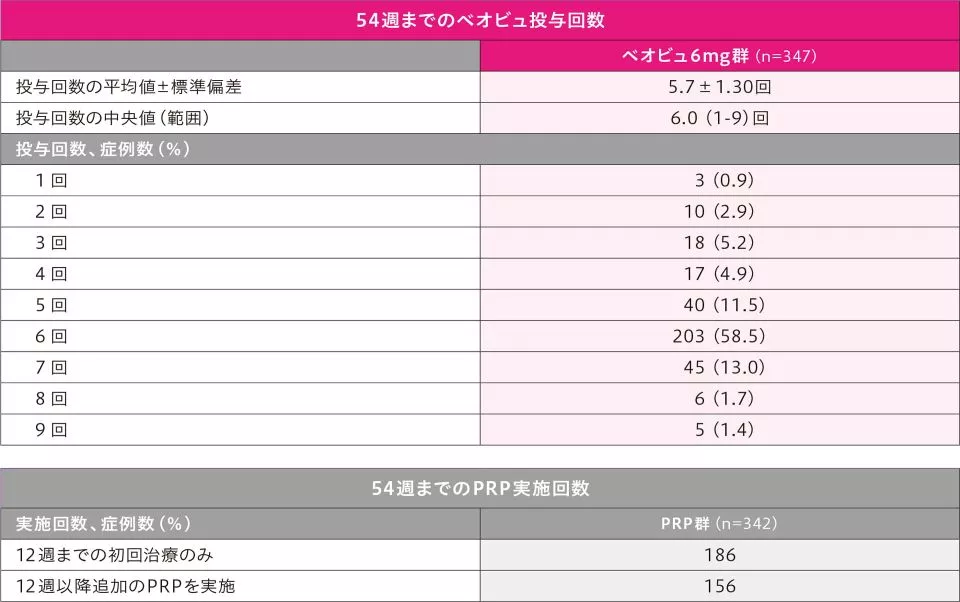
54週までのベオビュの投与状況及びPRPの実施状況は以下のとおりです。
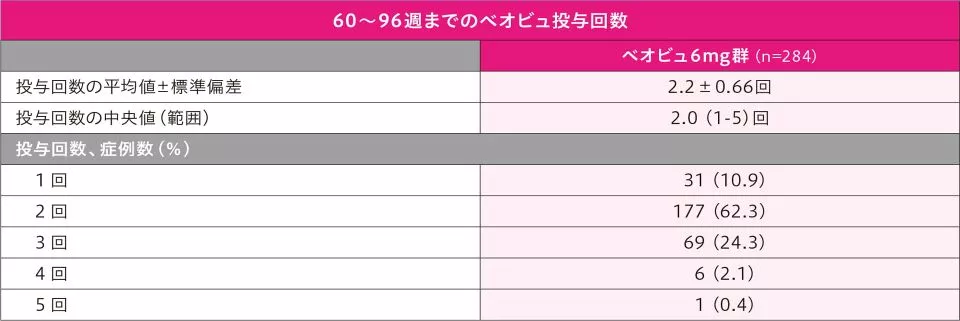
60~96週までのベオビュの投与状況は以下のとおりです。
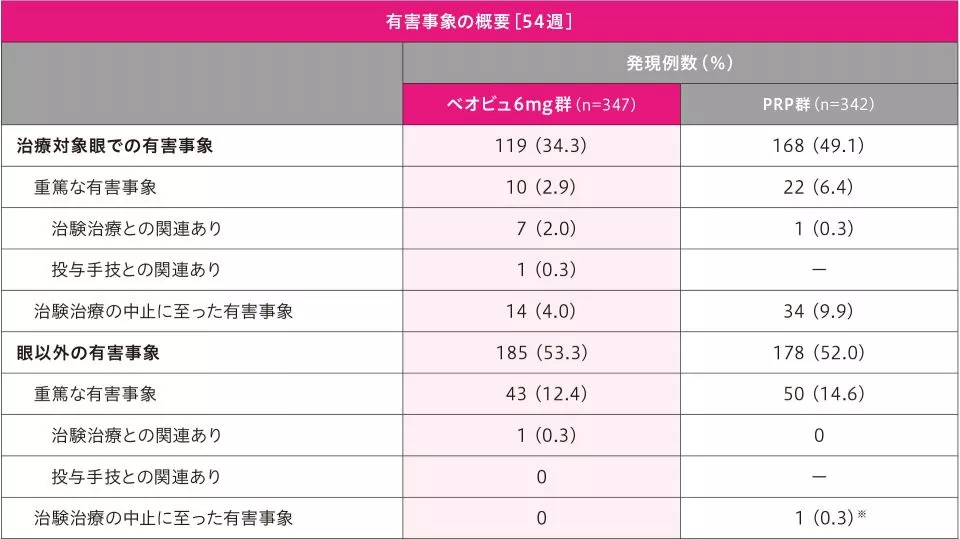
副作用[54週]
治療対象眼
54週までの治療対象眼における「治験治療との関連あり」とされた副作用の発現率は、ベオビュ6mg群7.2%(25/347例)、PRP群8.8%(30/342例)で、主な副作用は硝子体出血〔ベオビュ6mg群2.0%(7/347例)、PRP群2.0%(7/342例)、以下同順〕、黄斑浮腫〔0.3%(1/347例)、3.2%(11/342例)〕、ぶどう膜炎〔1.4%(5/347例)、0〕、眼痛〔0、1.5%(5/342例)〕、虹彩毛様体炎〔1.2%(4/347例)、0〕、糖尿病性網膜浮腫〔0、1.2%(4/342例)〕でした。
また、ベオビュ6mg群で「治験薬投与手技との関連あり」とされた副作用の発現率は、4.3%(15/347例)で、主な副作用は結膜出血〔1.4%(5/347例)〕でした。
重篤な副作用は、「治験治療との関連あり」として閉塞性網膜血管炎、ぶどう膜炎、硝子体出血(ベオビュ6mg群各2例)、眼内炎(ベオビュ6mg群1例)、黄斑浮腫(PRP群1例)が、「治験薬投与手技との関連あり」として眼内炎(ベオビュ6mg群1例)が認められました。
治験治療中止に至った副作用は、「治験治療との関連あり」として、ベオビュ6mg群7例(ぶどう膜炎4例、閉塞性網膜血管炎2例、硝子体炎1例)、PRP群3例(黄斑浮腫3例)に、「治験治療及び治験薬投与手技との関連あり」としてベオビュ6mg群4例(虹彩毛様体炎、眼内炎、硝子体出血、網膜血管炎各1例)に認められました。
眼以外
54週までの眼以外の副作用(治験治療との関連あり)の発現率は、ベオビュ6mg群0.3%(1/347例)、PRP群0.6%(2/342例)で、脳梗塞〔ベオビュ6mg群0.3%(1/347例)〕、嘔吐、処置による頭痛〔PRP群各0.3%(1/342例)〕でした。
重篤な副作用(治験治療との関連あり)は、脳梗塞(ベオビュ6mg群1例)が認められました。
治験治療中止に至った副作用(治験治療との関連あり)は、認められませんでした。
死亡は9例(ベオビュ6mg群6例、PRP群3例)で、いずれも治験治療との関連なしと判断されました。
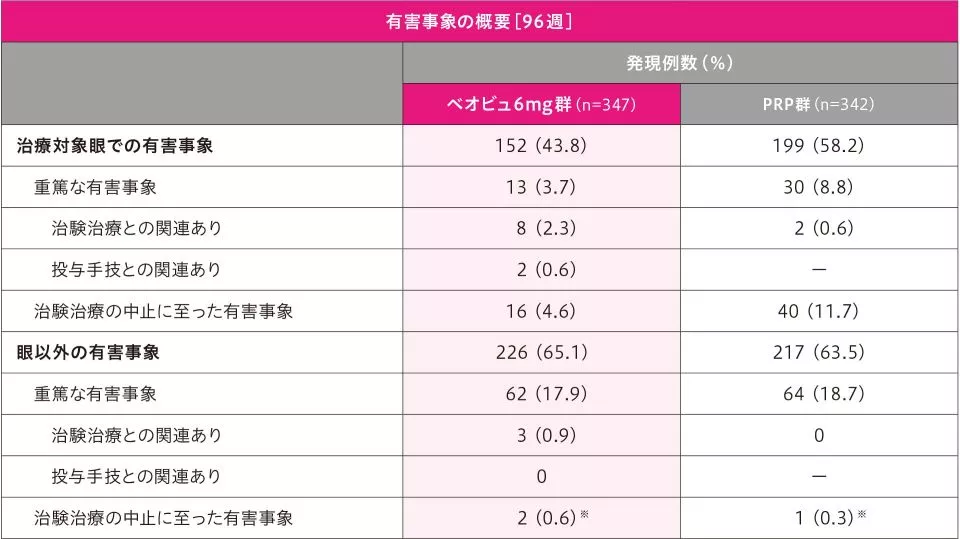
副作用[96週]
治療対象眼
96週までの治療対象眼における「治験治療との関連あり」とされた副作用の発現率は、ベオビュ6mg群8.1%(28/347例)、PRP群9.6%(33/342例)で、主な副作用は硝子体出血〔ベオビュ6mg群2.0%(7/347例)、PRP群2.3%(8/342例)、以下同順〕、黄斑浮腫〔0.3%(1/347例)、3.2%(11/342例)〕、ぶどう膜炎〔1.7%(6/347例)、0〕、眼痛〔0、1.8%(6/342例)〕、虹彩毛様体炎〔1.2%(4/347例)、0〕、糖尿病性網膜浮腫〔0、1.2%(4/342例)〕でした。また、ベオビュ6mg群で「治験薬投与手技との関連あり」とされた副作用の発現率は、5.8%(20/347例)で、主な副作用は結膜出血〔1.7%(6/347例)〕、眼圧上昇〔1.4%(5/347例)〕でした。
重篤な副作用は、「治験治療との関連あり」としてぶどう膜炎(ベオビュ6mg群3例)、閉塞性網膜血管炎、硝子体出血(ベオビュ6mg群各2例)、網膜血管炎、眼内炎(ベオビュ6mg群各1例)、黄斑浮腫、牽引性網膜剥離(PRP群各1例)が、「治験薬投与手技との関連あり」として網膜血管炎及びぶどう膜炎、眼内炎(ベオビュ6mg群各1例)が認められました。
治験治療中止に至った副作用は、「治験治療との関連あり」として、ベオビュ6mg群7例(ぶどう膜炎4例、閉塞性網膜血管炎2例、硝子体炎1例)、PRP群3例(黄斑浮腫3例)に、「治験治療及び治験薬投与手技との関連あり」としてベオビュ6mg群5例(網膜血管炎2例、虹彩毛様体炎、眼内炎、硝子体出血各1例)に認められました。
眼以外
96週までの眼以外の副作用(治験治療との関連あり)の発現率は、ベオビュ6mg群0.9%(3/347例)、PRP群0.6%(2/342例)で、脳梗塞〔ベオビュ6mg群0.9%(3/347例)〕、嘔吐、処置による頭痛〔PRP群各0.3%(1/342例)でした。
重篤な副作用(治験治療との関連あり)は、脳梗塞(ベオビュ6mg群3例)が認められました。
治験治療中止に至った副作用(治験治療との関連あり)は、認められませんでした。
死亡は17例(ベオビュ6mg群8例、PRP群9例)で、いずれも治験治療または治験薬投与手技との関連なしと判断されました。
※治験治療との関連はなしと判断された
日本において承認されたベオビュの用法及び用量(抜粋) 日本において承認されたベオビュの用法及び用量に関連する注意(抜粋) 〈増殖糖尿病網膜症〉 |
※投与群を因子、対応する評価項目のベースライン値を共変量とした
