パンくず
ベオビュ 増殖糖尿病網膜症(PDR)
日本人を含む国際共同第Ⅲ相試験(CONDOR:D2301試験)23、24)
23)社内資料:国際共同第Ⅲ相試験(D2301試験)[20250006] 承認時評価資料
24)社内資料:国際共同第Ⅲ相試験(D2301試験)[20250145] 承認時評価資料
試験方法
目的
54週の最高矯正視力スコアのベースラインからの変化量に関して、ベオビュ6mgの汎網膜光凝固(PRP)に対する非劣性を検証する。
試験対象
18歳以上で治療対象眼※1が増殖糖尿病網膜症※2による視力障害を有する患者689例(うち日本人患者は50例)
試験デザイン
多施設共同単遮蔽無作為化並行群間比較試験(検証試験)
試験方法
患者をベオビュ6mg群またはPRP群のいずれかに1:1の比で無作為化し、ベオビュを硝子体内に投与またはPRPを実施した。
ベオビュ6mgは6週ごとに3回導入投与した後、維持投与として12週ごとに90週まで投与した。規定来院日に疾患活動性評価を行い、疾患活動性が認められた場合は6週ごとの投与も可能とし、48週以降は、疾患活動性評価に基づき、投与間隔を一度に6週ずつ、最大24週ごとまで延長、また12週ごと投与に戻すことも可能とした。
PRPは初回治療を1~4セッションに分けて12週時までに終了するよう実施した。その後必要な場合は、90週までに必要に応じ2~4セッションに分けて、追加実施可能とした。
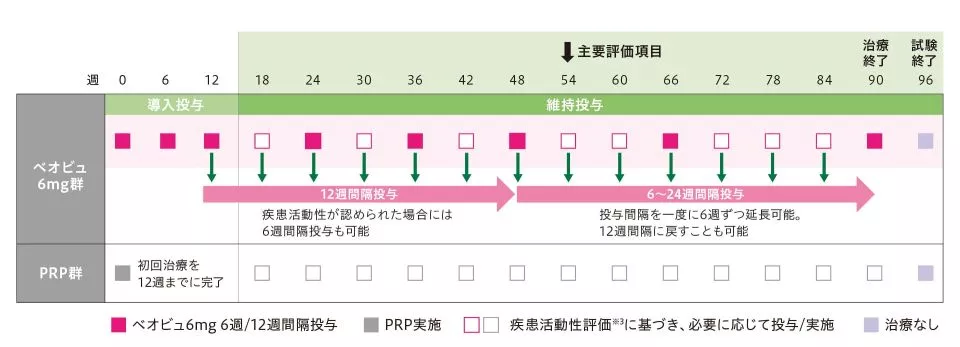
※3 疾患活動性の評価
視力や網膜画像に基づき評価された。
主要評価項目
最高矯正視力スコア※4のベースラインからの変化量(54週)(検証的な解析項目)
主要な副次評価項目
- 増殖糖尿病網膜症が認められない患者の割合(54週)(検証的な解析項目)
- 中心窩を含む糖尿病黄斑浮腫※5が認められた患者の割合(54週まで)(検証的な解析項目)
その他の副次評価項目
- 最高矯正視力スコア※4のベースラインからの変化量(96週)
- 最高矯正視力スコア※4のベースラインからの変化量のAUC※6(6~54週及び6~96週)
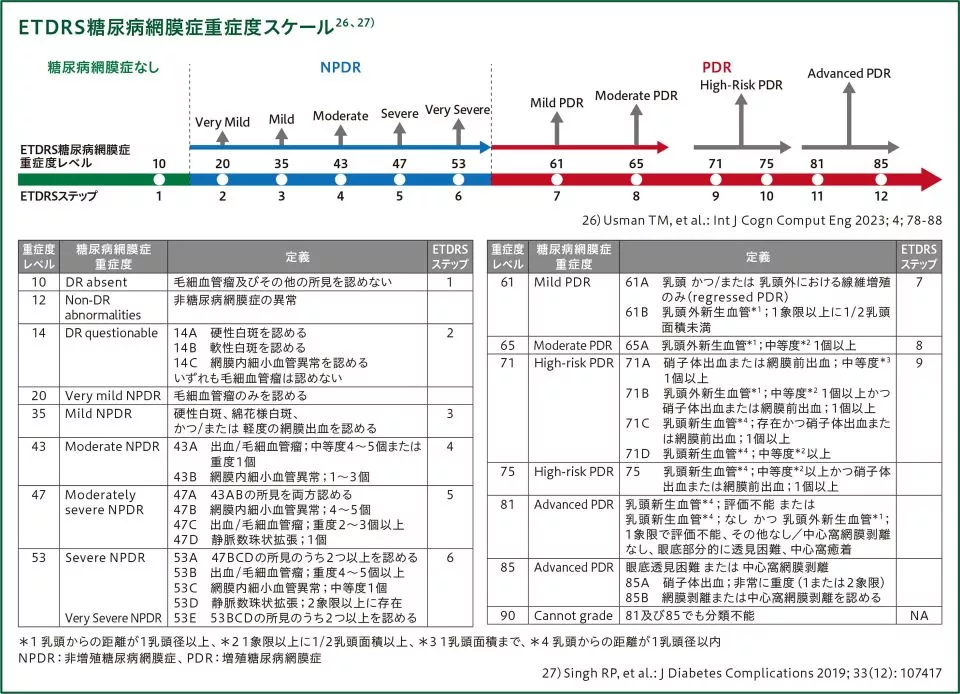
- ETDRS糖尿病網膜症重症度のベースラインからの変化量(2段階以上または3段階以上の改善及び悪化)(54週及び96週)
[ ETDRS糖尿病網膜症重症度がベースラインから2段階以上改善した患者の割合(54週):検証的な解析項目] - 増殖糖尿病網膜症が認められない患者の割合(96週)
- 糖尿病網膜症に伴う視力を脅かす合併症※7を発症した患者の割合(54週及び96週まで)
- 中心窩を含む糖尿病黄斑浮腫※5が認められた患者の割合(96週まで)
探索的評価項目
- PRPよりも硝子体内投与に選好性を示す患者の割合※8
- 追加投与※9を要さず12週間隔投与を維持した患者の割合(54週)(ベオビュ群のみ)
- 最終投与間隔18週及び24週の患者で疾患活動性※3が認められない患者の割合(ベオビュ群のみ)
- 視力関連QOL:NEI VFQ-28R(National Eye Institute Vison Function Questionnaire-28-R)※10、25)スコアのベースラインからの変化量(54週及び96週)
- 周辺視野のベースラインからの変化量(96週まで)
※4 ETDRS文字スコア(ETDRS視力検査表を用いて測定開始距離4mで評価)
※5 光干渉断層撮影画像の中心サブフィールド厚≧280μmと定義
※6 [(6~54週時までの最高矯正視力スコアの和)/(6~54週時までの有効な最高矯正視力スコアデータが得られた来院回数)]-(ベースラインの最高矯正視力スコア)で算出(6~54週)。6~96週についても同様の方法で算出
※7 ベースライン後のいずれかの時点で発症した中心窩に及ぶ糖尿病黄斑浮腫、網膜剥離、硝子体出血、血管新生緑内障、虹彩または前房隅角の血管新生、及び糖尿病網膜症合併症に対する硝子体切除術と定義
※8 両眼に疾患を有し、硝子体内投与及びPRPを各眼に受けた患者において、Patient Preference Questionnaireを用いた治療満足度評価で、一貫して硝子体内投与を好んだ患者の割合及び一貫してPRPを好んだ患者の割合
※9 予定された12週間隔投与の来院以外での投与と定義
※10 NEI VFQ-25の改訂版で、活動制限(19項目)と社会情緒的機能(9項目)により構成される
安全性評価項目
有害事象、眼科学的検査、臨床検査、バイタルサイン
解析計画
| 主要評価項目 |
|---|
| 主要な副次評価項目 |
|---|
| その他の副次評価項目 |
|---|
| 探索的評価項目 |
|---|
日本において承認されたベオビュの用法及び用量(抜粋) 日本において承認されたベオビュの用法及び用量に関連する注意(抜粋) 〈増殖糖尿病網膜症〉 |
患者背景及び治療対象眼の主なベースライン特性
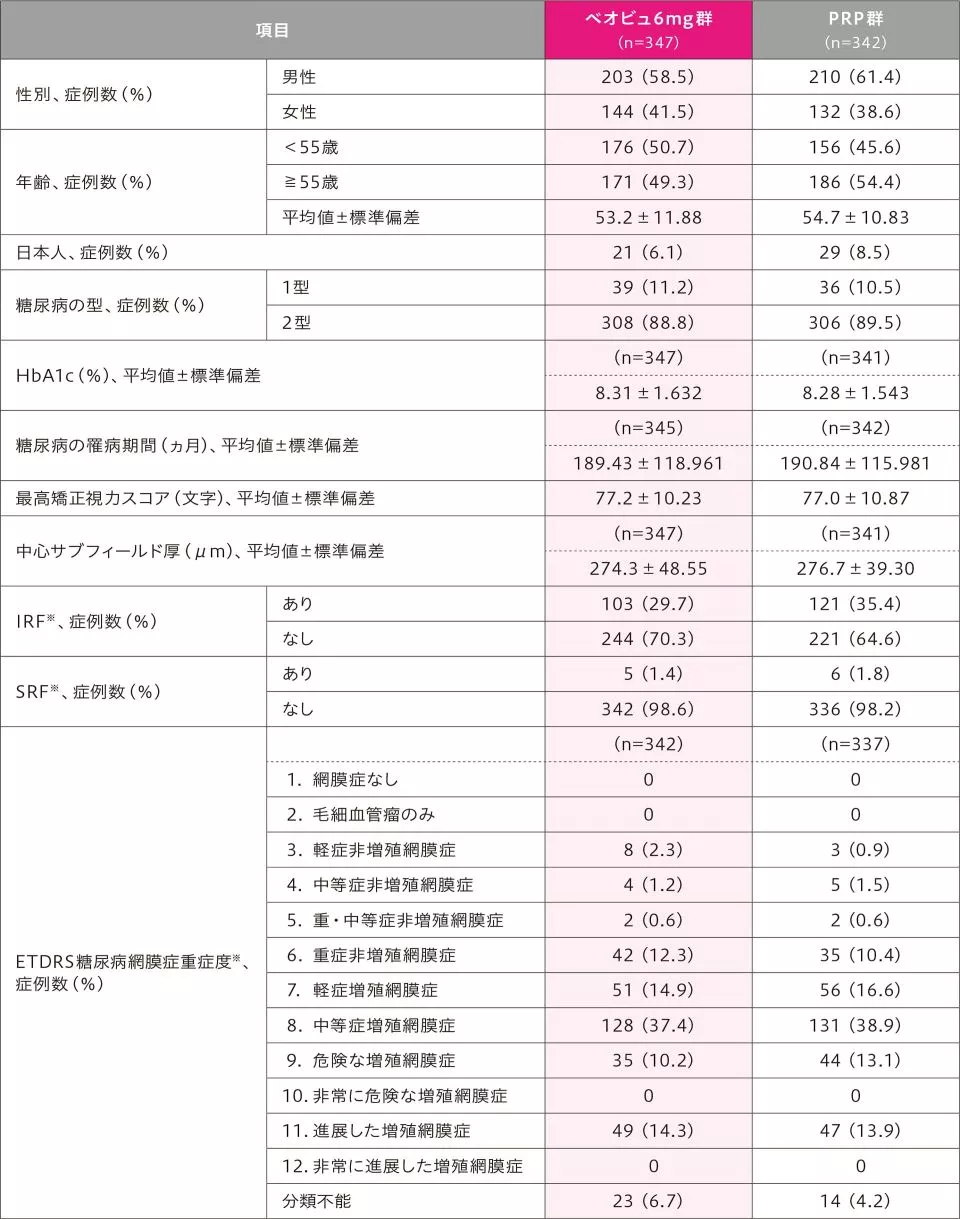
※ 中央リーディングセンターで評価された分類。
被験眼に増殖糖尿病網膜症が存在すること及び中心窩を含む糖尿病黄斑浮腫が存在しないことを治験担当医師により確認された患者が本試験に登録された。
