
Pogosta vprašanja zdravnikov o zdravilu ENTRESTO®
Indikacije zdravila ENTRESTO® (sakubitril/valsartan):
Srčno popuščanje pri odraslih: zdravljenje simptomatskega kroničnega srčnega popuščanja z zmanjšanim iztisnim deležem pri odraslih bolnikih.
Srčno popuščanje pri pediatričnih bolnikih: zdravljenje simptomatskega kroničnega srčnega popuščanja s sistolično disfunkcijo levega prekata pri otrocih in mladostnikih, ki so stari eno leto ali več.1
Kazalo
Ker želite izvedeti več, lahko tukaj najdete odgovore.

MEHANIZEM DELOVANJA
Kako deluje zdravilo ENTRESTO®?
Zdravilo ENTRESTO® vsebuje sakubitril in valsartan. Sakubitril se presnavlja v aktivni metabolit sakubitrilat (LBQ657), zaviralec neprilizina, valsartan pa je ARB. Komplementarne koristi zdravila ENTRESTO® na srčno-žilni sistem pri bolnikih s srčnim popuščanjem je mogoče pripisati učinku substance LBQ657 na peptide, ki jih razgrajuje neprilizin (kot so natriu retični peptidi), in sočasnemu delovanju valsartana na zaviranje učinkov angiotenzina II.1
ACEi in ARB delujejo na ENO nevrohumoralno pot z zaviranjem RAAS, medtem ko zdravilo ENTRESTO® deluje na DVE poti: 1. valsartan zavira škodljive učinke RAA sistema in 2. sakubitril z inhibicijo neprilizina poveča obseg delovanja natriuretično peptidnega sistema (NPS). Zdravilo ENTRESTO® je edino zdravilo za srčno popuščanje, ki z dvojno podporu srcu okrepi srce in izboljša preživetje.1
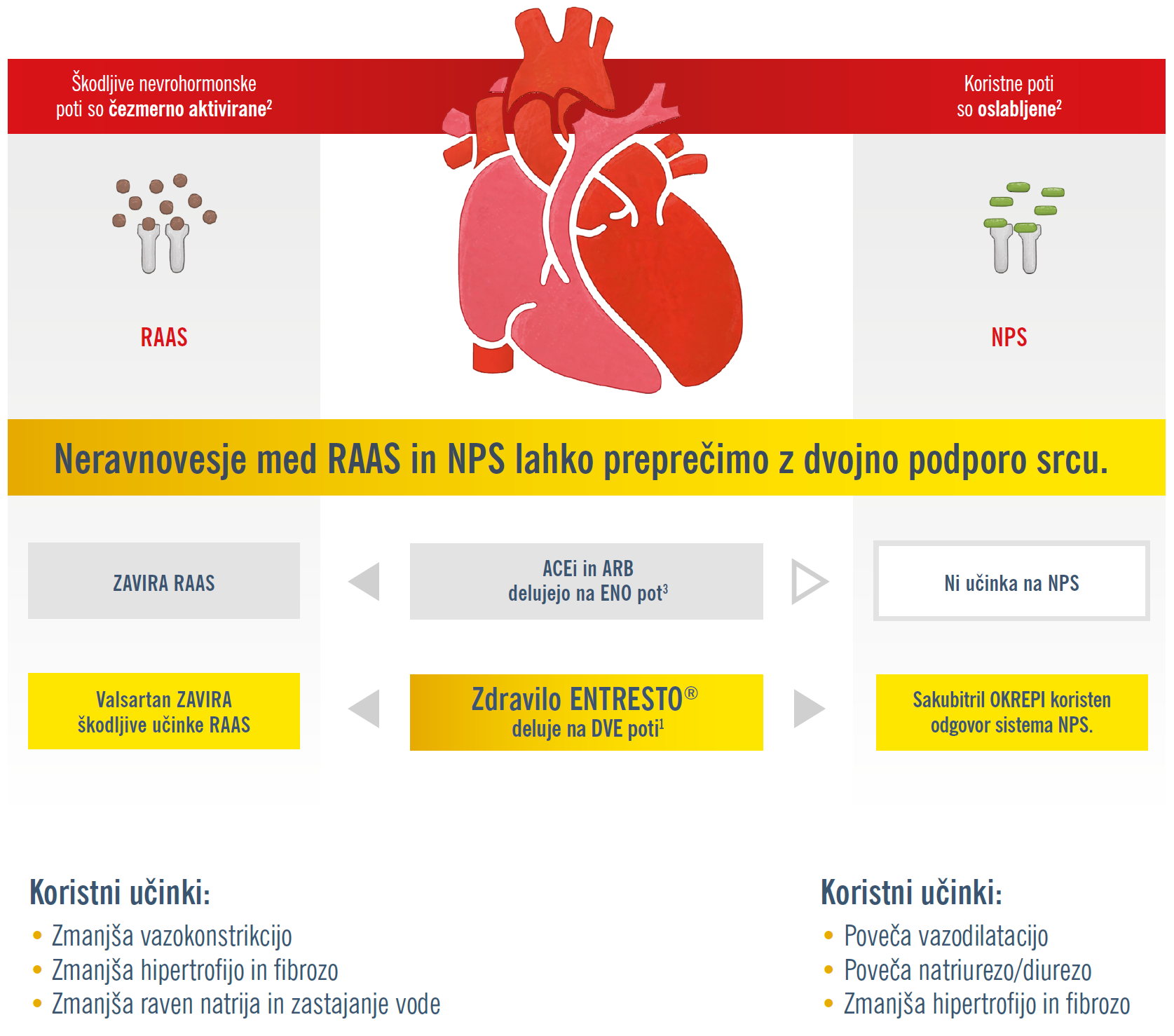
ACEi = zaviralec angiotenzin-konvertaze (angiotensin-converting enzyme inhibitor); ARB = zaviralec receptorjev za angiotenzin II (angiotensin II receptor blocker); NPS = sistem natriuretičnih peptidov (natriuretic peptide system); RAAS = istem renin-angiotenzin-aldosteron (reninangiotensin-aldosterone system).
VIRI:
Povzetek glavnih značilnosti zdravila Entresto 24 mg/26 mg, 49 mg/51 mg in 97 mg/103 mg filmsko obložene tablete. Datum zadnje revizije besedila maj 2025.
Volpe M, et al. Clin Sci (Lond). 2016;130(2):57–77.
Ramani GV, et al. Mayo Clin Proc. 2010;85(2):180–195.
Katere so koristi zaviranja neprilizina?
Neprilizin je encim, ki razgrajuje vazoaktivne snovi, kot so natriuretični peptidi, v telesu. Zaviranje neprilizina zviša ravni teh peptidov. Kot morda veste, so nekateri izmed teh vazoaktivnih peptidov povezani s koristnimi učinki, kot so vazodilatacija, natriureza, diureza, povečana hitrost glomerulne filtracije in pretok krvi skozi ledvice, zaviranje sproščanja renina in aldosterona, zmanjšanje aktivnosti simpatičnega sistema ter protihipertrfofični in protifibrotični učinki.1,2
Študija PARADIGM-HF je pokazala, da lahko zaviranje neprilizin (sakubitrilna komponenta zdravila ENTRESTO®) in zaviranje RAAS, ki ga povzroči ARB (valsartanska komponenta zdravila ENTRESTO®) pomembno zmanjšata tveganje za umrljivost zaradi srčno-žilnih vzrokov in stopnjo hospitalizacij zaradi srčnega popuščanja v primerjavi z zaviranjem RAAS samim z zaviralcem ACE (enalaprilom).3
ACE = angiotenzin-konvertaza (angiotensin-converting enzyme); ARB = zaviralec receptorjev za angiotenzin II (angiotensin II receptor blocker);
HF = srčno popuščanje (heart failure); RAAS = sistem renin-angiotensin-aldosteron (renin-angiotensin-aldosterone system).
VIRI:
Povzetek glavnih značilnosti zdravila Entresto 24 mg/26 mg, 49 mg/51 mg in 97 mg/103 mg filmsko obložene tablete. Datum zadnje revizije besedila maj 2025.
Mann DL, Zipes DP, Libby P, Bonow RO, eds. Braunwald’s Heart Disease: A Textbook of Cardiovascular Medicine. 10th ed. Philadelphia: Saunders; 2015.
McMurray JJ, et al. N Engl J Med. 2014;371(11):993–1004.
Kako lahko svojim bolnikom pojasnim delovanje zdravila ENTRESTO®?
Zdravilo ENTRESTO® zagotavlja edinstveno dvojno podporo, ki omogoči dodatno zaščito srca. To je prvi tovrsten kompleks zdravila za zdravljenje HFrEF.1,2
V SMERNICAH ESC HF se zdravilo ENTRESTO® priporoča za zdravljenje HFrEF.3
Zdravilo ENTRESTO® vsebuje dve učinkovini, sakubitril in valsartan, ki imata različno pot delovanja na srce.4
Sakubitril zavira razgradnjo natriuretičnih peptidov, ki jih proizvaja telo. Natriuretični peptidi pomagajo pri zmanjševanju obremenitve srca in krvnega tlaka. Prav tako ščitijo srce pred nastankom fibroze ali brazgotinastega tkiva, ki se pojavlja pri srčnem popuščanju.4
Druga učinkovina, valsartan, zavira delovanje hormona, imenovanega angiotenzin II. Učinki tega hormona so lahko škodljivi za bolnike s srčnim popuščanjem. Valsartan blokira receptorje, na katere so angiotenzin II ponavadi veže in tako prepreči škodljive učinke tega hormona na srce. Prav tako razširi žile in tako zniža krvni tlak.4
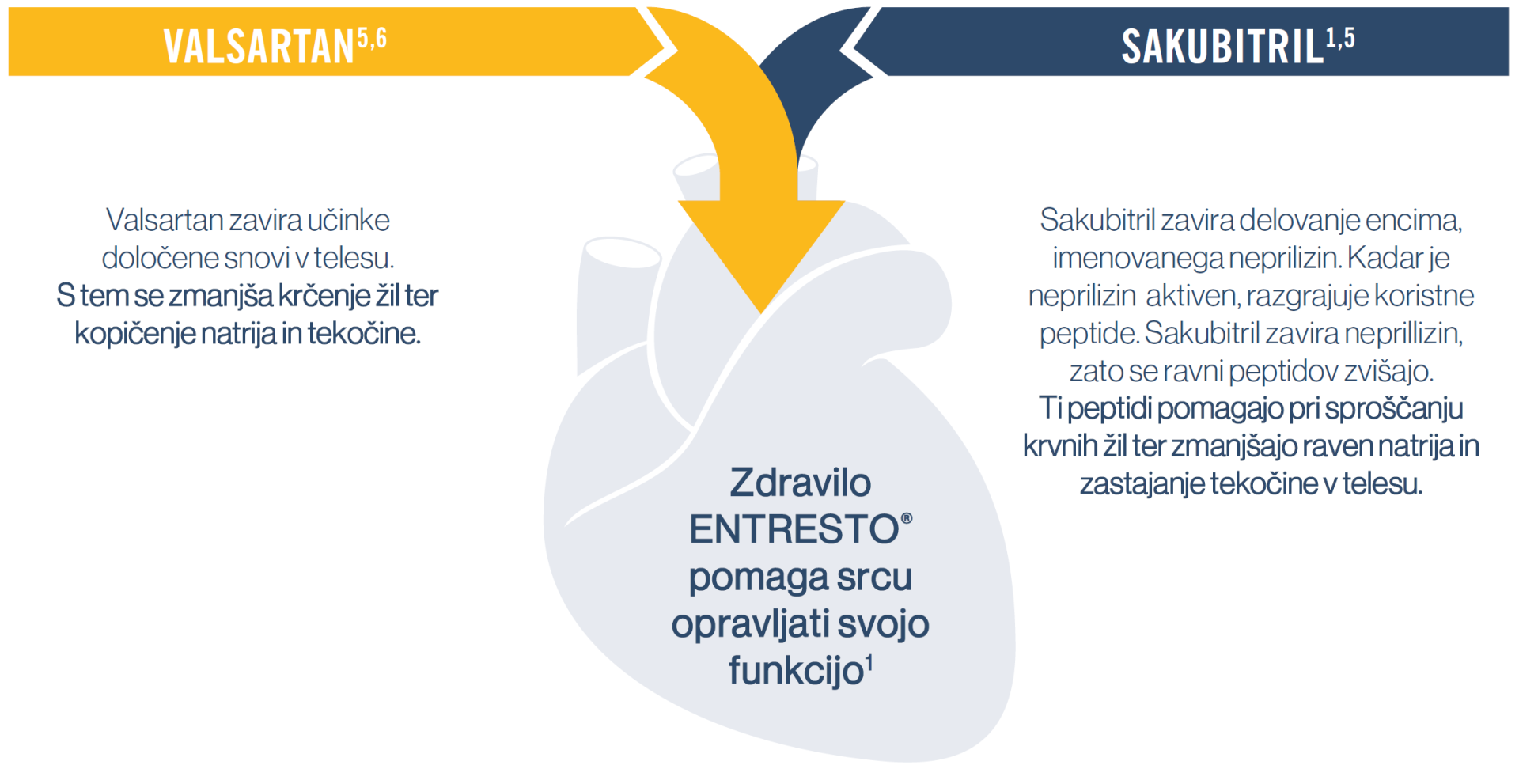
ESC = Evropsko združenje za kardiologijo (European Society of Cardiology); HF = srčno popuščanje (heart failure); HFrEF = srčno popuščanje z zmanjšanim iztisnim deležem (heart failure with reduced ejection fraction).
VIRI:
Povzetek glavnih značilnosti zdravila Entresto 24 mg/26 mg, 49 mg/51 mg in 97 mg/103 mg filmsko obložene tablete. Datum zadnje revizije besedila maj 2025.
Vardeny O, et al. JACC Heart Fail. 2014;2(6):663–670.
Ponikowski P, et al. Eur Heart J. 2016;37(27):2129–2200.
European Medicines Agency EPAR summary for the public. http://www.ema.europa.eu/docs/en_GB/document_library/EPAR_-_Summary_for_...(link is external). Published [November 2016]. Accessed [April 2017].
Mann DL, Zipes DP, Libby P, Bonow RO, eds. Braunwald’s Heart Disease: A Textbook of Cardiovascular Medicine. 10th ed. Philadelphia: Saunders; 2015.
Brunton LL, Chabner BA, Knollmann BC, eds. Goodman and Gillman’s The Pharmacological Basis of Therapeutics. 12th ed. New York: McGraw-Hill; 2011.
UČINKOVITOST
Kakšno je absolutno zmanjšanje tveganja (ARR) pri zdravilu ENTRESTO®, in kaj je vrednost NNT?
NNT je ocena vpliva na zdravljenje na podlagi števila bolnikov, ki jih je treba zdraviti, da bi dosegli učinek pri enem bolniku.1 V študiji PARADIGM-HF je bil primarni opazovani dogodek prvi dogodek smrti zaradi srčno-žilnih vzrokov ali hospitalizacije zaradi srčnega popuščanja. Mediana trajanja spremljanja je bila 27 mesecev, bolniki pa so bili zdravljeni do 4,3 leta.2
Dodatni podatki o opazovanih dogodkih so na voljo spodaj.
Primarni opazovani dogodek: 20-% RRR pri zdravilu ENTRESTO® v primerjavi z enalaprilom2
Vrednost ARR je bila 4,7 %.
Vrednost NNT za primarni opazovani dogodek je bila 21. Z drugimi besedami je treba z zdravilom ENTRESTO® namesto z enalaprilom zdraviti 21 bolnikov, da se prepreči en primarni opazovani dogodek v času trajanja študije.3
Smrt zaradi srčno-žilnih vzrokov: 20-% RRR pri zdravilu ENTRESTO® v primerjavi z enalaprilom2*†
Vrednost ARR je bila 3,1%.
Vrednost NNT za smrt zaradi srčno-žilnih vzrokov je bila 32. Z drugimi besedami je treba z zdravilom ENTRESTO® namesto z enalaprilom zdraviti 32 bolnikov, da se prepreči ena smrt zaradi srčno-žilnih vzrokov v času trajanja študije.3
Prva hospitalizacija zaradi srčnega popuščanja: 20-% RRR pri zdravilu ENTRESTO® v primerjavi z enalaprilom2*
Vrednost ARR je bila 2,8%.
Vrednost NNT za prvo hospitalizacijo zaradi srčnega popuščanja je bila 36. Z drugimi besedami je treba z zdravilom ENTRESTO® namesto z enalaprilom zdraviti 36 bolnikov, da se prepreči prva hospitalizacija zaradi srčnega popuščanja v času trajanja študije.3 Kakšno je absolutno zmanjšanje tveganja (ARR) pri zdravilu ENTRESTO®, in kaj je vrednost NNT?
* Analiz komponent primarnega sestavljenega končnega dogodka niso prospektivno načrtovali za prilagoditev multiplicitete.
† Vključuje tudi bolnike, ki so jih pred smrtjo hospitalizirali zaradi srčnega popuščanja.
ARR = absolutno zmanjšanje tveganja (absolute risk reduction); HF = srčno popuščanje (heart failure); HFrEF = srčno popuščanje z zmanjšanim iztisnim deležem (heart failure with reduced ejection fraction); NNT = število bolnikov, ki jih je treba zdraviti (number needed to treat); RRR = relativno zmanjšanje tveganja (relative risk reduction).
VIRI:
Cook RJ, Sackett DL. BMJ. 1995;310(6977):452–454.
Povzetek glavnih značilnosti zdravila Entresto 24 mg/26 mg, 49 mg/51 mg in 97 mg/103 mg filmsko obložene tablete. Datum zadnje revizije besedila maj 2025.
McMurray JJ, et al. N Engl J Med. 2014;371(11):993–1004.
Kakšni so učinki na kakovost življenja bolnikov?
Zdravilo ENTRESTO® ima učinek, ki ga bolniki s HFrEF občutijo, in jim pomaga voditi bolj aktivno in izpolnjeno življenje. Z zgodnjo uvedbo zdravljenja z zdravilom ENTRESTO® lahko preprečite hospitalizacijo bolnikov ter jim zagotovite daljše življenje in boljše počutje.1–3
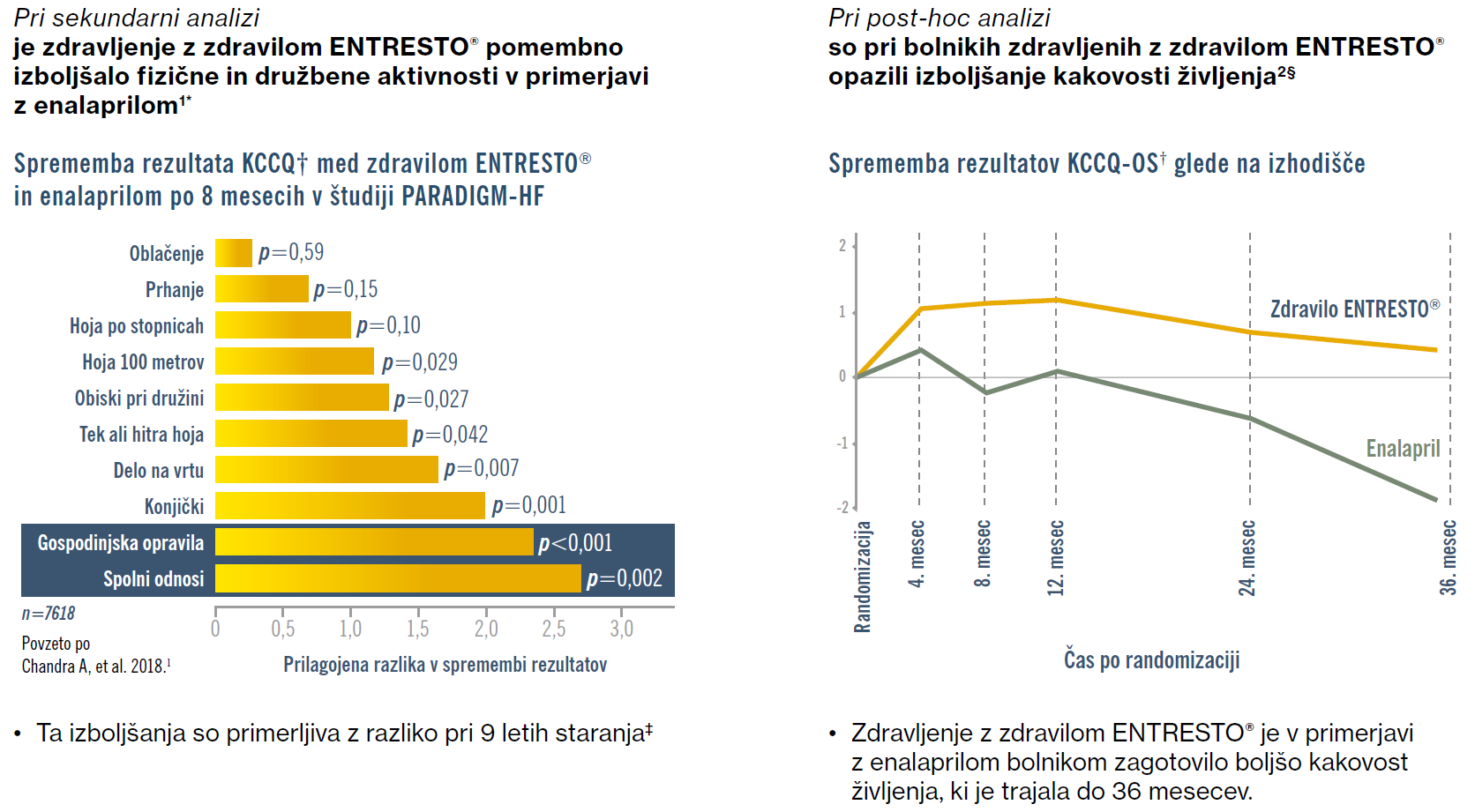
*V tej sekundarni analizi podatkov iz študije PARADIGM-HF so ugotavljali učinek zdravljenja z zdravilom ENTRESTO® na komponente fizičnih in družbenih omejitev pri testu KCCQ po 8 mesecih in longitudinalno 36 mesecev. Pri bolnikih, ki so prejemali zdravilo ENTRESTO® so bile prilagojene spremembe rezultatov pri 7 od 10 fizičnih in družbenih aktivnostih pomembno boljše kot pri skupini, ki je prejemala enalapril. Največje izboljšanje v primerjavi z enalaprilom je bilo pri gospodinjskih opravilih (prilagojena sprememba rezultata, 2.35; 95-% IZ, 1,19–3,50; P < 0,001) in spolnih odnosih (prilagojena sprememba rezultata, 2,72; 95-% IZ, 0,97–4,46; P = 0,002); oba učinka sta vztrajala 36 mesecev (skupna prilagojena sprememba rezultata, 1,69; 95-% IZ, 0,78–2,60; P < 0,001; oz. 2,36; 95-% IZ, 1,01–3,71; P = 0,001).1,3
† KCCQ je zdravstveni vprašalnik za meritev kakovosti življenja pri bolnikih s srčnim popuščanjem, ki kvantificira telesne funkcije, simptome, družbene funkcije, samoučinkovitost in znanje ter kakovost življenja na lestvici od 0 do 100, kjer višji rezultat pomeni manj simptomov in telesnih omejitev, povezanih s srčnim popuščanjem.1,2
‡ Izmerjeno z analitičnim modelom, ki upošteva starost in učinek zdravljenja.1
§ V tej analizi post-hoc študije PARADIGM-HF so ugotavljali spremembe rezultatov KCCQ ob randomizaciji, po 4 mesecih, po 8 mesecih, po 12 mesecih in nato enkrat na leto do zadnjega obiska. 91 % bolnikov, ki so sodelovali v PARADIGM-HF (n=7623/8399), je izpolnilo KCCQ ob randomizaciji, popolne podatke KCCQ je osmi mesec imelo 6881 bolnikov (90 % vseh bolnikov s podatki ob randomizaciji) Pri osmem mesecu so bile v skupini bolnikov, zdravljenih z zdravilom ENTRESTO®, v primerjavi z bolniki na terapiji z enalaprilom, ugotovljene izboljšave tako v rezultatu KCCQ* skupni klinični izid (CSS*) (+0,64 v primerjavi z –0,29; p=0,008) kot tudi v skupnem rezultatu KCCQ* (+1,13 v primerjavi z –0,14; p<0,001). Prišlo je tudi do značilne spremembe deleža bolnikov s poslabšanjem (znižanje obeh rezultatov KCCQ za ≤ 5 točk) (27 % v primerjavi z 31 %; p = 0,01). Prilagojene spremembe v rezultatu KCCQ so pokazale dosledno izboljšanje pri bolnikih, zdravljenih z zdravilom ENTRESTO®, v primerjavi z bolniki, zdravljenimi z enalaprilom, tudi v 36-mesečnem obdobju spremljanja. Bolniki, ki so umrli ali niso dokončali izpolnjevanja KCCQ pri osmih mesecih, so bili izvzeti iz analize podatkov.2,3
HF = srčno popuščanje (heart failure); HFrEF = srčno popuščanje z zmanjšanim iztisnim deležem (heart failure with reduced ejection fraction);
KCCQ-OS = skupni povzetek kansaškega vprašalnika za kardiomiopatijo (Kansas City Cardiomyopathy Questionnaire Overall Summary).
VIRI:
Chandra A, et al. JAMA Cardiol. 2018;3(5):1–8.
Lewis EF, et al. Circ Heart Fail. 2017;10(8):e003430.
Povzetek glavnih značilnosti zdravila Entresto 24 mg/26 mg, 49 mg/51 mg in 97 mg/103 mg filmsko obložene tablete. Datum zadnje revizije besedila maj 2025.
VARNOST/PRENAŠANJE
Kakšen je varnostni profil zdravila ENTRESTO®?
Varnostni profil in profil prenašanja zdravila ENTRESTO® je primerljiv z enalaprilom:1
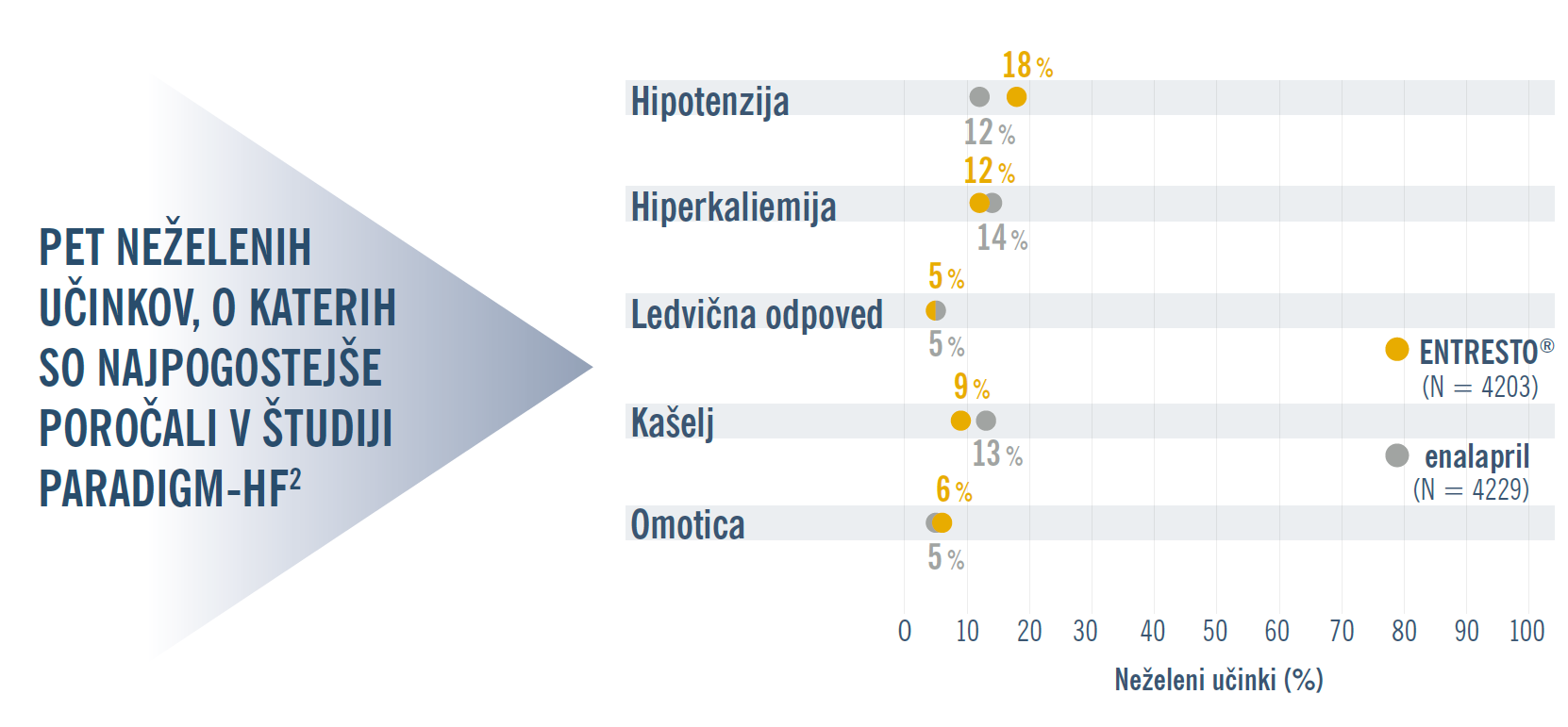
V dvojno slepem obdobju je v skupini, ki je prejemala zdravilo ENTRESTO®, manj bolnikov prekinilo zdravljenje zaradi neželenega dogodka (10,7 % v primerjavi z 12,2 % pri enalaprilu).1
V dvojno slepem obdobju je bila incidenca angioedema pri bolnikih, ki so prejemali zdravilo ENTRESTO®, 0,5 % v primerjavi z 0,2% pri enalaprilu.1
KONTRAINDIKACIJE2
Preobčutljivost na učinkovini ali katero koli pomožno snov.
Zdravila ENTRESTO® se ne sme odmerjati skupaj z zaviralcem ARB ali ACE in se ne sme odmerjati prej kot po preteku 36 ur od prekinitve zdravljenja z zaviralcem ACE.
Angioedem, povezan s predhodnim zdravljenjem z zaviralcem ACE/zaviralcem angiotenzinskih receptorjev v anamnezi.
Dedni ali idiopatski angioedem.
Sočasna uporaba z zdravili, ki vsebujejo aliskiren, pri bolnikih s sladkorno boleznijo in pri bolnikih z okvaro ledvic (z ocenjeno hitrostjo glomerulne filtracije < 60 ml/min/1,73 m2).
Huda okvara jeter, biliarna ciroza ali holestaza.
Drugo in tretje trimesečje nosečnosti.
* Vsi odstotki na tem grafu so zaokroženi na najbližje celo število.
ACEi = zaviralec angiotenzin-konvertaze (angiotensin-converting enzyme inhibitor); ARB = zaviralec receptorjev za angiotenzin II (angiotensin
II receptor blocker).
VIRI:
Povzetek glavnih značilnosti zdravila Entresto 24 mg/26 mg, 49 mg/51 mg in 97 mg/103 mg filmsko obložene tablete. Datum zadnje revizije besedila maj 2025.
Fala L. Am Health Drug Benefits. 2015;8(6):330–334.
Ali večina bolnikov prenaša ciljni odmerek zdravila ENTRESTO®?
V preskušanju PARADIGM-HF je 76 % bolnikov v skupini, ki je prejemala zdravilo ENTRESTO®, do konca študije prejemala ciljni odmerek 200 mg dvakrat na dan (povprečni dnevni odmerek 375 mg).* To je bilo primerljivo s skupino, kjer je 75 % bolnikov do konca študije prejemalo enalapril, kjer je ciljni odmerek 10 mg dvakrat na dan (povprečni dnevni odmerek 18,9 mg).1
* Odobreni odmerki so bili 24 mg/26 mg, 49 mg/51 mg in 97 mg/103 mg. V nekaterih virih so ti odmerki navedeni kot 50 mg, 100 mg oz. 200 mg.
HF = srčno popuščanje (heart failure).
VIRI:
Povzetek glavnih značilnosti zdravila Entresto 24 mg/26 mg, 49 mg/51 mg in 97 mg/103 mg filmsko obložene tablete. Datum zadnje revizije besedila maj 2025.
Kaj moram storiti, če se pri mojem bolniku med jemanjem zdravila ENTRESTO® pojavi hipotenzija?
POMEMBNE VARNOSTNE INFORMACIJE O HIPOTENZIJI
Zdravilo ENTRESTO® znižuje krvni tlak in lahko povzroči simptomatsko hipotenzijo.1
Zdravljenje se ne sme začeti, če sistolični krvni tlak ne znaša ≥ 100 mmHg. Bolnikov s sistoličnim krvnim tlakom < 100 mmHg niso preučevali. Pri bolnikih, ki so v kliničnih študijah prejemali zdravilo ENTRESTO®, so poročali o primerih simptomatske hipotenzije, zlasti pri bolnikih, starih ≥ 65 let, bolnikih z boleznijo ledvic in bolnikih z nizkim sistoličnim krvnim tlakom (< 112 mmHg). Ob začetku zdravljenja oziroma med titriranjem odmerka zdravila ENTRESTO® je treba rutinsko spremljati krvni tlak.1
Kot je prikazano v spodnji preglednici, je bila hipotenzija v dvojno slepem obdobju preskušanja PARADIGM-HF neželeni učinek, o katerem so poročali zelo pogosto. Prekinitev zdravljenja zaradi hipotenzije je bilo malo, število pa je bilo pri obeh skupinah podobno.1,2

Treba je poudariti, da so zaradi uvajalnega obdobja v zasnovi študije PARADIGM-HF stopnje zgoraj opisanih neželenih učinkov nižje kot v praksi.1
Obravnavanje hipotenzije:1
Če pride do hipotenzije, je priporočeno znižanje odmerka ali prekinitev zdravljenja z zdravilom ENTRESTO®.
Razmisliti je treba o prilagajanju odmerjanja diuretikov, sočasno uporabljanih antihipertenzivov in odpravljanju drugih vzrokov hipotenzije (na primer hipovolemije).
Pomanjkanje natrija in/ali hipovolemijo je treba odpraviti pred začetkom zdravljenja z zdravilom ENTRESTO®, vendar je pri izvajanju takšnih korektivnih ukrepov potreben skrben razmislek zaradi tveganja za volumsko preobremenitev.
HF = srčno popuščanje (heart failure).
VIRI:
Povzetek glavnih značilnosti zdravila Entresto 24 mg/26 mg, 49 mg/51 mg in 97 mg/103 mg filmsko obložene tablete. Datum zadnje revizije besedila maj 2025.
McMurray JJ, et al. N Engl J Med. 2014;371(11):993–1004.
ODMERJANJE/UPORABA
Ali naj premislim o uporabi zdravila ENTRESTO® pri svojih bolnikih s HFrEF razreda II po NYHA?
Srčno popuščanje je progresivna bolezen, zato pri vseh bolnikih, vključno tistimi, ki so videti brez simptomov ali kažejo blage simptome, obstaja tveganje za hospitalizacijo in smrt.1,2
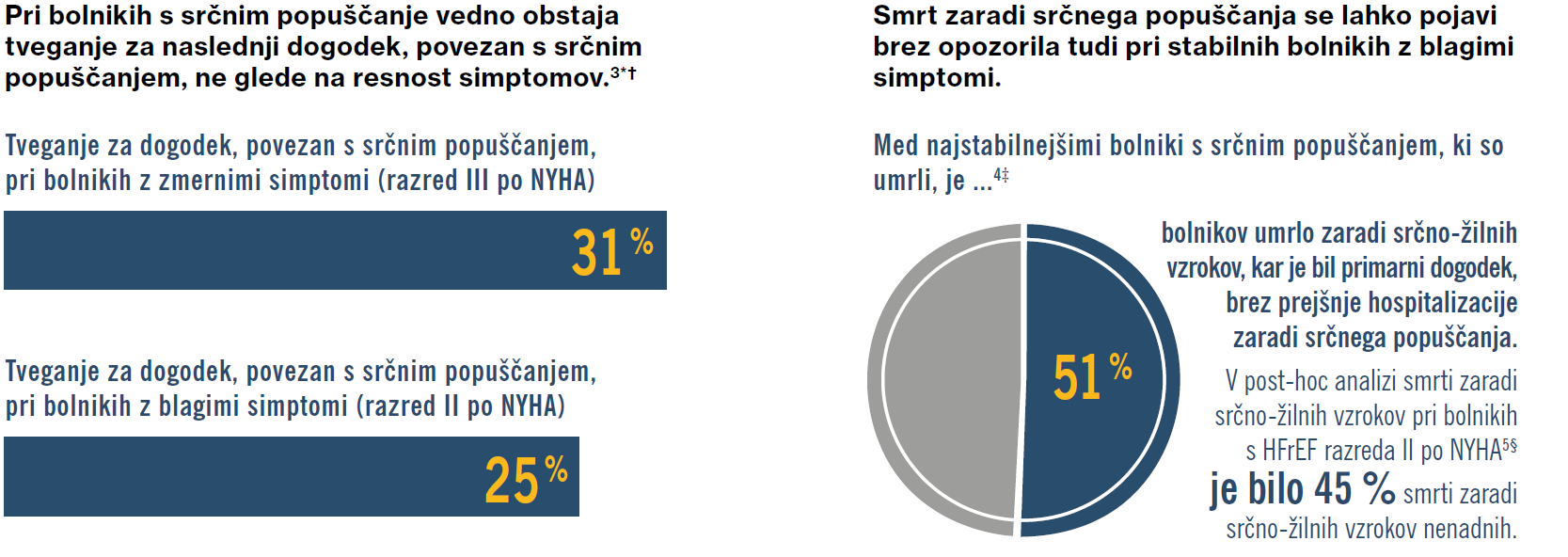
V preskušanju PARADIGM-HF je bilo 70 % preskušancev v razredu II po NYHA, kar pomeni, da so imeli nekaj simptomov ob običajnih dejavnostih. Koristni učinek zdravila ENTRESTO® so opazili pri širokem razponu bolnikov s srčnim popuščanjem razreda II–IV po NYHA:3
20 % manjše tveganje za primarni sestavljeni opazovani dogodek, tj. smrt zaradi srčno-žilnih vzrokov ali prva hospitalizacija zaradi srčnega popuščanja, kot pri enalaprilu (P = 0,0000002),3
21 % manjše tveganje za prvo hospitalizacijo zaradi srčnega popuščanja kot pri enalaprilu,3
20 % manjše tveganje za smrt zaradi srčno-žilnih vzrokov kot pri enalaprilu.3
* Hospitalizacija zaradi srčnega popuščanja ali smrt zaradi srčno-žilnih vzrokov.
† Študija PARADIGM-HF je bila multinacionalno, randomizirano, dvojno slepo preskušanje, v katerem so primerjali zdravilo ENTRESTO® z enalaprilom pri 8442 simptomatskih (NYHA razred II–IV) bolnikih s HFrEF (LVEF ≤ 40 %). Primarni opazovani dogodek je bil sestavljen izid srčno-žilne smrti ali prve hospitalizacije zaradi poslabšanja srčnega popuščanja, pri tem se je zdravilo ENTRESTO® pokazalo kot bolj učinkovito v primerjavi z enalaprilom (p < 0,0001). Mediana trajanja spremljanja je bila 27 mesecev, bolniki pa so bili zdravljeni do 4,3 leta.3
1 Pri tej Post-hoc analizi PARADIGM-HF so ocenjevali tveganje za primarni opazovani dogodek na podlagi obstoja predhodne hospitalizacije zaradi srčnega popuščanja in časa od zadnje hospitalizacije kot kazalnika klinične stabilnosti. Bolniki, ki so bili nazadnje hospitalizirani manj kot 3 mesece pred presejalnim postopkom (N = 1611), so bili opredeljeni kot najmanj stabilni. Bolniki, ki predhodno niso bili hospitalizirani zaradi srčnega popuščanja (N = 3125), so bili opredeljeni kot najbolj stabilni.4
§ Pri tej Post-hoc analizi PARADIGM-HF so ocenjevali učinek zdravila ENTRESTO® v primerjavi z enalaprilom na vzrok smrti pri bolnikih s srčnim popuščanjem (skupno število umrlih bolnikov je bilo 1546, vključno s 711 bolniki na terapiji z zdravilom ENTRESTO® in 835 bolniki na terapiji z enalaprilom [17 % oz. 19,8 % od vseh bolnikov v posamezni skupini]). Večina smrti je bila zaradi srčno-žilnih vzrokov (80,9 %; N = 1251), pri tem je bila večina od teh razvrščenih kot nenadna smrt (44,8 %) ali smrt, povezana s srčnim popuščanjem (26,5 %).5
HF = srčno popuščanje (heart failure); HFrEF = srčno popuščanje z zmanjšanim iztisnim deležem (heart failure with reduced ejection fraction) (heart failure with reduced ejection fraction); LVEF = iztisni delež levega prekata (left ventricular ejection fraction); NYHA = Newyorško združenje za srce (New York Heart Association).
VIRI:
Mann DL, Zipes DP, Libby P, Bonow RO, eds. Braunwald’s Heart Disease: A Textbook of Cardiovascular Medicine. 10th ed. Philadelphia: Saunders; 2015.
Ponikowski P, et al. Eur Heart J. 2016;37(27):2129–2200.
Povzetek glavnih značilnosti zdravila Entresto 24 mg/26 mg, 49 mg/51 mg in 97 mg/103 mg filmsko obložene tablete. Datum zadnje revizije besedila maj 2025.
Solomon SD, et al. JACC Heart Fail. 2016;4(10):816–822.
Desai AS, et al. Eur Heart J. 2015;36(30):1990–1997.
Ali lahko bolniki preidejo na zdravilo ENTRESTO®, če so na manjših odmerkih ACEi/ARB?
Za vse simptomatske bolnike s HFrEF so izdelali razpored titriranja zdravila ENTRESTO®, ne glede na trenutni odmerek ACEi ali ARB, s katerega so prešli na to zdravilo.1
Ciljni odmerek zdravila ENTRESTO® je 97 mg/103 mg dvakrat na dan, tj. odmerek, ki so ga raziskovali v preskušanju PARADIGM-HF.1
Priporočeni začetni odmerek zdravila ENTRESTO® je 49 mg/51 mg dvakrat na dan. Po 2–4 tednih je treba odmerek podvojiti na ciljni odmerek ene tablete 97 mg/103 mg dvakrat na dan, če ga bolnik prenaša.1
Pri bolnikih, ki trenutno jemljejo nizke odmerke ACEi ali ARB, ali bolnikih, ki trenutno ne jemljejo teh zdravil, se priporoča začetni odmerek 24 mg/26 mg dvakrat na dan in počasno titriranje odmerka (podvojitev vsake 3–4 tedne).1
Ne uporabljajte sočasno z ACEi ali ARB. Ne začenjajte zdravljenja z zdravilom ENTRESTO® manj kot 36 ur po prekinitvi zdravljenja z zaviralci ACE.1
Pri bolnikih z blago ledvično okvaro (eGFR 60–90 ml/min/1,73 m2) odmerka ni treba prilagajati. Pri bolnikih z zmerno ledvično okvaro (eGFR 30–60 ml/min/1,73 m2) je treba razmisliti o začetnem odmerku 24 mg/26 mg dvakrat na dan. Klinične izkušnje pri bolnikih s hudo ledvično okvaro (eGFR < 30 ml/min/1,73 m2) so zelo omejene,zato je treba zdravilo ENTRESTO® uporabljati previdno, priporočeni začetni odmerek pa je 24 mg/26 mg dvakrat na dan. Pri bolnikih s končno ledvično odpovedjo ni izkušenj, zato uporaba zdravila ENTRESTO® ni priporočena.1
Pri bolnikih z blago jetrno okvaro (razred A po Child-Pughovi lestvici) odmerka zdravila ENTRESTO® ni treba prilagajati. Pri bolnikih z zmerno jetrno okvaro (razred B po Child-Pughovi lestvici) je treba zdravilo ENTRESTO® uporabljati previdno, priporočeni začetni odmerek pa je 24 mg/26 mg dvakrat na dan. Pri bolnikih s hudo okvaro jeter, biliarno cirozo ali holestazo (razred C po Child-Pughovi lestvici) je uporaba zdravila ENTRESTO® kontraindicirana.1
Če imajo bolniki težave s prenašanjem zdravila (simptomatsko hipotenzijo, hiperkaliemijo ali moteno delovanje ledvic), je treba razmisliti o prilagoditvi odmerka sočasnih zdravil oziroma znižanju odmerka zdravila ENTRESTO® ali prekinitvi odmerjanja zdravila ENTRESTO®.1
ACEi = zaviralec angiotenzin-konvertaze (angiotensin-converting enzyme inhibitor); ARB = zaviralec receptorjev za angiotenzin II (angiotensin II receptor blocker); eGFR = ocenjena stopnja glomerularne filtracije (estimated glomerular filtration rate); HF = srčno popuščanje (heart failure); HFrEF = srčno popuščanje z zmanjšanim iztisnim deležem (heart failure with reduced ejection fraction).
VIRI:
Povzetek glavnih značilnosti zdravila Entresto 24 mg/26 mg, 49 mg/51 mg in 97 mg/103 mg filmsko obložene tablete. Datum zadnje revizije besedila maj 2025.
Zakaj je po prenehanju uporabe zaviralca ACE in pred začetkom uporabe zdravila ENTRESTO® potrebno 36-urno obdobje izplavljanja?
Na kratko, treba je upoštevati obdobje izplavljanja, da se zmanjša tveganje za angioedem.1
Neprilizin, tako kot ACE, poleg tega, da presnavlja natriuretične peptide, sodeluje tudi pri razgradnji bradikinina,2,3 zato kombinacija zaviranja neprilizina in zaviranja ACE lahko poveča tveganje z bradikininom povezanega angioedema.4
Zdravljenje z zdravilom ENTRESTO® se ne sme začeti manj kot 36 ur po zadnjem odmerku zaviralca ACE. Velja tudi obratno, zdravljenje z zaviralcem ACE se ne sme začeti manj kot 36 ur po zadnjem odmerku zdravila ENTRESTO®.
Zdravilo ENTRESTO® lahko povzroči angioedem. Angioedem, povezan z edemom grla, je lahko smrten. Zdravilo ENTRESTO® je povezano z večjo pogostnostjo pojavljanja angioedema pri temnopoltih bolnikih in pri bolnikih z angioedemom v anamnezi. Če se pojavi angioedem, takoj prekinite zdravljenje z zdravilom ENTRESTO®, zagotovite ustrezno zdravljenje in spremljajte stanje dihalnih poti. Zdravljenja z zdravilom ENTRESTO® ne smete začeti znova.1
Bolnikov z angioedemom v anamnezi niso raziskovali. Pri teh bolnikih je lahko tveganje za angioedem večje, zato se pri uporabi zdravila ENTRESTO® priporoča previdnost. Zdravilo ENTRESTO® je kontraindicirano pri bolnikih z angioedemom, povezanim s predhodnim zdravljenjem z zaviralcem ACE/zaviralcem angiotenzinskih receptorjev v anamnezi, ali bolnikih z dednim ali idiopatskim
angioedemom.1
ACE = angiotenzin-konvertaza (angiotensin-converting enzyme).
VIRI:
Povzetek glavnih značilnosti zdravila Entresto 24 mg/26 mg, 49 mg/51 mg in 97 mg/103 mg filmsko obložene tablete. Datum zadnje revizije besedila maj 2025.
Mann DL, Zipes DP, Libby P, Bonow RO, eds. Braunwald’s Heart Disease: A Textbook of Cardiovascular Medicine. 10th ed. Philadelphia: Saunders; 2015.
Erdös EG, Skidgel RA. FASEB J. 1989;3(2): 145–151.
Hegde LG, et al. J Cardiovasc Pharmacol. 2011;57(4):495–504.
PRESKUŠANJE PARADIGM-HF
Kateri profil bolnikov je sodeloval v raziskavi PARADIGM-HF?
Zdravilo ENTRESTO® je indicirano za zdravljenje simptomatskega kroničnega srčnega popuščanja - srčno popuščanje z zmanjšanim iztisnim deležem (HFrEF).1
Raziskava PARADIGM-HF, največje preskušanje pri bolnikih s srčnim popuščanjem, ki so ga kdaj izvedli, je pokazalo superiornost zdravila ENTRESTO® v primerjavi z zaviralcem ACE, enalaprilom. Vključenih je bilo več kot 8400 bolnikov z zmanjšanim iztisnim deležem (≤ 40 %).2,3
V tem preskušanju so zdravilo ENTRESTO® uporabljali skupaj z drugimi terapijami za srčno popuščanje, namesto zaviralcev ACE ali ARB. Bolniki so morali najmanj 4 tedne prejemati zaviralec ACE ali ARB (v odmerku, ki je enakovreden najmanj 10 mg enalaprila na dan) in največji odmerek beta-blokatorjev, ki so ga še prenašali (razen, če je bil kontraindiciran ali ga niso prenašali).1,3
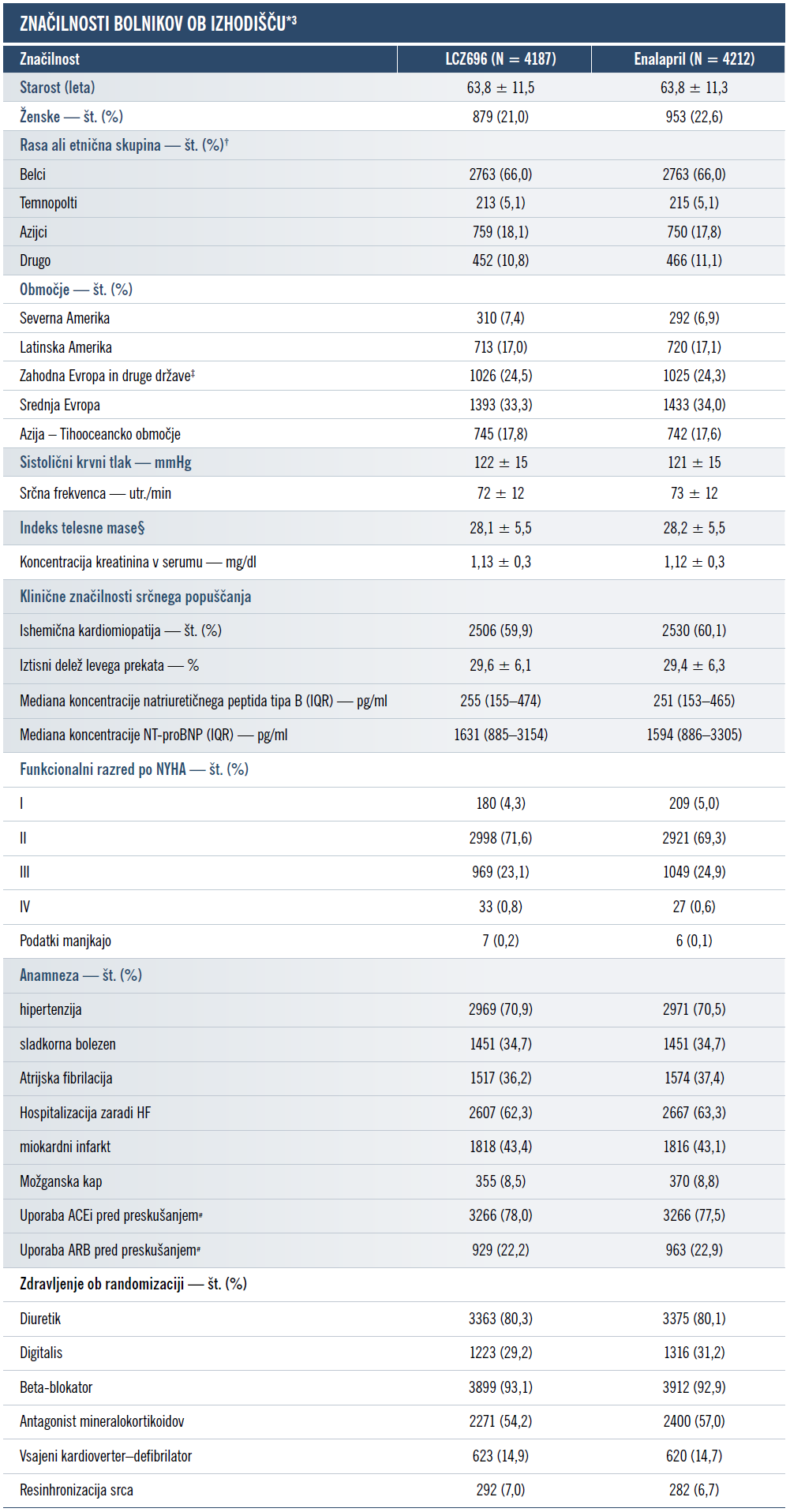
*Vrednosti plus–minus so povprečja ±SD. Med skupinama ni bilo pomembnih razlik, razen uporabe digitalisa (P = 0,04) in antagonistov mineralokortikoidnih receptorjev (P = 0,01), kjer vrednosti niso bile prilagojene za večkratno testiranje. Zaradi zaokroževanja seštevek vrednosti morda ne bo 100. Dodatne podrobnosti o značilnostih ob izhodišču so na voljo v 3. poglavju dopolnilnega dodatka. Če želite vrednosti za kreatinin pretvoriti v mikromole na liter, jih pomnožite z 88,4. Okrajšava »IQR« pomeni interkvartilni razpon (interquartile range).
† O podatku o rasi ali etnični skupini so poročali raziskovalci.
‡ Ta kategorija vključuje Južno Afriko in Izrael.
§ Indeks telesne mase je telesna masa v kilogramih, deljena s kvadratom višine v metrih.
¶ Podatki o razredu po NYHA odražajo stanje bolnikov v času randomizacije. Ob presejalnem pregledu so morali bolniki imeti najmanj simptome razreda II po NYHA.
# Ob presejalnem pregledu 20 bolnikov ni prejemalo zdravljenje, z zaviralci ACE ali ARB, zahtevano po protokolu, 45 bolnikov pa je prejemalo obe zdravili. Podatki o odmerkih zaviralcev ACE in ARB, ki so jih bolniki prejemali pred preskušanjem, so na voljo v dopolnilnem dodatku.
ACE = angiotenzin-konvertaza (angiotensin-converting enzyme); ACEi = zaviralec angiotenzin-konvertaze (angiotensin-converting enzyme inhibitor); ARB = zaviralec receptorjev za angiotenzin II (angiotensin II receptor blocker); HF = srčno popuščanje (heart failure); HFrEF = srčno popuščanje z zmanjšanim iztisnim deležem (heart failure with reduced ejection fraction); NT-proBNP = N-terminalni natriuretični peptid tipa pro-B (N-terminal pro-b-type natriuretic peptide); NYHA = Newyorško združenje za srce; SD = standardni odklon.
VIRI:
Povzetek glavnih značilnosti zdravila Entresto 24 mg/26 mg, 49 mg/51 mg in 97 mg/103 mg filmsko obložene tablete. Datum zadnje revizije besedila maj 2025.
McMurray JJ, et al. Eur J Heart Fail. 2014; 16(7):817–825.
McMurray JJ, et al. N Engl J Med. 2014;371(11):993–1004.
Zakaj se sakubitril kombinira z ARB in ne z zaviralci ACE? Zakaj je kot primerjalno zdravilo v raziskavi PARADIGM-HF izbran enalapril?
V kliničnih preskušanjih je bila kombinacija zaviralca ACE in zaviralca neprilizina povezana z resnim angioedemom. Kombinacija neprilizina in ARB je zasnovana tako, da zagotovi najmanjše tveganje za resni angioedem.1
Enalapril je zaviralec ACE, ki so ga v študijah izidov obsežno raziskovali. V preskušanjih SOLVD-T in CONSENSUS so dokazali zmanjšano umrljivost pri širokem razponu bolnikov s srčnim popuščanjem, ki so prejemali enalapril.2–4
V prelomnem kliničnem preskušanju SOLVD-T so pri enalaprilu ugotovili 16-odstotno zmanjšanje skupne umrljivosti v primerjavi s placebom.3
V prelomnem kliničnem preskušanju CONSENSUS je enalapril zmanjšal umrljivost po 6 mesecih pri bolnikih, razvrščenih v razred IV po NYHA, za 40 % v primerjavi s placebom.4
ACE = angiotenzin-konvertaza (angiotensin-converting enzyme); ARB = zaviralec receptorjev za angiotenzin II (angiotensin II receptor blocker); HF = srčno popuščanje (heart failure); NYHA = Newyorško združenje za srce (New York Heart Association).
VIRI:
McMurray JJ, et al. N Engl J Med. 2014;371(11):993–1004.
McMurray JJ, et al. Eur Heart J. 2012;33(14):1787–1847.
SOLVD Investigators. N Engl J Med. 1991;325(5): 293–302.
CONSENSUS Trial Study Group. N Engl J Med. 1987;316(23):1429–1435.
Zakaj niso učinkovino sakubitril raziskovali samostojno?
Neprilizin razgrajuje vazodilatatorje (kot so natriuretični peptidi) in vazokonstriktorje (kot je angiotenzin II). Sakubitril zavira neprilizin in tako zviša ravni obeh učinkovin. Torej je nujno zavreti učinke zvišanih ravni angiotenzina II z zaviralcem ARB.1–4 Zato je zdravilo ENTRESTO® kompleks, ki zavira neprilizin in blokira angiotenzinske raceptorje.
ARB = zaviralec receptorjev za angiotenzin II (angiotensin II receptor blocker).
VIRI:
Povzetek glavnih značilnosti zdravila Entresto 24 mg/26 mg, 49 mg/51 mg in 97 mg/103 mg filmsko obložene tablete. Datum zadnje revizije besedila maj 2025.
Camm JA, Lüscher TF, Serruys PW, eds. ESC Textbook of Cardiovascular Medicine. 2nd ed. Oxford, UK: Oxford University Press; 2009:685–719.
Stephenson SL, Kenny AJ. Biochem J. 1987;241(1):237–247.
McMurray JJ, et al. Eur J Heart Fail. 2014;16(7):817–825.
PRESKUŠANJI PROVE-HF IN EVALUATE-HF
Kakšen je bil namen preskušanj PROVE-HF in EVALUATE-HF?
V preskušanju PARADIGM-HF je zdravilo ENTRESTO® zmanjšalo tveganje za smrt zaradi srčno-žilnih vzrokov ali hospitalizacijo zaradi srčnega popuščanja za 20 % v primerjavi z enalaprilom.1–3
Vendar patofizioloških mehanizmov, na katerih temelji prednost zaviranja angiotenzinskih receptorjev in neprilizina v primerjavi z zaviranjem angiotenzin-konvertaze, niso povsem razumeli.4,5
V študiji PROVE-HF so raziskovali povezavo spremembe NT-proBNP po začetku zdravljenja z zdravilom ENTRESTO® in dolgotrajnih sprememb parametrov remodelacije srca. Zasnova študije PROVE-HF je odražala obravnavanje bolnikov s HFrEF v klinični praksi.4
Študija PROVE-HF (NCT02887183) je bila prospektivna, multicentrična, odprta, 12-mesečna študija ene skupine, v kateri so ocenjevali povezavo med spremembo ravni NT-proBNP po začetku zdravljenja z zdravilom ENTRESTO® ter strukture in funkcije srca pri bolnikih s HFrEF.4
ZASNOVA IN POSTOPKI V ŠTUDIJI PROVE-HF

V študiji EVALUATE-HF so raziskovali učinek zdravila ENTRESTO® v primerjavi z enalaprilom na zmanjšanje togosti aorte, remodelacije srca ter bioloških označevalcev obremenitve in poškodb stene srca pri bolnikih z blagim do zmernim HFrEF.5
Študija EVALUATE-HF (NCT02874794) je bila multicentrična, randomizirana, dvojno slepa, dvojno zakrita, aktivno nadzorovana 12-tedenska študija vzporednih skupin z obveznim titriranjem, v kateri so primerjali učinek zdravila ENTRESTO® v primerjavi z enalaprilom na spremembe togosti centralne aorte in remodelacijo srca pri bolnikih s HFrEF.5
ZASNOVA IN POSTOPKI V ŠTUDIJI EVALUATE-HF
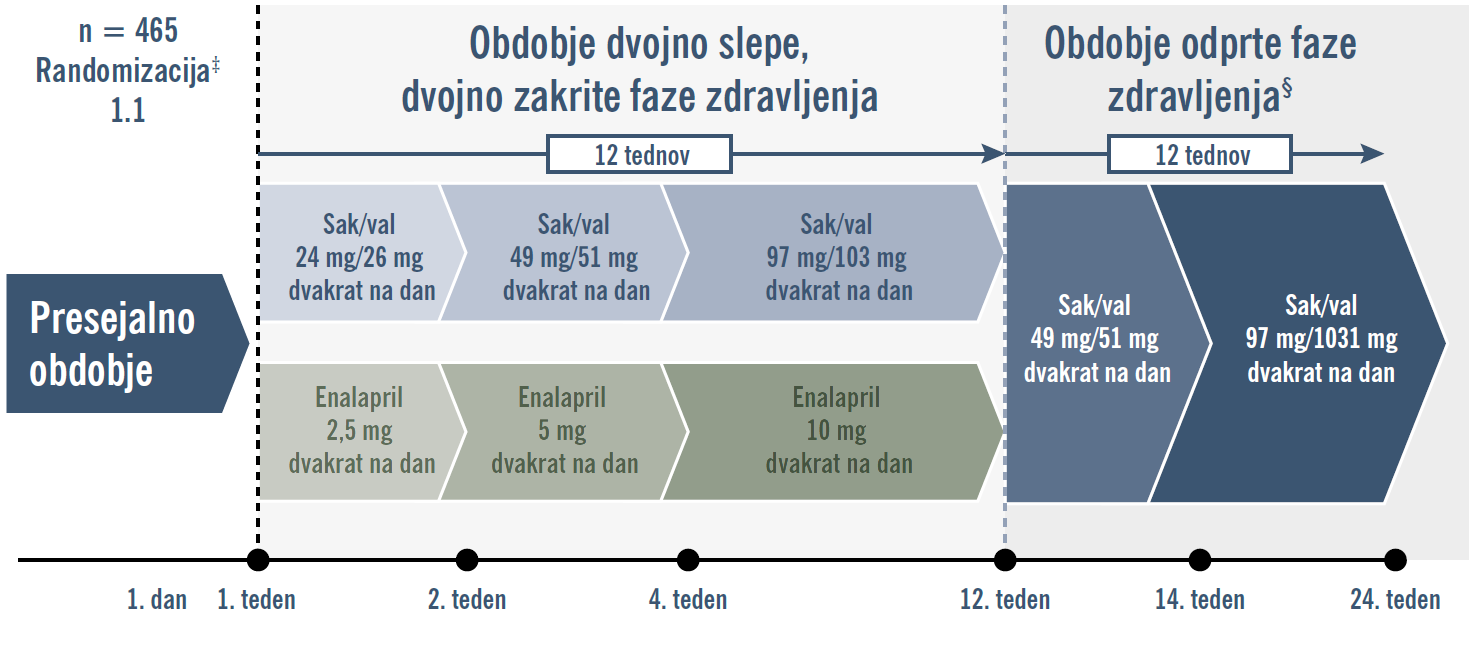
Po prekinitvi zdravljenja z zaviralci ACE/ARB (36-urno obdobje izplavljanja za bolnike, ki so prejemali zaviralce ACE), so sodelujoči bolniki prejemali zdravilo ENTRESTO® (odmerek je izbral raziskovalec skladno z informacijami za predpisovanje v ZDA). Zdravilo ENTRESTO® so titrirali približno vsaka 2 tedna do 60. dneva, ciljni odmerek pa je bil 97/103 mg dvakrat na dan (ali največji odmerek, ki so ga bolniki prenašali). † Bolniki so 12 mesecev prejemali zdravilo ENTRESTO®, namen pa je bil vzdrževati ciljni odmerek 97/103 mg dvakrat na dan (ali največji odmerek, ki so ga bolniki prenašali). Pri bolnikih z nesprejemljivimi neželenimi učinki se je odmerek lahko zmanjšal. Ob vsakem obisku v študiji so ocenili anamnezo, opravili zdravstveni pregled in odvzeli vzorce krvi. Ehokardiograme so izvedli ob izhodišču, po 6 mesecih in po 12 mesecih.
‡ Pri bolnikih, ki so trenutno jemali zaviralce ACE, so izvedli 36-urno izplavljanje.
§ Bolniki, ki so končali dvojno slepo fazo zdravljenja z zdravilom ENTRESTO® 24/26 mg dvakrat na dan, so vstopili v odprto fazo zdravljenja, pri kateri so prejemali enak odmerek.
ACE = angiotenzin-konvertaza (angiotensin-converting enzyme); HF = srčno popuščanje (heart failure); HFrEF = srčno popuščanje z zmanjšanim iztisnim deležem (heart failure with reduced ejection fraction); NT-proBNP = N-terminalni fragment možganskega prohormonskega natriuretičnega peptida (N-terminal fragment of the prohormone brain natriuretic peptide).
VIRI:
McMurray JJ, et al. N Engl J Med. 2014; 371(11): 993–1004.
McMurray JJ, et al. Eur J Heart Fail. 2013; 15(9): 1062–1073.
McMurray JJV, et al. Eur J Heart Fail. 2014; 16(7): 817–825.
Januzzi JL Jr, et al. JAMA 2019; 322(11): 1085–1095.
Desai AS, et al. JAMA 2019; 322(11): 1077–1084.
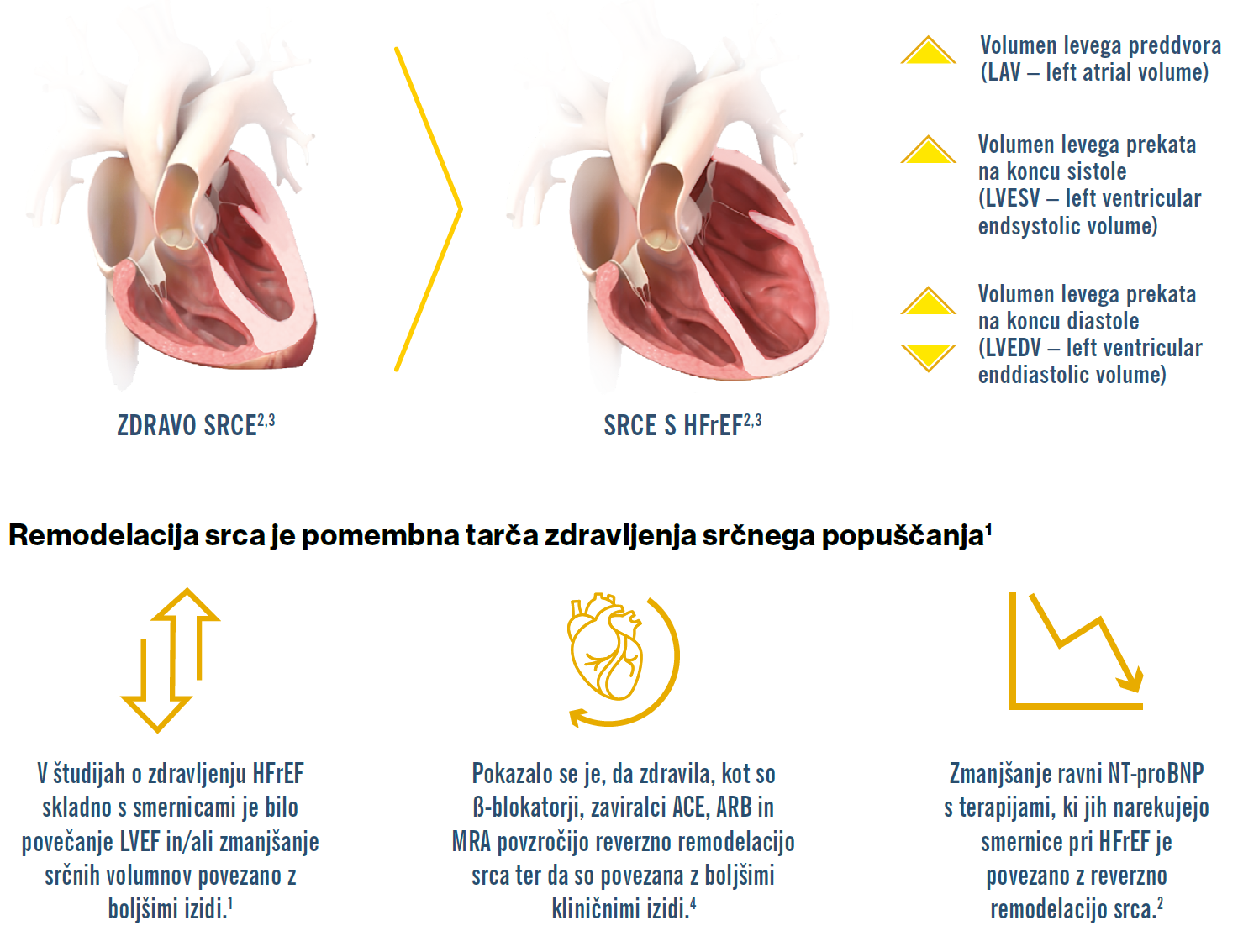
Kaj je remodelacija srca in zakaj je pomembna?
Remodelacija srca je bistvena za patofiziologijo HFrEF. Je pomemben dejavnik napredovanja HFrEF in je povezano s slabimi izidi.1
ACE = angiotenzin-konvertaza (angiotensin-converting enzyme); ARB = zaviralec receptorjev za angiotenzin II (angiotensin II receptor blocker); HFrEF = srčno popuščanje z zmanjšanim iztisnim deležem (heart failure with reduced ejection fraction); MRA = antagonist mineralokortikoidnih receptorjev (mineralocorticoid receptor antagonist); NT-proBNP = N-terminalni fragment možganskega prohormonskega natriuretičnega peptida (N-terminal fragment of the prohormone brain natriuretic peptide).
VIRI:
Drazner MH. JAMA.2019; 322(11):1051–1053.
Januzzi JL Jr, et al. JAMA 2019; 322(11): 1085–1095.
Desai AS, et al. JAMA 2019; 322(11): 1077–1084.
Kramer DG, et al. J Am Coll Cardiol. 2010;56(5):392–406
Kakšni so bili rezultati pri primarnem in sekundarnem opazovanem dogodku pri preskušanju PROVE-HF?
V študiji PROVE-HF so ugotovili, da zdravilo ENTRESTO® povzroča reverzno remodelacijo srca ter izboljša strukturo in funkcijo srca pri bolnikih s HFrEF.1
Cilji študije PROVE-HF1
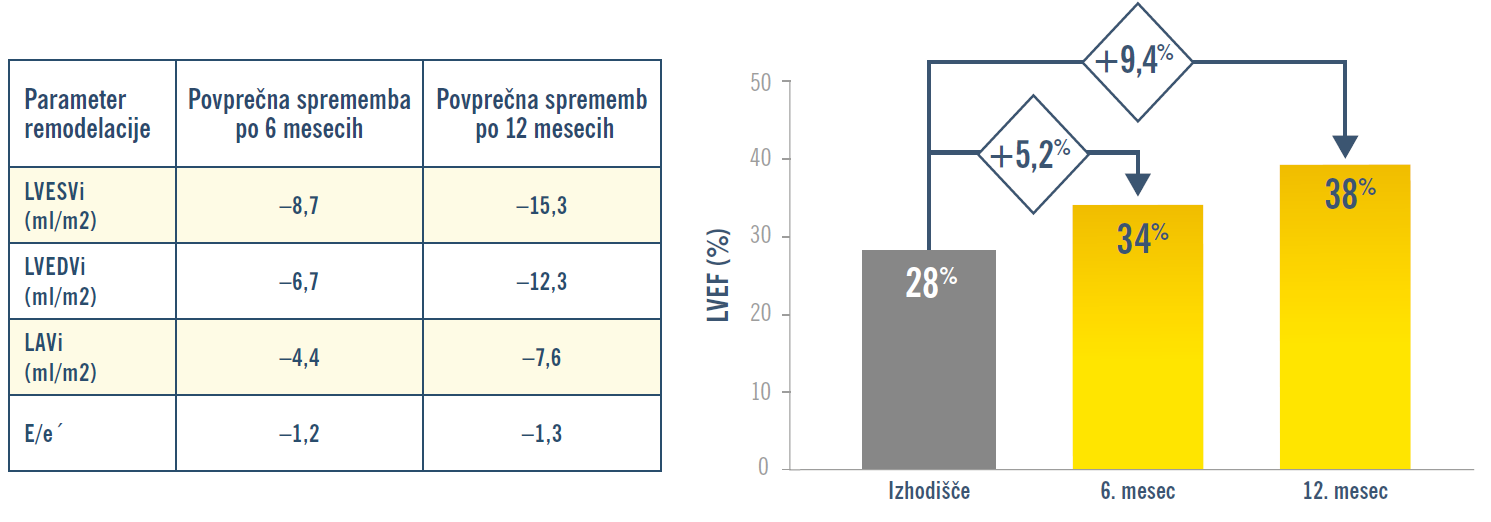
PRIMARNI OPAZOVANI DOGODEK: Povezava med spremembami koncentracij NT-proBNP in parametri remodelacije srca (LVESVi, LVEDVi, LVEF in LAVi) od izhodišča do 12. meseca.*
KLJUČNI SEKUNDARNI OPAZOVANI DOGODKI: Povezava med spremembami koncentracij NT-proBNP in parametri remodelacije srca (LVESVi, LVEDVi, LVEF in LAVi) od izhodišča do 6. meseca in do 12. meseca pri interesnih podskupinah.
PROVE-HF: Zdravilo ENTRESTO® zagotavlja hitro in vztrajno znižanje ravni NT-proBNP že po 14 dneh1
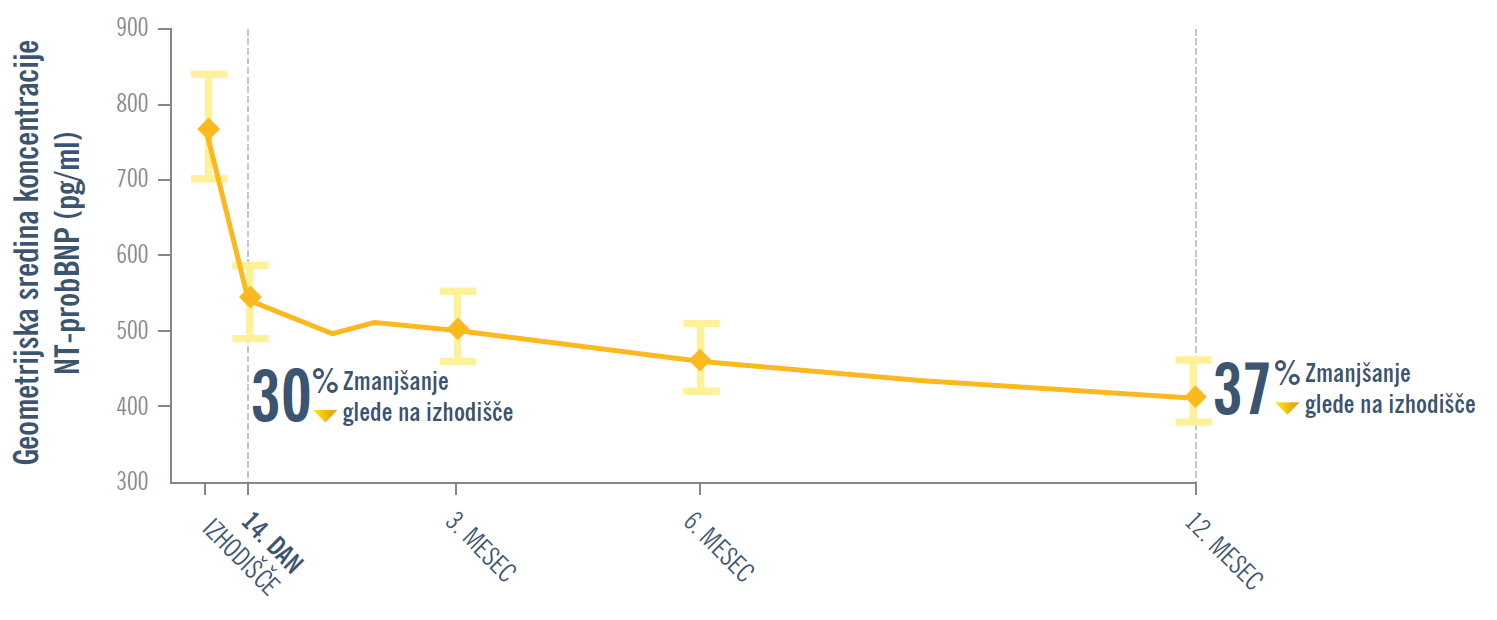
PROVE-HF: Zdravilo ENTRESTO® izboljša ključne ehokardiografske parametre remodelacije srca in povečalo vrednost LVEF1
Dosledni rezultati pri vseh podskupinah, vključno z bolniki, ki še niso prejemali zaviralcev ACE/ARB in bolniki z novo diagnosticiranim HFrEF1
* Korelacija med spremembo koncentracije NT-proBNP in E/e’ je bila dodana v načrt statistične analize pred zaklepom zbirke podatkov.
ACE = angiotenzin-konvertaza (angiotensin-converting enzyme); ARB = zaviralec receptorjev za angiotenzin II (angiotensin II receptor blocker); HFrEF = srčno popuščanje z zmanjšanim iztisnim deležem (heart failure with reduced ejection fraction); LAVi = indeks volumna levega preddvora (left atrial volume index); LVEDVi = indeks volumna levega prekata na koncu diastole (left ventricular end-diastolic volume index); LVEF = iztisni delež levega prekata (left ventricular ejection fraction); LVESVi = indeks volumna levega prekata na koncu sistole (left ventricular end-systolic volume index); NT-proBNP = N-terminalni natriuretični peptid tipa pro-B (N-terminal fragment of the prohormone brain natriuretic peptide).
VIRI:
Januzzi JL Jr, et al. JAMA 2019; 322(11): 1085–1095.
Kakšni so bili rezultati pri primarnem in sekundarnem opazovanem dogodku pri preskušanju EVALUATE-HF?
V študiji EVALUATE-HF ne enalapril ne zdravilo ENTRESTO® nista pomembno zmanjšala togost centralne aorte (remodelacija aorte). Zdravilo ENTRESTO® je zagotovilo hitro izboljšanje remodelacije srca in večje zmanjšanje ravni NT-proBNP v primerjavi z enalaprilom pri bolnikih s HFrEF.1
Cilji študije EVALUATE-HF1
PRIMARNI OPAZOVANI DOGODEK: Razlike med zdravilom ENTRESTO® in enalaprilom pri spremembah togosti aorte, izmerjene z aortno značilno impedanco (Zc = dP/dQ v zgodnji sistoli) pri bonikih s HFrEF od izhodišča do 12. tedna.
KLJUČNI SEKUNDARNI OPAZOVANI DOGODKI: Razlike med zdravilom ENTRESTO® in enalaprilom pri spremembah ključnih parametrov remodelacije srca in ravni NT-proBNP od izhodišča do 12. tedna.
EVALUATE-HF: Zdravilo ENTRESTO® vodi v hitrejše in večje izboljšanje ključnih ehokardiografskih parametrov remodelacije srca v primerjavi z enalaprilom.1
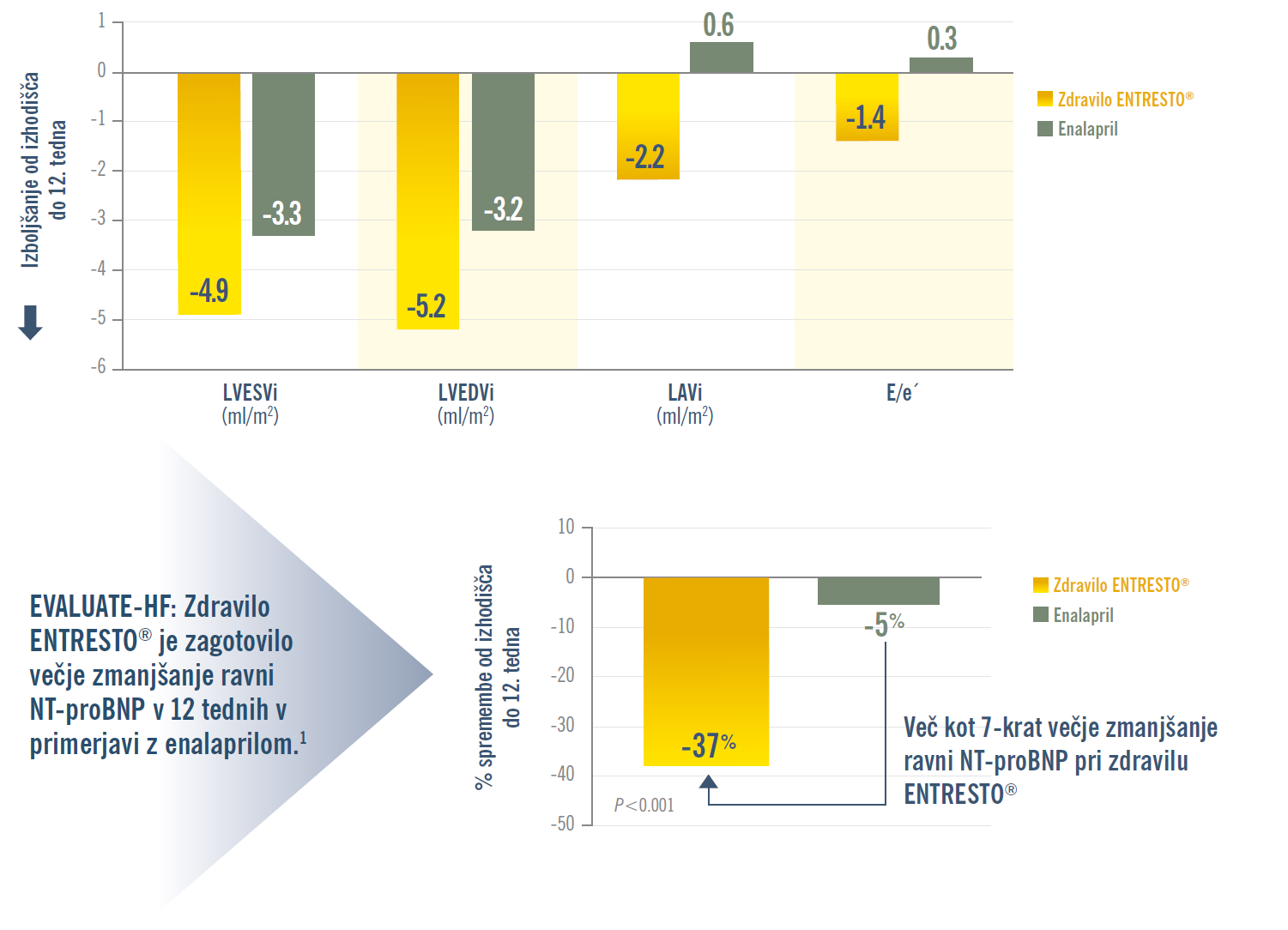
HFrEF = srčno popuščanje z zmanjšanim iztisnim deležem (heart failure with reduced ejection fraction); LAVi = indeks volumna levega preddvora (left atrial volume index); LVEDVi = indeks volumna levega prekata na koncu diastole (left ventricular end-diastolic volume index); NT-proBNP = N-terminalni natriuretični peptid tipa pro-B (N-terminal fragment of the prohormone brain natriuretic peptide).
VIRI:
Desai AS, et al. JAMA 2019; 322(11): 1077–1084.
Kaj rezultati teh preskušanj pomenijo za moje bolnike s HFrEF?
Študiji PROVE-HF in EVALUATE-HF sta pokazali, da zdravilo ENTRESTO® lahko povzroči reverzno remodelacijo srca in izboljša črpalno sposobnost srca.1, 2

Preskušanji PROVE-HF IN EVALUATE-HF sta pokazali:
hitro in pomembno izboljšanje ključnih ehokardiografskih parametrov remodelacije srca v primerjavi z enalaprilom2
pomembno izboljšanje črpalne sposobnosti srca (LVEF) za 9,4 % po 12 mesecih.1
Ti študiji dopolnjujeta študiji PARADIGM-HF in PIONEER-HF ter zagotavljata dokaze za mehanizme, zaradi katerih so izidi pri uporabi zdravila ENTRESTO® boljši kot pri zaviralcih ACE pri bolnikih s HFrEF:
20 % manjše tveganje za smrt zaradi srčno-žilnih vzrokov kot pri zaviralcih ACE.3
21 % manjše tveganje za hospitalizacijo kot pri zaviralcih ACE.3
Izboljšane telesne in družbene dejavnosti ter kakovost življenja.4
Primerljiva varnost in boljša učinkovitost v primerjavi z zaviralci ACE, če se zdravljenje začne po akutni dekompenzaciji srčnega popuščanja.5
ACE = angiotenzin-konvertaza (angiotensin-converting enzyme); CV = srčno-žilni (cardiovascular); HF = srčno popuščanje (heart failure);
HFrEF = srčno popuščanje z zmanjšanim iztisnim deležem (heart failure with reduced ejection fraction); LVEF = iztisni delež levega prekata (left
ventricular ejection fraction).
VIRI:
Januzzi JL Jr, et al. JAMA 2019; 322(11): 1085–1095.
Desai AS, et al. JAMA 2019; 322(11): 1077–1084.
Povzetek glavnih značilnosti zdravila Entresto 24 mg/26 mg, 49 mg/51 mg in 97 mg/103 mg filmsko obložene tablete. Datum zadnje revizije besedila maj 2025.
Chandra A, et al. JAMA Cardiol. 2018; 3(6): 498–505.
Velazquez EJ, et al. N Engl J Med. 2019; 380(6): 539-548.
UVEDBA ZDRAVILA V BOLNIŠNICI
V katerih preskušanjih so raziskovali uvedbo zdravila ENTRESTO v bolnišnici? [ŠTUDIJA PIONEER-HF]?
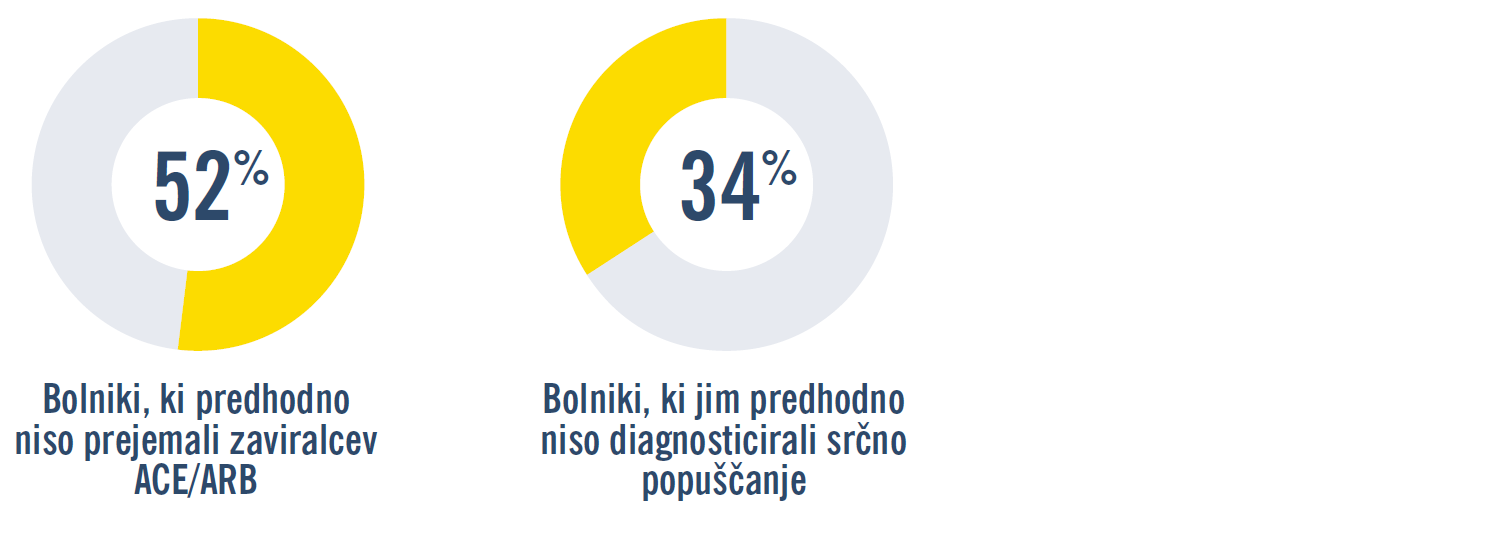
Uvedbo zdravila ENTRESTO® v bolnišnici so raziskovali v dveh randomiziranih kliničnih preskušanjih, ki sta znova potrdili njegovo večjo učinkovitost v primerjavi z zaviralci ACE: v študiji PIONEER-HF so ocenili biološke označevalce stresa na srčno steno kot primarni opazovani dogodek; v študiji TRANSITION so primerjali varnost in prenašanje uvedbe zdravila ENTRESTO® pred odpustom in po odpustu iz bolnišnice po hospitalizaciji zaradi akutnega dekompenziranega srčnega popuščanja. V obeh preskušanjih je sodeloval širok razpon bolnikov s HFrEF, vključno z bolniki, ki še niso bili zdravljeni z zaviralci ACE/ARB (52 % oz. 23 %) in novo diagnosticiranimi bolniki (de novo) s HF (34 % oz. 29 %), ki so bili stabilizirani po epizodi akutnega dekompenziranega srčnega popuščanja.1
PIONEER-HF je bilo prospektivno, multicentrično, dvojno slepo, randomizirano, nadzorovano klinično preskušanje, zasnovano za oceno varnosti, prenašanja in učinkovitosti uvedbe zdravila ENTRESTO® v bolnišnici v primerjavi z enalaprilom pri 881 odraslih bolnikih v Združenih državah Amerike s HFrEF (EF ≤ 40 % in NT-proBNP ≥ 1600 pg/ml ali BNP ≥ 400 pg/ml), ki so bili stabilizirani med hospitalizacijo zaradi akutnega dekompenziranega srčnega popuščanja. Primarni opazovani dogodek je bila časovno povprečna proporcionalna sprememba koncentracije NT-proBNP od izhodišča do konca 4. in 8. tedna.
Uvedba zdravila ENTRESTO® v bolnišnici je zagotovila večje zmanjšanje koncentracije NT-proBNP kot zdravljenje z enalaprilom. Ugotovili so tudi, da je enako varno kot zaviralci ACE in da je povezano s pomembnim zmanjšanjem tveganja za resne klinične izide (smrt, vnovična hospitalizacija zaradi srčnega popuščanja, vsaditev pripomočka za mehansko podporo levemu prekatu ali uvrstitev na seznam za transplantacijo srca).2
PIONEER-HF: Izbrani demografski podatki2
ACE = angiotenzin-konvertaza (angiotensin-converting enzyme); ARB = zaviralec angiotenzinskih receptorjev (angiotensin receptor blocker); EF = iztisni delež (ejection fraction); HF = srčno popuščanje (heart failure); HFrEF = srčno popuščanje z zmanjšanim iztisnim deležem (heart failure with reduced ejection fraction); LVEF = iztisni delež levega prekata (left ventricular ejection fraction); NYHA = Newyorško združenje za srce (New York Heart Association); NT-proBNP = N-terminalni natriuretični peptid tipa pro-B (N-terminal pro-B-type natriuretic peptide).
VIRI:
Ambrosy AP, et al. Eur J Heart Fail. 2019. doi:10.1002/ejhf.1540.
Velazquez EJ, et al. N Engl J Med. 2019;380(6):539–548.
V katerih preskušanjih so raziskovali uvedbo zdravila ENTRESTO® v bolnišnici?
TRANSITION je bilo randomizirano, odprto klinično preskušanje z vzporednimi skupinami, v katerem so primerjali uvedbo zdravila ENTRESTO® pred odpustom in po odpustu (v 1–14 dneh) pri bolnikih s HFrEF (NYHA razred II–IV HF LVEF ≤40%) po hemodinamični stabilizaciji po epizodi akutnega dekompenziranega srčnega popuščanja. Študijo so izvedli v 19 državah po vsem svetu pri več kot 1000 bolnikih, študija pa je pokazala, da so bolniki podobno dobro prenašali uvedbo zdravila ENTRESTO® v bolnišnici ali kmalu po odpustu.1,2
Študija TRANSITION je pokazala, da je približno polovica bolnikov s HFrEF, stabiliziranih po akutnem dekompenziranem srčnem popuščanju, dosegla ciljni odmerek zdravila ENTRESTO® v 10 tednih, 86 % ali več bolnikov je lahko vzdrževalo kateri koli odmerek zdravila ENTRESTO® več kot 2 tedna, po priporočilih za uvedbo zdravila in titriranje odmerka. Stopnja neželenih dogodkov in trajnih
prekinitev zdravljenja je bila majhna glede na izjemno ranljivo populacijo bolnikov po akutni dekompenzaciji srčnega popuščanja.1, 2
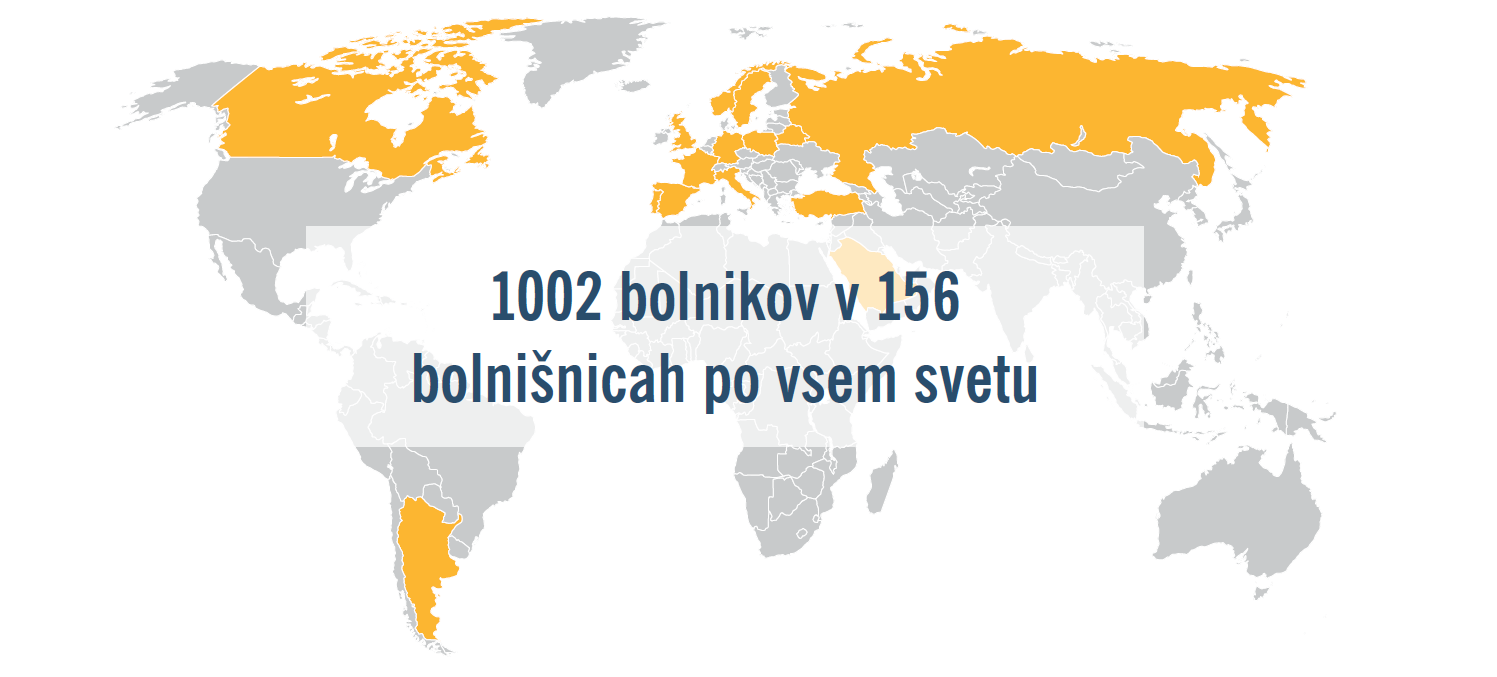
Ugotovitve študije TRANSITION dopolnjujejo ugotovitve študije PIONEER-HF in kažejo, da je zgodnja uvedba zdravila ENTRESTO® pri širokem razponu bolnikov z HFrEF, ki so bili nedavno sprejeti v bolnišnico zaradi akutnega dekompenziranega srčnega popuščanja, izvedljiva bodisi v bolnišnici ali kmalu po odpustu.2
HF = srčno popuščanje (heart failure); HFrEF = srčno popuščanje z zmanjšanim iztisnim deležem (heart failure with reduced ejection fraction); LVEF = iztisni delež levega prekata (left ventricular ejection fraction); NYHA = Newyorško združenje za srce (New York Heart Association).
VIRI:
Pascual-Figal D, et al. ESC Heart Fail. 2018;5(2):327–336.
Wachter R, et al. Eur J Heart Fail. 2019. doi: 10.1002/ejhf.1498.
Zakaj moram uvesti zdravilo ENTRESTO® v bolnišnici, preden bolnika odpustim?
Bolniki, hospitalizirani zaradi HFrEF, so posebej ranljivi po odpustu iz bolnišnice: ena četrtina bolnikov, hospitaliziranih zaradi srčnega popuščanja bo znova hospitalizirana v 30 dneh od odpusta.1 V tem obdobju je tveganje za smrt pri teh bolnikih 2-krat večje kot v obdobju 6–12 mesecev po odpustu.2
Ni razloga za čakanje: študija PIONEER-HF je pokazala superiornost uvedbe zdravila ENTRESTO® v bolnišnici v primerjavi z zaviralci ACE. Zdravilo ENTRESTO® je pokazalo hitro in večje zmanjšanje koncentracije NT-proBNP v primerjavi z zaviralci ACE, ki je opazno že po 1 tednu. Uvedba zdravila ENTRESTO® v bolnišnici je bila povezana z zmanjšanjem tveganja za resne klinične izide, kot sta vnovična hospitalizacija zaradi srčnega popuščanja ali smrt zaradi srčno-žilnih vzrokov, kmalu po odpustu. Odprta podaljšana faza študije PIONEER-HF je pokazala, da prej ko se uvede zdravilo ENTRESTO® po stabilizaciji akutnega dekompenziranega srčnega popuščanja, boljša je prognoza pri bolnikih s HFrEF.3,4
PIONEER-HF: zgodnja uvedba zdravila ENTRESTO® v bolnišnici
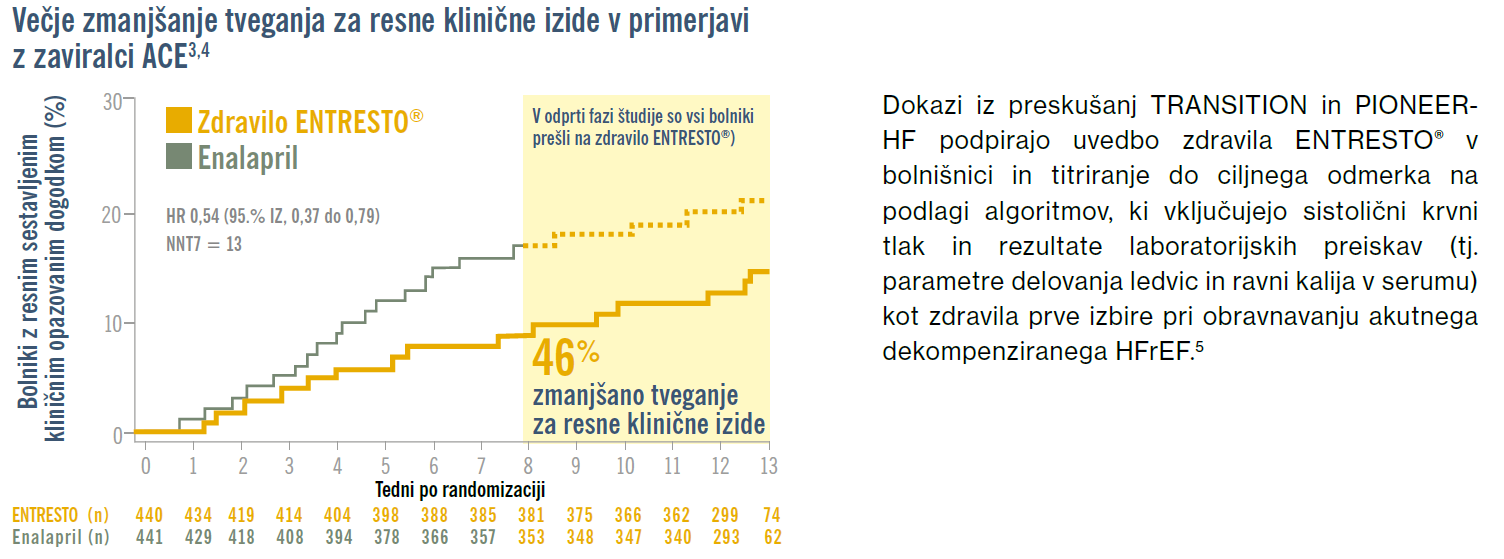
Zaradi preskušanj PIONEER-HF in TRANSITION je tudi razlog, da strokovni konsenz HFA-ESC podpira zdravilo ENTRESTO®
kot zdravilo prve izbire pri bolnikih, hospitaliziranih zaradi HFrEF.6
* Namesto zaviralcev ACE ali ARB.
ACE = angiotenzin-konvertaza (angiotensin-converting enzyme); ARB = zaviralec angiotenzinskih receptorjev (angiotensin receptor blocker); HF = srčno popuščanje (heart failure); HFA-ESC = Združenje za srčno popuščanje Evropskega društva za kardiologijo (Heart Failure Association of the European Society of Cardiology); HFrEF = srčno popuščanje z zmanjšanim iztisnim deležem (heart failure with reduced ejection fraction); HR = razmerje ogroženosti (hazard ratio); NNT = število bolnikov, ki jih je treba zdraviti (number needed to treat).
VIRI:
Yancy CW, et al. Circulation. 2013;128(16):e240–e327.
Solomon SD, et al. Circulation. 2007;116(13):1482–1487.
Velazquez EJ, et al. N Engl J Med. 2019;380(6):539–548.
DeVore AD, et al. Poster presented at American College of Cardiology 2019; March 16–19, 2019; New Orleans, LA.
Ambrosy AP, et al. Eur J Heart Fail. 2019. doi:10.1002/ejhf.1540.
Seferovic PM, et al. Eur J Heart Fail. 2019. doi: 10.1002/ejhf.1531.
Cook RJ, Sackett DL. BMJ. 1995;310(6977):452–454.
Ali je varno uvesti zdravilo ENTRESTO® v bolnišnici?
Bolnišnica zagotavlja neprekinjeno spremljanje in zdravljenje, zato je idealno okolje za uvedbo zdravila ENTRESTO®.
Študija PIONEER-HF je pokazala, da sta varnostni profil in profil prenašanja zdravila ENTRESTO®, uvedenega kmalu po stabilizirani epizodi akutnega dekompenziranega srčnega popuščanja, primerljiva z zaviralci ACE.1
Preskušanje TRANSITION je dodatno potrdilo, da sta varnostni profil in prenašanje zdravila Entresto (če se le-ta uvede v bolnišnici ali kmalu po odpustu) primerljiva z varnostnim profilom zaviralcev beta in zaviralcev ACE/ARB.2
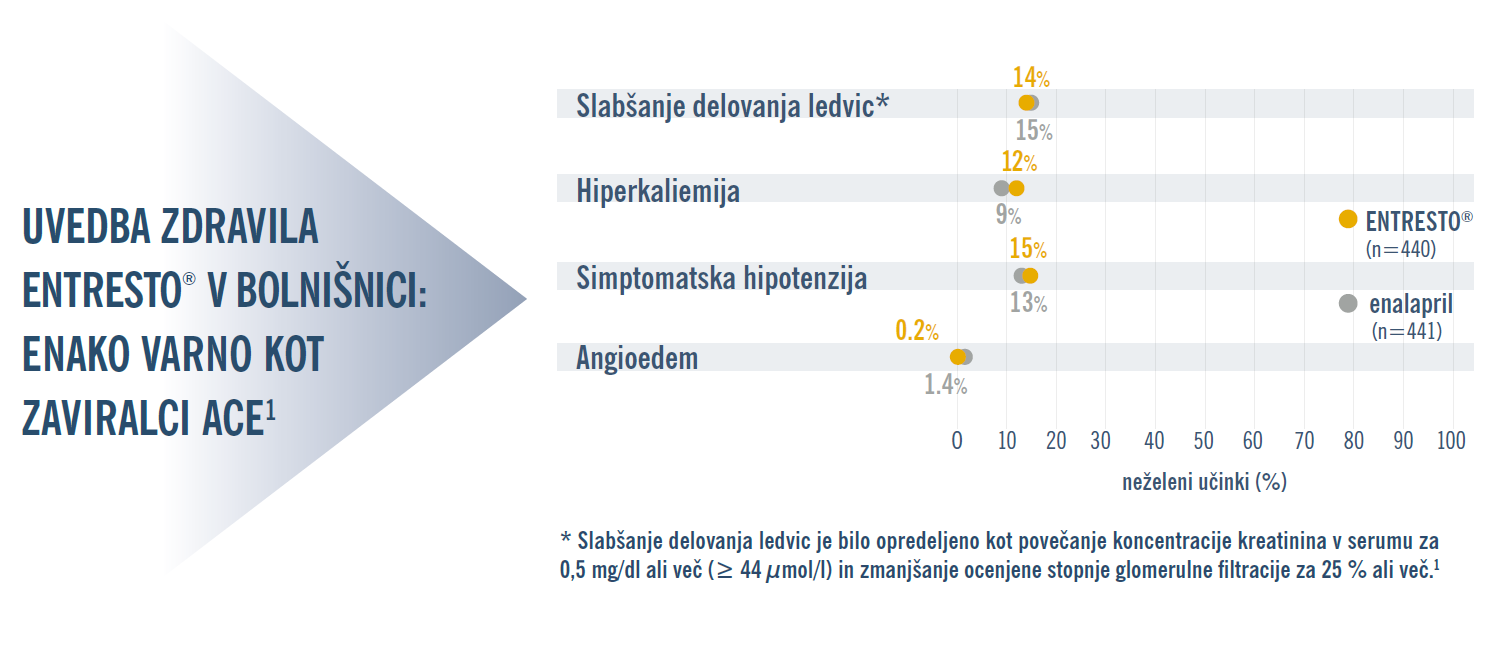
ACE = angiotenzin-konvertaza (angiotensin-converting enzyme); ARB = zaviralec receptorjev za angiotenzin (angiotensin receptor blocker); HF = srčno popuščanje (heart failure).
VIRI:
Velazquez EJ, et al. N Engl J Med. 2019;380(6):539–548.
Wachter R, et al. Eur J Heart Fail. 2019. doi: 10.1002/ejhf.1498.
Kako hitro po akutnem dekompenziranem srčnem popuščanju se lahko uvede zdravljenje z zdravilom ENTRESTO®?
Ko so bolniki hemodinamično stabilni, se lahko v bolnišnici uvede zdravilo ENTRESTO®.1
Hemodinamična stabilizacija (kot je opredeljena v študiji PIONEER-HF):1
LVEF ≤ 40 %.
SBP ≥ 100 mmHg v zadnjih 6 urah.
Brez povečanja uporabe intravenskih diuretkov ali brez uporabe intravenskih vazodilatatorjev v zadnjih 6 urah in brez uporabe intravenskih inotropov 24 ur pred randomizacijo.

HF = srčno popuščanje (heart failure); LVEF = iztisni delež levega prekata (left ventricular ejection fraction); SBP = sistolični krvni tlak (systolic blood pressure).
VIRI:
Velazquez EJ, et al. N Engl J Med. 2019;380(6):539–548.
SMERNICE
Kakšno je priporočilo evropskega združenja za kardiologijo (ESC) iz leta 2021 za uporabo zdravila ENTRESTO® pri srčnem popuščanju?
Smernice ESC HF dajejo zdravilu ENTREST O® a priporočilo razreda I za zdravljenje kroničnih simptomatskih bolnikov s HFr.E F. 1
Zdravilo ENTRESTO® so dodali v smernice ESC HF 2016 z priporočilom razreda I samo 6 mesecev po odobritvi v EU.1,2,3

Za celotne smernice ESC HF za leto 2021 obiščite spletno stran
https://www.escardio.org/Guidelines/Clinical-Practice-Guidelines/Acute-and-Chronic-Heart-Failure
EU = Evropska unija; ESC = Evropsko združenje za kardiologijo (European Society of Cardiology); HF = srčno popuščanje (heart failure); HFrEF = srčno popuščanje z zmanjšanim iztisnim deležem (heart failure with reduced ejection fraction).
VIRI:
2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: Developed by the Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC) With the special contribution of the Heart Failure Association (HFA) of the ESC, European Heart Journal, Volume 42, Issue 36, 21 September 2021.
European Medicines Agency EPAR summary for the public. https://www.ema.europa.eu/en/medicines/human/EPAR/entresto(link is external). Dostopano [Oktober 2023]
Ponikowski P, et al. Eur Heart J. 2016;18(8):891-975.
Ali je zdravilo ENTRESTO® na voljo tudi pediatrični populaciji bolnikov s srčnim popuščanjem?
Za zdravilo ENTRESTO® je bila odobrena indikacija za pediatrično populacijo bolnikov s srčnim popuščanjem (pri otrocih in mladostnikih, ki so stari eno leto ali več). S to spremembo sta za pediatrično indikacijo odobreni dve obliki zdravila Entresto:
Entresto filmsko obložene tablete (tablete so prisotne na trgu za odraslo populacijo, vendar niso razvrščene na listo ZZZS za pediatrično populacijo).
Entresto zrnca v kapsulah za odpiranje (gre za novo farmacevtsko obliko, ki ni na voljo na slovenskem trgu)1
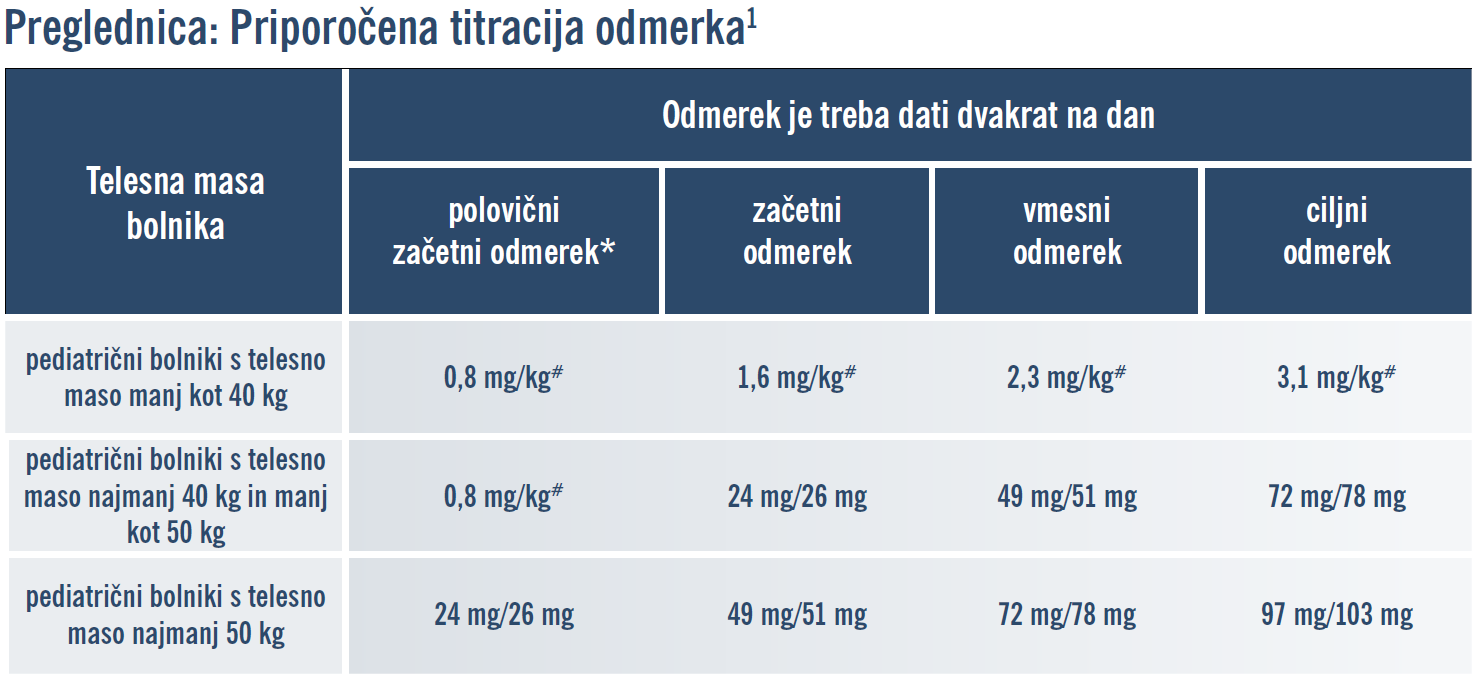
*Polovični začetni odmerek je priporočen za bolnike, ki prej niso prejemali zaviralca ACE ali zaviralca receptorjev angiotenzina II ali so prejemali nizke odmerke teh zdravil, za bolnike z okvaro ledvic (z ocenjeno hitrostjo glomerulne filtracije [eGFR - estimated glomerular filtration rate] <60 ml/min/1,73 m2) in za bolnike z blago okvaro jeter (glejte posebne skupine bolnikov).
# Odmerki 0,8 mg/kg, 1,6 mg/kg, 2,3 mg/kg in 3,1 mg/kg se nanašajo na skupno količino sakubitrila in valsartana, ki jo je treba bolniku dati v obliki zrnc.
ACE = angiotenzin-konvertaza (angiotensin-converting enzyme); eGFR = ocenjena stopnja glomerulne filtracije (estimated glomerular filtration rate); ZZZS = Zavod za zdravstveno zavarovanje Slovenije.
VIRI:
Povzetek glavnih značilnosti zdravila Entresto 24 mg/26 mg, 49 mg/51 mg in 97 mg/103 mg filmsko obložene tablete. Datum zadnje revizije besedila maj 2025.
VIR::
Povzetek glavnih značilnosti zdravila Entresto 24 mg/26 mg, 49 mg/51 mg in 97 mg/103 mg filmsko obložene tablete. Datum zadnje revizije besedila maj 2025.
FA-11513270
