Dette nettstedet er kun for helsepersonell som lege, offentlig godkjent sykepleier og farmasøyt
TRANSITION:
Tolerabilitet er uavhengig om Entresto ble initiert på sykehus eller rett etter en utskrivelse.1
TRANSITION undersøkte tolerabilitet og sikkerhet ved tidlig oppstart av Entresto hos pasienter innlagt på sykehus på grunn av akutt dekompensert hjertesvikt sammenlignet med oppstart rett etter utskrivelse. Tolerabilitet og sikkerhet var sammenlignbar i begge gruppene og omtrent 50 % av pasientene oppnådde måldose etter 10 uker.
Metode
TRANSITION var en randomisert, multisenter ikke-blindet studie som inkluderte 1002 pasienter (NYHA klasse II-IV) innlagt på grunn av akutt hjertesvikt.
Pasientene ble randomisert til å:
- initiere Entresto ikke senere enn 12 timer før utskrivelse
- initiere Entresto mellom dag 1 og 14 etter utskrivelse
Startdose var 24 mg/26 mg eller 49 mg/51 mg to ganger om dagen med en opp- eller nedtrapping etter tolerabilitet.
- Primærendepunkt: Andel pasienter som oppnådde måldosen, 97 mg/103 mg Entresto to ganger om dagen etter ti uker med behandling.
Pasientene skulle være over 18 år, ha redusert ejeksjonsfraksjon ≤ 40 %, være innlagt på sykehus på grunn av akutt dekompensert hjertesvikt, ha systolisk blodtrykk ≥ 100 mmHg og være hemodynamisk stabile før oppstart med Entresto.
Resultat
Etter ti uker var andelen som oppnådde måldosen (97 mg/103 mg to ganger om dagen) 45,4 % i gruppen som startet opp før utskrivelse og 50,7 % i gruppen som startet opp rett etter utskrivelse (RR 0,90; 95 % KI, 0,79-1,02). Andel pasienter som opprettholdt bruken av Entresto, uavhengig av dose, var 86 % i gruppen som begynte før utskrivelse og 89,6 % i gruppen som begynte etter utskrivelse (RRR 0,96; KI 0,92-1,01).
Sikkerhet
Avbrutt behandling på grunn av bivirkninger oppstod hos 7,3 % hos pasientene som fikk Entresto før utskrivelse og 4,9 % hos pasienter som fikk Entresto etter utskrivelse (RRR 1,49; 95 % KI 0,90-2,46).
Subanalyse fra TRANSITION: Tidlig oppstart av Entresto hos pasienter med akutt hjertesvikt og nedsatt nyrefunksjon(^1,2)
Bakgrunn og hensikt med subanalysen
Behandling av pasienter med hjertesvikt med redusert ejeksjonsfraksjon (HFrEF) og samtidig nedsatt nyrefunksjon er krevende grunnet risiko for ytterligere forverring av nyrefunksjonen, især etter akutt dekompensert hjertesvikt. Denne subanalysen søkte å belyse betydning av nedsatt nyrefunksjon (eGFR ≥30 til <60 ml/min/1,73 m2) på tidlig oppstart, opptitrering og tolerabilitet av Entresto i hemodynamisk stabiliserte HFrEF-pasienter innlagt på grunn av akutt dekompensering.
Studiepopulasjon og studiedesign
TRANSITION-studien inkluderte voksne pasienter (≥ 18 år) som var innlagt grunnet en akutt dekompensasjonshendelse (de novo hjertesvikt eller forverring av kronisk hjertesvikt), med LVEF ≤40 %, NYHA-klasse II til IV, og systolisk blodtrykk ≥ 100 mm Hg ved screening. Studiedeltakerne ble randomisert 1:1 til oppstart av Entresto enten under innleggelsen eller etter utskrivning. Pasientene mottok behandling med Entresto i ti uker fra randomisering, og ble fulgt i ytterligere 16 uker. Pasienter med eGFR <30 ml/min/1,73m2 ved baseline var ekskludert fra studien.
I denne subanalysen ble HFrEF-pasienter innlagt grunnet akutt hjertesvikt med samtidig nedsatt nyrefunksjon (eGFR ≥30 til <60 ml/min/1,73 m2), heretter kalt subgruppe nyresykdom (n=476) sammenliknet med pasienter med bevart nyrefunksjon (eGFR >60 ml/min/1,73m2) ved baseline, heretter kalt subgruppe ikke-nyresykdom (n=483).
Endepunkter
Primært endepunkt:
- Andel av pasienter som oppnådde måldosen av Entresto (97 mg/103 mg to ganger daglig (bid)) ti uker etter randomisering, uavhengig av doseendringer eller avbrudd samt tidspunkt for oppstart
Sekundære endepunkter:
- Andel av pasienter som oppnådde og opprettholdt dosering på 49 mg/51 mg og/eller 97 mg/103 mg bid i ≥ 2 uker i løpet av behandlingsperioden på ti uker.
- Andel av pasienter som oppnådde en hvilken som helst dosering av Entresto i ≥ 2 uker i løpet av behandlingsperioden på ti uker.
- Rate av permanent diskontinuering av Entresto grunnet bivirkninger i løpet av behandlingsperioden på ti uker.
- Tid til første reinnleggelse uansett årsak og hjertesviktrelatert reinnleggelse i løpet av 26 uker fra utskrivning etter indeksinnleggelsen.
Prespesifisert eksploratorisk endepunkt:
- Endring i biokjemiske markører for myokardveggstress og myokardskade (NT-proBNP og høysensitiv troponin T (hsTnT)). Biomarkørene ble målt etter hemodynamisk stabilisering ved randomisering, ved utskrivelse og fire og ti uker etter randomisering.
Sikkerhetsendepunkter:
Vitale tegn, laboratoriemålinger og bivirkninger rapportert i løpet av studieperioden ble evaluert i begge studiegruppene. Bivirkninger av spesiell interesse inkluderte hypotensjon, hyperkalemi, nedsatt nyrefunksjon og angioødem. Bivirkninger var investigatorrapporterte.
Resultater
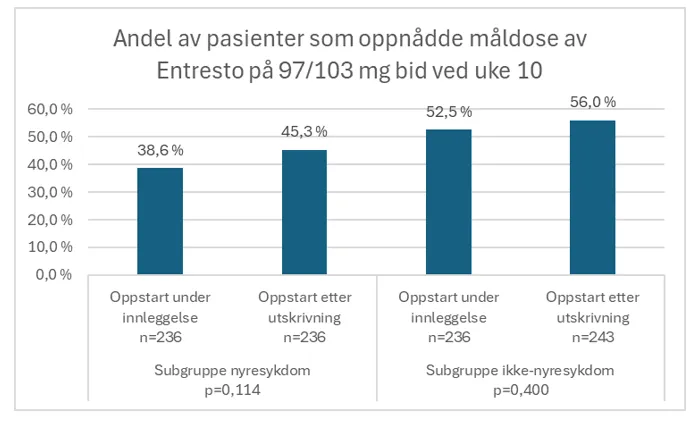
Primærendepunkt: Måldosen av Entresto (97 mg/103 mg bid) ble ved uke 10 oppnådd hos 41,9 % av pasienter med nyresykdom og 54,3 % av pasienter uten nyresykdom (p<0,001).

Det var ingen signifikant forskjell på andelen pasienter som oppnådde måldose ved uke ti mellom gruppen som fikk oppstart av Entresto under innleggelse og gruppen som fikk oppstart etter utskrivning:
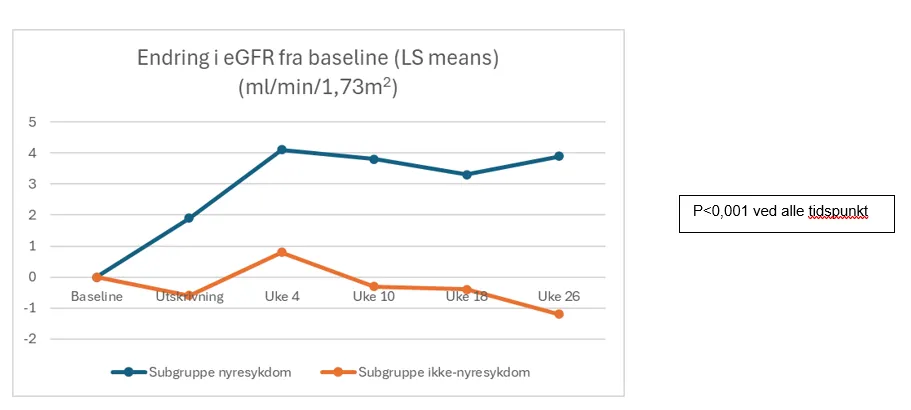
Endring i eGFR fra baseline:
Behandling med Entresto var assosiert med større forbedring i eGFR i subgruppen med nyresykdom enn i subgruppen uten nyresykdom (endring fra baseline LS mean 4,1 ml/min/1,73m2, 95 % KI 2,2-6,1; p<0,001).
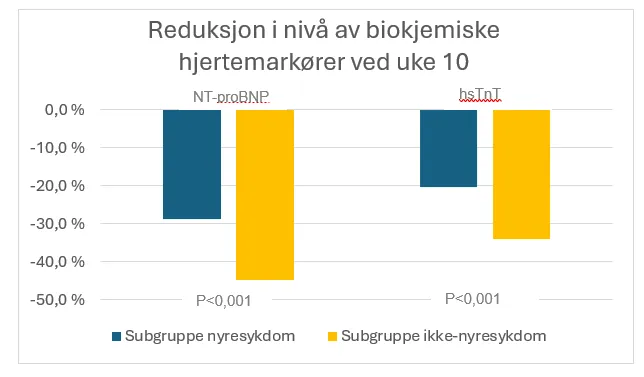
Endring i biokjemiske hjertemarkører fra baseline
Biokjemiske hjertemarkører ble signifikant forbedret i både nyresykdom- og ikke-nyresykdom subgruppen, dog var forbedringen større i subgruppen uten nyresykdom:
Resultater: sikkerhet og tolerabilitet
- Andelen pasienter som avbrøt behandlingen med Entresto grunnet bivirkninger i løpet av de ti behandlingsukene var 9,1 % i subgruppen med nyresykdom og 2,5 % i subgruppen uten nyresykdom (p<0,001)
- De hyppigst rapporterte bivirkningene i både nyresykdom- og ikke-nyresykdom subgruppen var hyperkalemi, hypotensjon og hjertesvikt.
- Nyresykdom ved baseline var assosiert med økt forekomst av hyperkalemi og hjertesvikt.
- I løpet av behandlingsperioden på ti uker ble det rapportert hyppigere nyrerelaterte bivirkninger i nyresykdom subgruppen enn i ikke-nyresykdom subgruppen.
- Man så ingen vesentlig forskjell i forekomst av bivirkninger i gruppen som hadde oppstart av Entresto under sykehusinnleggelsen sammenliknet med gruppen som hadde oppstart etter utskrivning.
Sikkerhetshendelse | Forekomst i subgruppe | Forekomst i subgruppe | p-verdi |
Hyperkalemi | 16,3 | 6,5 | < 0,001 |
Hjertesvikt | 9,7 | 5,6 | 0,029 |
Redusert nyrefunksjon | 6,4 | 2,1 | 0,002 |
Nyresvikt | 3,6 | 0,6 | 0,002 |
Akutt nyreskade | 2,8 | 0,4 | 0,002 |
Konklusjon
De fleste pasientene med HFrEF og samtidig nyresykdom innlagt for akutt hjertesvikt tolererte oppstart av Entresto under sykehusinnleggelsen og viste signifikant bedring i eGFR og hjertebiomarkører fra baseline til uke fire, noe som vedvarte gjennom studiens varighet.
Tatt i betraktning den dokumenterte nytten av Entresto hos pasienter med HFrEF, bør ikke samtidig nedsatt nyrefunksjon hindre klinikere i å initiere Entresto tidlig etter hemodynamisk stabilisering av en akutt dekompensering, samt sørge for opptitrering til høyeste tolerte dose.
Man bør være oppmerksom på en økt risiko for hyperkalemi og skrøpelighet hos enkelte av HFrEF-pasientene med nedsatt nyrefunksjon. Hos disse bør en vurdere en langsommere og mer gradvis opptrapping av Entresto.
Referanser:
- Wachter R, Senni M, Belohlavek J et al. Initiation of sacubitril/valsartan in haemodynamically stabilised heart failure patients in hospital or early after discharge: primary results of the randomised TRANSITION study. Eur J of heart failure (2019), 21, 998-1007
- Straburzynska-Migaj E, Senni M, Wachter W et al; Early Initiation of Sacubitril/Valsartan in Patients With Acute Heart Failure and Renal Dysfunction: An Analysis of the TRANSITION Study. J of Card Fail. 2024 Mar;30(3):425-435
Sikkerhetsinformasjon
Entresto (sakubitril/valsartan) filmdrasjerte tabletter er indisert til behandling av symptomatisk kronisk hjertesvikt med redusert ejeksjonsfraksjon hos voksne. Anbefalt startdose er 1 tablett med 49 mg/51 mg to ganger daglig. Dosen bør dobles i løpet av 2-4 uker til måldose med 1 tablett med 97 mg/103 mg to ganger daglig. Kontraindikasjoner inkluderer samtidig bruk av ACE-hemmer, tidligere angioødem, alvorlig nedsatt leverfunksjon, og graviditet i andre og tredje trimester. Behandlingen skal ikke initieres før 36 timer etter siste dose med ACE-hemmer, og kun dersom systolisk blodtrykk er ≥100 mmHg. De vanligste bivirkningene er hypotensjon, hyperkalemi og nedsatt nyrefunksjon. Ikke anbefalt ved terminal nyresykdom.
Entresto tilhører reseptgruppe C og har forhåndsgodkjent refusjon (§2).
Refusjonsberettiget bruk: Behandling av symptomatisk kronisk hjertesvikt med redusert ejeksjonsfraksjon (≤35 %) hos pasienter som tidligere er behandlet med både betablokker og ACE-hemmer eller ARB.
Pris: Entresto 24 mg/26 mg, 28 stk: kr 716,20. Entresto 49 mg/51 mg, 56 stk: kr 1396,10 – 168 stk: kr 4115,70. Entresto 97 mg/103 mg, 56 stk: kr 1396,10 – 168 stk: kr 4115,70
Se felleskatalogen for mer informasjon.
