パンくず
セムブリックス FAQ
製品FAQは医療に従事する先生方からよくご質問いただく内容をまとめたものです。記載している情報はあくまで参考情報としてお取り扱いいただき、医療上のご判断は医療従事者の裁量と責任のもとに行っていただきますようお願い致します。
製品のご使用にあたっては、最新の電子化された添付文書(電子添文)をご確認ください。製品に関してご不明な点がございましたら、弊社お問い合わせ窓口にお問い合わせください。
1.特定の背景を有する患者
肝機能障害のある患者に投与する際に、投与量の調節は必要ですか?
肝機能障害患者を対象とした海外臨床試験1)及び母集団薬物動態解析の結果より、軽度、中等度、及び重度の肝機能障害患者に対して本剤の投与量調節は必要ないと考えられました。
<肝機能障害患者を対象とした海外臨床試験(A2103試験)>
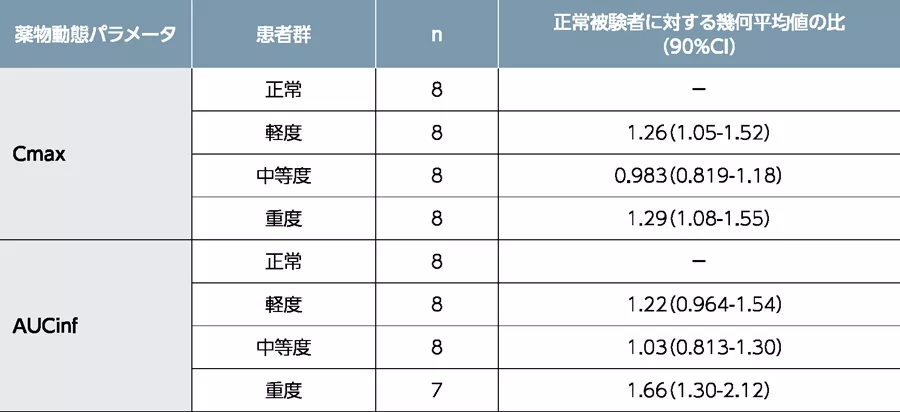
本剤40mgを空腹時に単回経口投与したとき、肝機能が正常な被験者に対する軽度(Child-Pugh分類A)、中等度(Child-Pugh分類B)、及び重度(Child-Pugh分類C)の肝機能障害患者での、本剤のCmax及びAUCinfの幾何平均値の比はそれぞれ下表の通りでした。
X2101試験で、1回200mgを1日2回投与注)まで本剤のMTDは特定されていないことから、1回40mgを1日2回投与時の肝機能障害患者での曝露量の増加は、臨床的に意味のある変動ではないと考えられました。
<母集団薬物動態解析>
X2101試験及びA2301/ASCEMBL試験に参加した肝機能が正常な患者(308例)及び軽度の肝機能障害患者(45例)を含めた母集団薬物動態解析の結果、軽度の肝機能障害は本剤の薬物動態に統計的に有意な影響を及ぼしませんでした。
注)本剤の承認された用法及び用量は「通常、成人にはアシミニブとして1回80mgを1日1回、空腹時に経口投与する。なお、患者の状態により適宜減量する。」である。
(参考)
1) Hoch M et al. : J Clin Pharmacol. 2021 ; 61(11) : 1454-1465
https://pubmed.ncbi.nlm.nih.gov/34115385/
2) セムブリックス適正使用ガイド 3.Q&A
腎機能障害のある患者に投与する際に、投与量の調節は必要ですか?
腎機能障害患者を対象とした海外臨床試験1)及び母集団薬物動態解析の結果より、軽度、中等度、及び重度の腎機能障害患者に対して本剤の投与量調節は必要ないと考えられました。
<腎機能障害患者を対象とした海外臨床試験(A2105試験)>
本剤40mgを空腹時に単回経口投与したとき、腎機能が正常な被験者(6例)に対する重度(体表面積未補正のeGFRが30mL/min未満で透析を必要としない)の腎機能障害患者(8例)での本剤のCmax及びAUCinfの幾何平均値の比(90%CI)はそれぞれ1.08(0.719-1.61)及び1.56(1.05-2.30)でした。
<母集団薬物動態解析>
母集団薬物動態解析に基づくシミュレーションの結果から、軽度及び中等度の腎機能障害患者では、腎機能が正常な被験者と比較して、本剤の定常状態でのAUC0-24 h(中央値)が11.5%増加すると推定されました。
X2101試験で、1回200mgを1日2回投与注)まで本剤のMTDは特定されていないことから、1回40mgを1日2回投与時の腎機能障害患者での曝露量の増加は、臨床的に意味のある変動ではないと考えられました。
注)本剤の承認された用法及び用量は「通常、成人にはアシミニブとして1回80mgを1日1回、空腹時に経口投与する。なお、患者の状態により適宜減量する。」である。
(参考)
1) Hoch M et al. : J Clin Pharmacol. 2021 ; 61(11) : 1454-1465
https://pubmed.ncbi.nlm.nih.gov/34115385/
2) セムブリックス適正使用ガイド 3.Q&A
小児CML患者へ投与できますか?
小児CML患者における安全性は確立していないため、小児CML患者への投与は適正使用の観点から推奨しておりません。1)
(参考)
セムブリックス電子添文9.7
妊娠する可能性のある女性に投与する場合、どのようなことに注意が必要ですか?
妊娠する可能性のある女性には、本剤投与中及び最終投与後3日間において避妊する必要性及び適切な避妊法について説明してください。
また、妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与することとされています1)。
〈参考データ〉
ラットを用いた受胎能及び着床までの初期胚発生に関する試験では、本剤が雌雄ラットの生殖機能に及ぼす影響は認められませんでした。一方で、ヒトの受胎能に対する影響を検討したデータはないことから本剤の消失半減期(14.2時間)を考慮し、本剤が体内から消失すると考えられるまで一定期間(少なくとも 3 日間)は適切な避妊を行うよう指導してください2)。
ラット及びウサギを用いた胚・胎児発生に関する試験では 、臨床曝露量の10.7倍(ラット)及び3.0 倍(ウサギ)に相当する用量で胚・胎児毒性(ウサギ)及び 催奇形性(ラット及びウサギ)が認められました1)2)。
(参考)
1) セムブリックス電子添文 9.4、9.5
2) セムブリックスインタビューフォーム Ⅷ-6
2.効能又は効果
BCR::ABL1遺伝子にT315I変異を持つCML患者に投与してもいいですか?
J12301/ASC4FIRST試験では、ベースライン時及び投与開始後にT315I変異が認められた患者はいませんでした。また、A2301/ASCEMBL試験ではT315I変異の既往が確認された患者は除外されていました。本剤1回80mgを1日1回での投与経験はないことから、T315I変異を持つ慢性期CML患者に対する本剤1回80mgを1日1回で投与した際の有効性及び安全性は確立していません。
(参考)
セムブリックス適正使用ガイド 3.Q&A
移行期又は急性転化期のCML患者およびALL患者に投与してもいいですか?
移行期又は急性転化期のCML患者およびALL患者に対するセムブリックスの投与は、有効性及び安全性が確立されておらず、承認されていない効能・効果に該当するため、投与は推奨できません。
なお、セムブリックスの効能又は効果は「慢性骨髄性白血病」となります。
また、効能又は効能に関連して以下の点にご注意ください。
・染色体検査又は遺伝子検査により慢性骨髄性白血病と診断された患者に使用してください。
・慢性期の慢性骨髄性白血病患者に使用してください。
・セムブリックスの電子添文「17.臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解した上で、適応患者の選択を行ってください。
(参考)
セムブリックス電子添文 4、5
3.用法及び用量
前治療薬に抵抗性又は不耐容のCMLに対して、本剤1回40 mg1日2回(BID)で投与を開始していた場合は、1回80mg1日1回(QD)での投与に切り替える必要がありますか?
電子添文に従い、本剤80mg QDでの投与へ可能な限り速やかに切り替えてください。注)
本剤40 mg BID投与から、80mg QDでの投与へ切り替える際は、40mgBIDでの最後の投与から12時間後を目安に80mg QDでの投与を開始してください。
なお、新規で本剤を開始する場合には、本剤80mg QDで投与を開始してください。1)
注)本剤は、2022年3月に「前治療薬に抵抗性又は不耐容の慢性骨髄性白血病」を効能又は効果、「1回40mgを1日2回、空腹時に経口投与する」を用法及び用量として製造販売承認を取得しましたが、以下の臨床試験結果に基づき、2025年5月に効能又は効果を「慢性骨髄性白血病」に、用法及び用量を「1回80mgを1日1回、空腹時に経口投与する」に変更する追加承認を取得しました。
・初発のCML-CP患者を対象としたJ12301/ASC4FIRST試験で80mg QD投与の有効性及び安全性を検討しました。
・前治療薬に抵抗性又は不耐容のCML-CP患者を対象としたAUS04試験の結果等で80mg QD投与は40mg BID投与と同様の有効性及び安全性を検討しました。
(参考)
1) セムブリックス適正使用ガイド 3.Q&A
用法及び用量が本剤1回80mg1日1回(QD)投与のみの設定となったのはなぜですか?
2つの国際共同第Ⅲ相試験等の結果を踏まえて、80mg QDの用法及び用量として承認されたためです。
下記、2つの国際共同第Ⅲ相試験では、慢性期の慢性骨髄性白血病(CML-CP)に対する本剤総1 日用量80mg投与の有効性及び安全性が検討されました。1)
・2 剤以上のチロシンキナーゼ阻害剤による前治療薬に抵抗性又は不耐容の CML-CP 患者を対象とした、
A2301/ASCEMBL 試験で、本剤40mg1日2回(BID)の有効性及び安全性が検討されました。注)
・初発のCML-CP患者を対象としたJ12301/ASC4FIRST試験で本剤80mg QD投与の有効性及び安全性が検討されました。
また、前治療薬に抵抗性又は不耐容のCML-CP患者を対象としたAUS04試験の結果等で80mg QD投与と40mg BID投与とで有効性及び安全性が同様であるかの検討がされました。1)
その上で、以下の点を考慮し、本剤の用法及び用量は80mg QD投与のみの設定としました。1)
・40mg BID 及び80mg QD の2 種類の用法及び用量を設定することで生じる医療現場での混乱の可能性
・CML患者において一般的に1日の服用回数が複数回の用法用量よりも1日1回の用法用量の方が治療アドヒアランスの向上が期待されること2)
注)本剤は、2022年3月に「前治療薬に抵抗性又は不耐容の慢性骨髄性白血病」を効能又は効果、「1回40mgを1日2回、空腹時に経口投与する」を用法及び用量として製造販売承認を取得しましたが、2025年5月に効能又は効果を「慢性骨髄性白血病」に、用法及び用量を「1回80mgを1日1回、空腹時に経口投与する」に変更する追加承認を取得しました。
(参考)
1) セムブリックス錠(2025年5月19日承認、審査報告書)
2) Geissler J. et al.: J Cancer Res Clin Oncol. 2017 Jul;143(7):1167-1176.
食事の影響はありますか?
食後に本剤を投与した場合、本剤の血中濃度が低下するとの報告があります。
食事の影響を避けるため、食事の1時間前から食後2時間までの間の服用は避けることとしています1)。
なお、セムブリックスの薬物動態パラメータに関する試験結果(E2101試験、A2101試験)から食事の影響の原因としては、食物摂取後に消化管内に存在する胆汁酸の影響が考えられました。
また、セムブリックスの薬物動態に及ぼす食事の影響は用量に依存しないと推定されています2)。
〈参考データ〉
健康成人(24例)に本剤40mgを空腹時、低脂肪食、及び高脂肪食摂取後に単回経口投与したとき、空腹時に対するCmax及びAUCinfの幾何平均値の比は低脂肪食摂取後では0.652及び0.700、高脂肪食摂取後では0.318及び0.377でした。(外国人データ)1)。
(参考)
1) セムブリックス電子添文7.2、16.2.1
2) セムブリックス錠(2022年3月28日承認)申請資料概要 2.7.2-3.1.2
飲み忘れた場合はどのようにすればよいですか?
決して2回分を一度に飲まないでください。気づいた時に、1回分を飲んでください。ただし、飲む予定だった時間から12時間以上経過している場合はその回は飲まずにとばして、次の決められた時間に1回分を飲んでください1)。
(参考)
1) セムブリックス患者向医薬品ガイド
前治療薬に抵抗性又は不耐容のCMLに対して、本剤1回40 mg1日2回(BID)で投与を開始していた場合は、1回80mg1日1回(QD)での投与に切り替える必要がありますか?
電子添文に従い、本剤80mg QDでの投与へ可能な限り速やかに切り替えてください。注)
本剤40 mg BID投与から、80mg QDでの投与へ切り替える際は、40mgBIDでの最後の投与から12時間後を目安に80mg QDでの投与を開始してください。
なお、新規で本剤を開始する場合には、本剤80mg QDで投与を開始してください。1)
注)本剤は、2022年3月に「前治療薬に抵抗性又は不耐容の慢性骨髄性白血病」を効能又は効果、「1回40mgを1日2回、空腹時に経口投与する」を用法及び用量として製造販売承認を取得しましたが、以下の臨床試験結果に基づき、2025年5月に効能又は効果を「慢性骨髄性白血病」に、用法及び用量を「1回80mgを1日1回、空腹時に経口投与する」に変更する追加承認を取得しました。
・初発のCML-CP患者を対象としたJ12301/ASC4FIRST試験で80mg QD投与の有効性及び安全性を検討しました。
・前治療薬に抵抗性又は不耐容のCML-CP患者を対象としたAUS04試験の結果等で80mg QD投与と40mg BID投与とで有効性及び安全性が同様であるかを検討しました。
(参考)
1) セムブリックス適正使用ガイド 3.Q&A
4.安全性
投与に際して必要な検査と関連する注意事項は何ですか?
セムブリックス投与の際に必要となる検査ならびに関連する注意事項1)2)を以下の表にまとめています。
各副作用のモニタリングのための検査を実施の上、注意事項の内容にご留意ください。
| 注意を要する副作用 | 検査と注意事項 |
|---|---|
| 骨髄抑制 | 本剤投与開始前及び投与中は定期的に(投与開始後最初の3ヵ月間は2週間毎、その後は1ヵ月毎)、また、患者の状態に応じて血液検査(血球数算定等)を実施し、患者の状態を十分に観察してください。 |
| 膵炎 | 本剤投与開始前及び投与中は定期的に(1ヵ月毎)、また、患者の状態に応じて血清リパーゼ及び血清アミラーゼを測定し、患者の状態を十分に観察してください。 |
| QT間隔延長 | ・本剤投与開始前及び投与中は、必要に応じて心電図検査及び電解質検査(カリウム、マグネシウム等)を実施し、患者の状態を十分に確認してください。 ・必要に応じて電解質(カリウム、マグネシウム等)の補正を行ってください。 |
| 感染症 | 定期的に血液検査をする等、患者の状態を十分に観察してください。 |
| B型肝炎ウイルスの再活性化 | ・本剤投与に先立って肝炎ウイルス感染の有無を確認し、本剤投与開始前に適切な処置を行ってください。 ・B型肝炎ウイルスキャリアの患者又は既往感染者(HBs抗原陰性、かつHBc抗体又はHBs抗体陽性)に本剤を投与する場合、本剤投与開始後は継続して肝機能検査や肝炎ウイルスマーカーのモニタリングを行う等、B型肝炎ウイルスの再活性化の徴候や症状の発現に注意してください。 ・B型肝炎ウイルス再活性化の検査・モニタリングについては、「B型肝炎治療ガイドライン3)」を参照し、必要に応じて肝臓専門医に相談してください。 |
(参考)
1) セムブリックス電子添文 8、9
2) セムブリックス適正使用ガイド 1.2.2 投与に際しての検査と注意事項
3) 日本肝臓学会 肝炎診療ガイドライン作成委員会 編:B型肝炎治療ガイドライン第4版(2022年6月), p87-90 注)引用しているガイドライン等に関しては、最新の情報をご確認ください。
5.製剤
貯法について教えてください
セムブリックスの貯法は「25℃以下」です。貯法を逸脱した製品の使用は避けてください。
なお、冷所保存等の規制はないため、冷蔵庫での保存は必須ではありませんが、25℃以下での保存を維持するために、必要に応じて冷蔵庫や保冷剤等の使用を検討ください。
(参考)
セムブリックス電子添文
20mg製剤2錠と40mg製剤1錠は生物学的に同等ですか?
20mg製剤2錠と40mg製剤1錠で生物学的同等性が確認されています。
なお、試験の詳細なデータは公表していませんが、審査報告書1)に関連する記載があります。
(参考)
セムブリックス錠(2022年3月28日承認、審査報告書、p.23 6.1)
https://www.pmda.go.jp/drugs/2022/P20220330001/300242000_30400AMX00189_A100_1.pdf
粉砕して投与してもいいですか?
抗悪性腫瘍剤という観点からもセムブリックスを粉砕して服用した場合について検討したデータはございません。
セムブリックスを粉砕して投与することは、承認外の用法となります。粉砕投与した際の有効性、安全性、薬物動態は確立していませんので、弊社からは推奨していません。
一包化してもいいですか?
セムブリックスと他剤と一包化して安定性を検討したデータはありません。
参考までに、セムブリックス錠20mg、40mgの無包装における安定性試験の結果は以下の通りです。
25℃/60%RHの保存条件において3か月間、試験項目(性状、類縁物質、溶出性、水分、含量)は規格内の結果でした。
(参考)
社内資料:セムブリックス錠20mg及び40mg 無包装における安定性
簡易懸濁法による投与をしてもいいですか?
セムブリックスを懸濁して服用した場合、もしくは経管投与した場合について検討したデータはございません。
セムブリックスを懸濁して投与することは、承認外の用法となります。懸濁投与した際の有効性、安全性、薬物動態は確立していませんので、弊社からは推奨していません。
6.その他
日本人と外国人で薬物動態に差はありますか?
日本人を含む異なる患者群を対象とした2つの国際共同第Ⅲ相試験(A2301/ASCEMBL 試験およびJ12301/ASC4FIRST 試験)における薬物動態パラメータ及び母集団薬物動態解析の結果から、セムブリックスの薬物動態に明らかな民族差は生じないと考えられています。
【参考データ】
対象:前治療薬に抵抗性又は不耐容の慢性期CML
〈国際共同第Ⅲ相試験(A2301/ASCEMBL 試験)〉
ノンコンパートメント法で算出したセムブリックスの反復投与後(Week 2のDay 1)の薬物動態パラメータを日本人と非日本人で比較したところ、日本人のAUC0-12h及びCmaxの幾何平均値(幾何CV%)は、それぞれ6,450ng·h/mL(22.8%)及び1,210ng/mL(18.8%)、非日本人ではそれぞれ5,370ng·h/mL(39.4%)及び804ng/mL(51.6%)であり、日本人でやや高い傾向がみられました。しかしながら、いずれの薬物動態パラメータも個別値は非日本人の変動の範囲内であることから、日本人と非日本人の薬物動態に明らかな違いはないと考えられました。
また、母集団薬物動態解析の結果においても、人種(アジア人、非アジア人)及び民族(日本人、非日本人)はセムブリックスの薬物動態に対する共変量ではなかったこと、ならびにセムブリックスの代謝には主にCYP3A4、UGT2B7およびUGT2B17が関与し、全身クリアランスに複数の経路が寄与していることから、セムブリックスの薬物動態に明らかな民族差は生じないと考えられました。
対象:初発の慢性期CML
〈国際共同第Ⅲ相試験(J12301/ASC4FIRST 試験)〉
セムブリックスの80 mgを空腹時に1日1回反復投与後(Week 2の Day 1)薬物動態パラメータを日本人と非日本人で比較したところ、日本人のAUClast及びCmaxの幾何平均値(幾何CV%)は、それぞれ9,670ng·h/mL(7.7%)及び1,680ng/mL(15.8%)、非日本人ではそれぞれ8,300ng·h/mL(48.1%)及び1,410ng/mL(42.4%)でした。日本人のAUClast 及びCmaxはいずれも非日本人の値の範囲内であり、初発のCML患者におけるセムブリックスの薬物動態に明らかな民族差は認められませんでした。2)
また、母集団薬物動態解析の結果においても、民族の違いによる明らかな差は認められませんでした。3)
(参考)
1) ノバルティスファーマ社内資料 日本人と非日本人の比較(A2301試験)
2) セムブリックス錠(2025年5月19日承認、審査報告書)
3) ノバルティスファーマ社内資料:母集団動態解析
血液脳関門を通過しますか?
セムブリックスの血液脳関門の通過性について、ヒトにおいて検討したデータはなく、血液脳関門の通過性については不明です。
なお、動物実験(ラット)において14C標識アシミニブを経口投与したときの脳内移行性を検討した試験において、アシミニブの脳への移行はほとんど認められませんでした。
(参考)
セムブリックスインタビューフォーム Ⅶ-5 (1)
投与中に手術を行う際に休薬は必要ですか?
セムブリックスの手術に対する影響について検討されておらず、手術前後でのセムブリックス投与方法は確立されていないため、手術前後における休薬の必要性及び休薬期間については不明です。
休薬を検討する際は、投与168~216時間後までに80% が糞中に、11% が尿中に排泄されたデータ1)を参考に、セムブリックスによる副作用や患者の状態に応じて休薬の要否又は期間を検討することが必要であると考えられます。
なお、セムブリックスが創傷治癒遅延を引き起こすかどうかは明らかになっていません。
(参考)
セムブリックスインタビューフォーム Ⅶ-7
投与後に新たに検出されたBCR::ABL1遺伝子変異はありますか?
初発のCML患者を対象としたJ12301/ASC4FIRST試験、前治療薬に抵抗性又は不耐容のCML患者を対象としたA2301/ASCEMBL試験及びX2101試験で、本剤投与中に新たに検出(ベースラインの変異有無を問わない)されたBCR::ABL1遺伝子変異としては以下が報告されました。なお、新たな遺伝子変異が認められた患者全例でMMRは得られず、本剤の投与が中止されています。
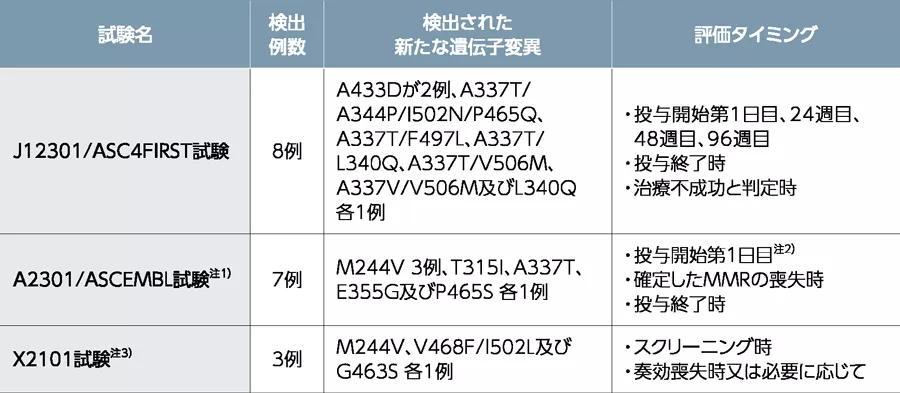
注1)T315I又はV299L変異の既往が確認された患者は除外基準とし、投与開始第1日目及びその後のBCR-ABL1遺伝子検査でT315I又はV299L変異が検出された場合は、投与を中止することとしました。
注2)投与開始第1日目に遺伝子変異が検出された場合は、投与終了時まで12週毎に遺伝子変異が評価されました。
注3)遺伝子変異が検出された場合は、遺伝子変異が検出されなくなるまで3サイクル(1サイクル28日間)毎又は治験担当医師の判断に応じて評価されました。
(参考)
セムブリックス適正使用ガイド 3.Q&A
