パンくず

記載されている薬剤の使用にあたっては、電子添文をご参照ください。
オファツムマブの開発背景とASCLEPIOS試験(海外データ)
オファツムマブは、日本では2021年に「再発寛解型多発性硬化症(MS)と疾患活動性を有する二次性進行型MSの再発予防及び身体的障害の進行抑制」を効能又は効果として発売された。オファツムマブは、通常、成人には1回20mgを初回、1週後、2週後、4週後に皮下注射し、以降は4週間隔で皮下注射する。
海外第Ⅲ相検証試験ASCLEPIOSⅠ試験(G2301試験)1)・ASCLEPIOSⅡ試験(G2302試験)2)※1では、再発を伴うMS患者1,882例を対象にオファツムマブのteriflunomide(本邦未承認)に対する優越性を検証した。日本はteriflunomide未承認のため不参加であった。主要評価項目(検証的解析項目)である1年あたりの確定再発数(ARR)の推定値は、ASCLEPIOSⅠ試験ではteriflunomide群の0.22に対し、オファツムマブ群では0.11、ASCLEPIOSⅡ試験ではteriflunomide群の0.25に対し、オファツムマブ群では0.10と、両試験ともに2群間で有意差が認められた(いずれもp<0.001、負の二項回帰モデル)。年間再発率の低下率はそれぞれ50.5%および58.5%であり(検証的解析結果)、オファツムマブ群のteriflunomide群に対する優越性が検証された。また、両試験のメタ解析では、主要な副次評価項目である総合障害度スケール(EDSS)に基づく6ヵ月持続する障害増悪(6mCDW)が認められるまでの期間(検証的解析項目)においても、オファツムマブ群のほうがteriflunomide群と比べて長く、6mCDW発現のハザード比は0.675(95%信頼区間:0.498-0.916)と、6mCDWの発現リスクが32.5%有意に減少しており(検証的解析結果、p=0.012、層別Cox比例ハザードモデル)、teriflunomide群に対するオファツムマブ群の優越性が検証された。
なお、投与時の注目すべき有害事象として、注射に伴う全身反応があり、オファツムマブ群はその発現率が20.2%であった。有効性は限定的とされるものの、注射に伴う全身反応の予防にはアセトアミノフェンと抗ヒスタミン剤(初回のみメチルプレドニゾロン追加)の前投薬がある3)※1。MSでは体温上昇に伴い一時的に神経症状が悪化するウートフ徴候が認められるため、本徴候が懸念される場合は前投薬が望ましいであろう。
※1 ASCLEPIOSⅠ/Ⅱ試験の試験概要および安全性はこちらを参照ください。
国際共同第Ⅱ相試験APOLITOS試験の国内成績
国内では、ブリッジング試験として2022年に小規模の国際共同第Ⅱ相試験APOLITOS試験(G1301試験)4)が実施され、本試験の成績に基づき国内での承認を取得した。対象は日本およびロシアの再発を伴うMS患者64例(日本人32例)である(図1)。本試験の結果、主要評価項目(検証的解析項目)である投与12~24週後の1スキャンあたりのガドリニウム(Gd)造影T1病変数は、オファツムマブ群でプラセボ群に比べて93.6%減少し、プラセボ群に対する優越性が検証された[検証的解析結果。当該病変数の相対的な減少率を「1-当該病変数の比」で算出し、割合(%)として表記]。また、プラセボ群を投与24週後にオファツムマブに切り替えた結果、副次評価項目である年間再発率(ARR)は投与24週後までは0.684、投与24~48週後では0.083と、ASCLEPIOSⅠ/Ⅱ試験の0.10~0.111,2)と同程度の成績が得られた。投与24週時における有害事象発現率はオファツムマブ群69.8%(30/43例)、プラセボ群81.0%(17/21例)であり、安全性においてもASCLEPIOSⅠ/Ⅱ試験と同様の有害事象プロファイルであった4)。
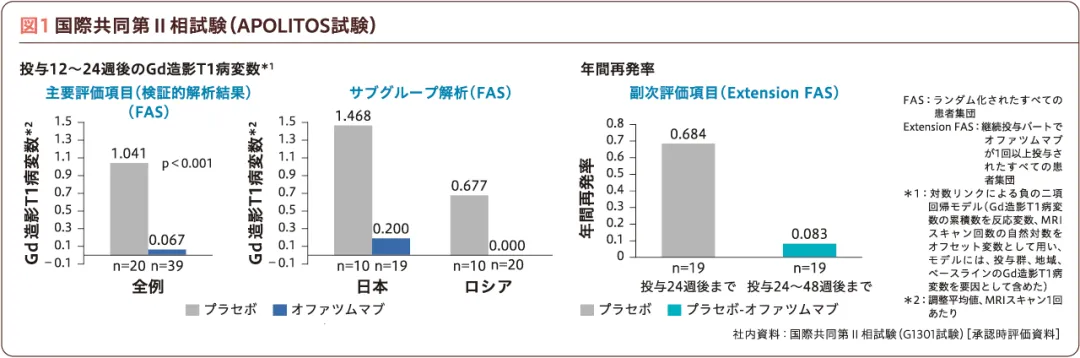
国際共同第Ⅱ相試験(APOLITOS試験)の詳細についてはこちらをご覧ください。
オファツムマブの長期継続試験
現在、ASCLEPIOSⅠ/Ⅱ試験、海外第Ⅱ相生物学的同等性試験APLIOS試験(G2102試験)、およびAPOLITOS試験の各試験を終了した患者(日本人を含む。有効性解析対象集団:1,882例、安全性解析対象集団:1,969例)を対象とした海外第Ⅲb相試験ALITHIOS試験において、オファツムマブの長期投与試験が継続されている5)。5年時の報告では、ARR(有効性評価項目)はオファツムマブで治療開始した群(オファツムマブ継続群)で0.056(コアパートより47.4%低下)、teriflunomide投与後にオファツムマブに切り替えた群(オファツムマブ切替群)で0.063(同72.6%低下)であった(図2)。また、オファツムマブ継続群および切替群における1スキャンあたりのGd造影T1病変数(有効性評価項目)は平均0.009および0.024、NEDA(no evidence of disease activity:疾患活動性が認められない状態)-3達成率(有効性評価項目)は93.4%および90.9%であった。また、5年時の年間脳容積変化率(有効性評価項目)はオファツムマブ継続群で-1.42%、オファツムマブ切替群で-1.66%で有意差が認められた(p=0.002、多重性調整なし、ランダム係数モデル)5)。以上の結果は、オファツムマブによる早期治療開始の有効性を支持するものと考えられる。
安全性の評価では、5年間を通じて新たな有害事象は報告されずIgG濃度は98%が正常域内を維持していた。IgM濃度は低下傾向を示し、正常域内を維持したのは69.4%であった。Ig濃度の低下と重篤な感染症との関連性は示されなかった5)。
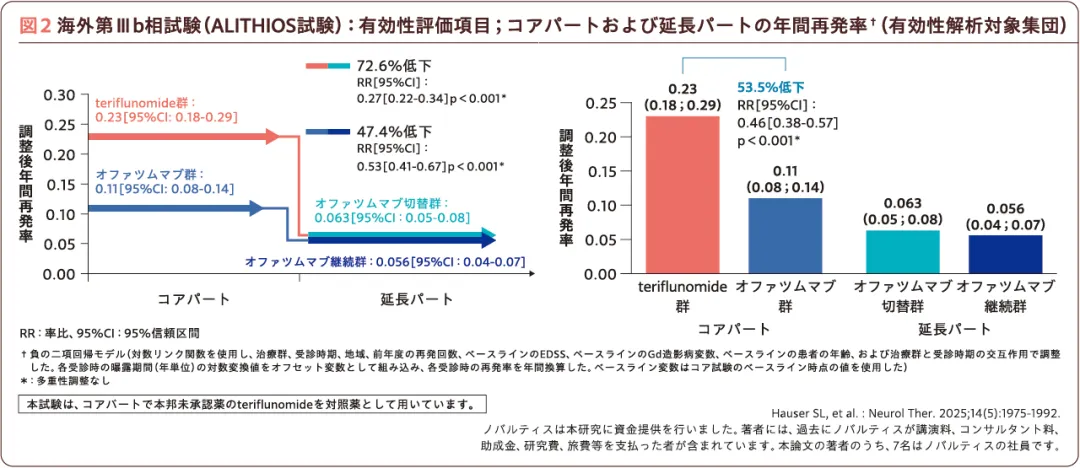
海外第Ⅲb相試験(ALITHIOS試験)の詳細についてはこちらをご覧ください。
MSの治療戦略の変化と今後の展望
近年では、長期間の有効性および安全性データの蓄積により、初期からhigh efficacy therapyを導入する治療戦略(eHET)が世界的に普及している。EUでのオファツムマブ承認は2021年であり、フィンランドでは2022年時点で患者の43.7%がeHETを選択されている6)。ドイツにおいてもeHETが漸増しており、なかでも2022年にはhigh efficacy therapyの中でオファツムマブが占める割合は49.7%に達していた7)。長期の検証により、MSを安定状態に長期間維持可能な治療法の確立が期待できることから、現在進行しているオファツムマブの長期継続試験の結果が待たれる。
参考文献
1) 社内資料:海外第Ⅲ相試験(G2301試験)[承認時評価資料]
2) 社内資料:海外第Ⅲ相試験(G2302試験)[承認時評価資料]
3) 米国食品医薬品局〔U.S. Food and Drug Administration〕Drugs@FDA:KESIMPTA / ARZERRA(ofatumumab)(2025年10月10日閲覧)
4) 社内資料:国際共同第Ⅱ相試験(G1301試験)[承認時評価資料]
5) Hauser SL, et al.: Neurol Ther. 2025;14(5):1975-1992.ノバルティスは本研究に資金提供を行いました。著者には、過去にノバルティスが講演料、コンサルタント料、助成金、研究費、旅費等を支払った者が含まれています。本論文の著者のうち、7名はノバルティスの社員です。
6) Ahvenjärvi H, et al.: Brain Behav. 2025;15(2):e70326.
7) Papukchieva S, et al.: Ther Adv Neurol Disord. 2024;17:17562864241237857.
ご所属、ご講演内容については2025年7月作成時点のものです
