パンくず
ケシンプタ FAQ
製品FAQは医療に従事する先生方からよくご質問いただく内容をまとめたものです。記載している情報はあくまで参考情報としてお取り扱いいただき、医療上のご判断は医療従事者の裁量と責任のもとに行っていただきますようお願い致します。
製品のご使用にあたっては、最新の電子化された添付文書(電子添文)をご確認ください。製品に関してご不明な点がございましたら、弊社お問い合わせ窓口にお問い合わせください。
1.特定の背景を有する患者
ケシンプタは肝機能障害のある患者に使用してもいいですか?
電子添文では、肝機能障害患者への投与に関して規定はございません。
ただし、B型肝炎ウイルスキャリアの患者への注意喚起をしていますのでご注意ください。
ケシンプタ電子添文
1.1 慢性リンパ性白血病の治療のためにオファツムマブを点滴静注したB型肝炎ウイルスキャリアの患者において、B型肝炎ウイルスの再活性化により肝不全に至り死亡した例が報告されている。
8.1 B型肝炎ウイルスの再活性化による肝炎があらわれるおそれがあるので、本剤投与に先立ってB型肝炎ウイルス感染の有無を確認すること。
9.1.1 活動性B型肝炎患者、B型肝炎ウイルスキャリアの患者又は既往感染者(HBs抗原陰性、かつHBc抗体又はHBs抗体陽性)
活動性B型肝炎患者では、肝炎の治療を優先すること。本剤の治療期間中及び治療終了後は、継続して肝機能検査値や肝炎ウイルスマーカーのモニタリングを行うなど、B型肝炎ウイルスの再活性化の徴候や症状の発現に注意すること。B型肝炎ウイルスキャリアの患者又は既往感染者(HBs抗原陰性、かつHBc抗体又はHBs抗体陽性)ではB型肝炎ウイルスの再活性化により肝炎があらわれるおそれがある。
ケシンプタを高齢者に投与してもいいですか?
電子添文上、高齢者への投与に関して規定はございません。
ケシンプタは妊婦に投与してもいいですか?
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与してください。
妊娠可能な女性に対しては、ケシンプタ投与中及び最終投与後6ヵ月間は適切な避妊法を用いるよう指導してください1)。
なお、海外第III相検証試験中の妊娠は4件でした(うち1件は男性被験者のパートナーの妊娠)2)。
サルを用いた動物実験では、胎児・乳児で末梢血B細胞数の枯渇および脾臓重量の減少、乳児でキーホールリンペットヘモシアニン(KLH)に対する液性免疫応答の低下が報告されました。
また、臨床曝露量が160倍(AUCを指標)の母動物(サル)の乳児において、免疫調節による感染症を起因とした早期死亡が報告されました1), 2)。
(参考)
1) ケシンプタ電子添文 9.4、9.5
2) ケシンプタ適正使用ガイド 4. ケシンプタ投与中における注意事項
ケシンプタを授乳婦に投与してもいいですか?
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討してください。本剤の母乳中への移行は不明ですが、ヒトIgGは母乳中に移行することが知られています1)。
(参考)
1) ケシンプタ電子添文 9.6
ケシンプタを小児に投与してもいいですか?
小児を対象とした臨床試験は実施しておらず、有効性・安全性は確認されていません1)。
(参考)
1) ケシンプタ電子添文 9.7
2.用法及び用量
ケシンプタ導入時の投与スケジュールを教えてください
ケシンプタは、まずは初回・1週後・2週後・4週後に投与します。
それ以降は維持期として4週間毎に投与します1)。
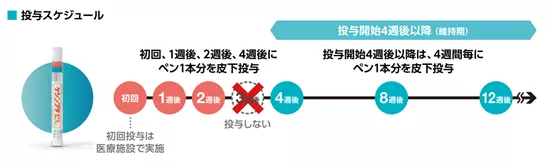
ケシンプタ電子添文
6. 用法及び用量
通常、成人にはオファツムマブ(遺伝子組換え)として1回20mgを初回、1週後、2週後、4週後に皮下注射し、 以降は4週間隔で皮下注射する。
(参考)
1) ケシンプタ適正使用ガイド 2. ケシンプタの投与を開始する前に
ケシンプタを投与し忘れてしまった場合の対処方法を教えてください
投与予定日に投与できなかった場合は、できるだけ速やかに投与してください。その後は、用法及び用量に規定された投与間隔を空けて次の投与をしてください1), 2)。
(参考)
1) ケシンプタ電子添文 7.1
2) ケシンプタくすりのしおり
ケシンプタは在宅自己投与してもいいですか?
在宅自己投与が可能です。
ただし、投与開始時は医療施設で、必ず医師によるか医師の直接の監督のもとで投与してください。
自己投与の適用については、医師がその妥当性を慎重に検討し、十分な教育訓練を実施した後、本剤投与による危険性と対処法について患者又はその介護者が理解し、確実に投与できることを確認した上で、医師の管理指導の下で実施してください。
また、患者又はその介護者による自己投与ができなくなった場合は自己投与を中止させてください。
副作用の発現が疑われる場合には、自己投与を中止し、医療機関へ連絡するよう患者さんにご指導ください。
(参考)
ケシンプタ電子添文 8.5
手術前後でケシンプタを休薬する必要はありますか?
電子添文では、手術前後の休薬の必要性に関して規定はございません。
ただし、ケシンプタ投与によりB細胞数が低下し、免疫グロブリン濃度の低下、並びに白血球、好中球、及びリンパ球の減少があらわれ、これに伴い感染症が生じる又は悪化するおそれがありますので、ご注意ください1)。
(参考)
1) ケシンプタ電子添文 8.3
3.安全性
ケシンプタの初回投与時に特に注意すべきことはありますか?
ケシンプタの投与開始は、医療施設において、医療従事者の指導のもとで行ってください1)。
また、特に初回投与後24時間は注射に伴う反応の発現に注意するよう患者に指導ください。注射に伴う反応は主に初回投与後24時間以内に発現します。主な症状は、発熱、頭痛、筋肉痛、悪寒及び疲労などです。
初回投与時には、注射に伴う全身反応を軽減させるために、必要に応じてステロイド等(非ステロイドとの併用も含む)※の 前投与を考慮してください。
なお、海外第III相検証試験では、注射に伴う全身反応の軽減のため、前投与として非ステロイド〔アセトアミノフェンおよび/または抗ヒスタミン剤(または同等の薬剤)〕の経口投与※)が推奨されていたほか、初回投与時のみ、前投与としてステロイド〔メチルプレドニゾロン100 mg(または同等の薬剤)〕の静脈内投与※)も推奨されていました。2)
※「注射に伴う全身反応の軽減」に対しては本邦未承認
(参考)
1) ケシンプタ電子添文 8.4、8.5
2) ケシンプタ適正使用ガイド 2. ケシンプタの投与を開始する前に
ケシンプタ投与後の注射に伴う全身反応の発現状況を教えてください
注射に伴う全身反応※(発熱、頭痛、筋肉痛、悪寒、疲労など)の発現率は20.6%でした1)。
臨床試験では、多くは「初回投与時」に認められていますが、2回目以降の投与時にも認められています2)。
国際共同第II相試験/海外第III相試験(APOLITOS試験・ASCLEPIOS I試験・ASCLEPIOS II試験)の延長試験の4年までのデータにおいて、全体の安全性集団にて24.7%(487/1969例)の患者に注射に伴う全身反応が発現しました3)。
※「注射に伴う全身反応」とは、皮下投与後24時間以内に発現した反応または症状のこと
(参考)
1) ケシンプタ電子添文 11.1
2) ケシンプタ適正使用ガイド 4. ケシンプタ投与中における注意事項
3) Hauser SL:Multiple sclerosis 29(11-12) Page:1452-1464
ケシンプタをB型肝炎ウイルスキャリアまたは既往感染患者へ投与する場合に注意することはありますか?
活動性B型肝炎患者、B型肝炎ウイルスキャリアの患者/既往感染者(HBs抗原陰性、かつHBc抗体またはHBs抗体陽性)では、ケシンプタ投与中および投与終了後は継続して肝機能検査値や肝炎ウイルスマーカーのモニタリングを行うなど、B型肝炎ウイルスの再活性化の徴候や症状の発現に注意してください。
また、活動性B型肝炎患者では、肝炎の治療を優先してください1)。
ケシンプタの投与により、B細胞数の減少や免疫グロブリン濃度の低下などがみられ、投与中および投与中止後は感染症が生じるまたは悪化するおそれがあることから注意喚起しています。
さらに、慢性リンパ性白血病の治療のためにオファツムマブ点滴静注製剤を投与したB型肝炎ウイルスキャリアの患者において、B型肝炎ウイルスの再活性化により、肝不全に至り死亡した報告があることから、電子添文の【警告】で注意喚起しています1)。
(参考)
1) ケシンプタ電子添文 1.1、8.1、9.1.1
ケシンプタ投与中に必要な検査はありますか?
ケシンプタ治療期間中及び治療終了後は定期的に血液検査を行うなど、患者さんの状態に十分ご注意ください1)。
ケシンプタ投与により免疫グロブリン濃度の低下、並びに白血球、好中球及びリンパ球の減少があらわれ、これに伴い感染症が生じる又は悪化するおそれがあることから、注意喚起しております。
具体的な検査の間隔について電子添文では規定はございません。患者さんの状態に応じて医師のご判断でお願いいたします。
(参考)
1) ケシンプタ電子添文 8.2
ケシンプタ投与後の免疫グロブリン濃度低下の発現状況を教えてください
免疫グロブリンM(IgM)1), 2)
● 海外第III相試験併合データ(ASCLEPIOS I試験・ASCLEPIOS II試験)では、基準値下限(0.23 g/L)より10%低値(休薬基準)に該当した患者の割合は14.3%(135/944例)でした。
● 投与96週後までケシンプタ投与を完了した被験者における、投与96週後のIgM濃度(平均値)のベースラインからの変化量は、−0.537 g/L(38.8%減少)でした。
免疫グロブリンG(IgG)1), 2)
● 海外第III相試験併合データ(ASCLEPIOS I試験・ASCLEPIOS II試験)では、基準値下限(5.49 g/L)より20%低値(休薬基準)に該当した患者の割合は1.3%(12/944例)でした。
● 投与96週後までケシンプタ投与を完了した被験者における、投与96週後のIgG濃度(平均値)のベースラインからの変化量は、0.224 g/L(2.2%増加)でした。
(参考)
1) ケシンプタ申請資料概要 2.7.4 臨床的安全性 3.3
2) ケシンプタ適正使用ガイド 4. ケシンプタ投与中における注意事項
ケシンプタ投与中に血清免疫グロブリン濃度が低下した場合の対応を教えてください
血清免疫グロブリン濃度が減少することで、感染症が発現または悪化するおそれがあります。感染症があらわれた際には投与を中止するなど適切な処置を行ってください1)。
なお、海外第III相試験(ASCLEPIOS I試験・ASCLEPIOS II試験)では、試験中に「免疫グロブリンM濃度が基準値下限(0.23 g/L)より10%低値」または「免疫グロブリンG濃度が基準値下限(5.49 g/L)より20%低値」に該当した場合を休薬基準としていました2)。
(参考)
1) ケシンプタ電子添文 8.2
2) ケシンプタ適正使用ガイド 4. ケシンプタ投与中における注意事項
ケシンプタ投与中に生ワクチン(弱毒生ワクチン含む)の接種をしてもいいですか?
ケシンプタ投与中の生ワクチンや弱毒生ワクチンの接種は、併用注意として注意喚起しています。
ケシンプタ投与中に接種することで、生ワクチン又は弱毒生ワクチンによる感染症発現のリスクが増大するおそれがあるためです。
生ワクチン又は弱毒生ワクチンは本剤投与開始の少なくとも4週間前までに接種してください。
ケシンプタ投与中及び投与中止後にB細胞数が回復してから生ワクチン又は弱毒生ワクチンを接種することをご検討ください1)。
(参考)
1) ケシンプタ電子添文 10.2
ケシンプタ投与中に不活化ワクチンの接種をしてもいいですか?
ケシンプタ投与中の不活化ワクチン接種は、併用注意として注意喚起しています。
ケシンプタ投与中は、ワクチンの効果を減弱させる恐れがあります。そのため、不活化ワクチンは本剤投与開始の少なくとも2週間前までに接種してください1)。
(参考)
1) ケシンプタ電子添文 10.2
前治療薬からケシンプタに変更する際のウォッシュアウト期間は?
電子添文において、前治療薬のウォッシュアウト期間に関して具体的な規定はございません。
ただし、併用注意では、切り替え時に相加的な免疫抑制作用が生じる可能性をを注意喚起しています。前治療薬の作用持続時間及び作用機序を考慮して、ウォッシュアウト期間を設定してください1) 。
(参考)
1) ケシンプタ電子添文 10.2
ケシンプタ投与中止後のB細胞数の推移を教えてください
ケシンプタ投与中止後36週目にB細胞数がベースラインまたは基準値下限(40cells/μL)まで回復した被験者の割合は、以下の通りでした1)。
● 海外第III相試験(ASCLEPIOS I試験)において55.6%(15/27例)
● 海外第III相試験(ASCLEPIOS II試験)において70.3%(26/37例)
ケシンプタ適正使用ガイドの《投与中止後のB細胞数に及ぼす影響》も併せてご参照ください2)。
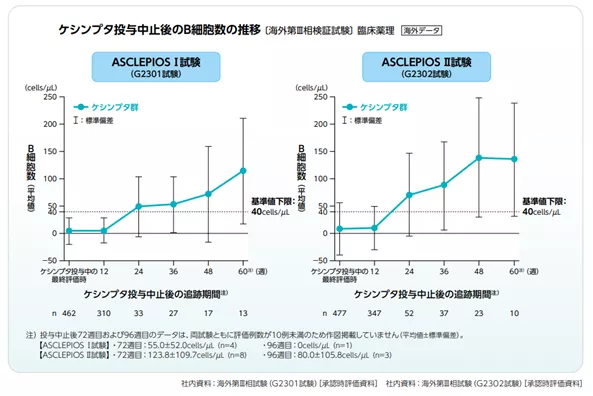
(参考)
1) ケシンプタ電子添文 16.8.1
2) ケシンプタ適正使用ガイド 4. ケシンプタ投与中における注意事項
4.製剤
ケシンプタを箱のまま保存する理由を教えてください
遮光保存が必要なためです。ですので、外箱に入れたまま交付してください。
患者さんには、外箱に入れた状態で冷蔵庫内で保存するよう指導してください。
(参考)
ケシンプタ電子添文 20
ケシンプタを室温で保管してしまいましたが使用してもいいですか?
ケシンプタの貯法は、2~8℃です。貯法を逸脱した製品の使用は避けてください。
ケシンプタは投与を行う時まで、箱に入れたまま冷蔵庫(2~8℃)で保存してください1)。
あわせて、電子添文やインタビューフォームの記載をご確認ください。
電子添文 14.3.1
患者が家庭で保存する場合は、本剤は外箱に入れた状態で、冷蔵庫内で保存すること。
やむを得ず室温(30℃以下)で保存する場合は、7日間保存可能であるが、この期間内に使用しなかった場合は、冷蔵庫に戻し7日以内に使用すること。
インタビューフォーム IV-6. 製剤の各種条件下における安定性2)
25℃/60%RHで3ヵ月保存時まで、試験項目はいずれも規格内であった。一方、6ヵ月保存時には、本剤の純度試験が規格外であった。
(参考)
1) ケシンプタ電子添文 14.3.1
2) ケシンプタインタビューフォーム IV-6.
ケシンプタを誤って凍結させてしまいましたが使用してもいいですか?
ケシンプタの貯法は、2~8℃です。貯法を逸脱した製品の使用は避けてください。
凍結を避けるため、冷凍庫での保存やチルド室、野菜室、冷気の吹き出し口付近に置かないようにしてください1) 。
(参考)
1) ケシンプタ適正使用ガイド 3. ケシンプタの「自己投与」の教育指導、適用可否の判断
ケシンプタを持ち運ぶ際に注意することはありますか?
ケシンプタの貯法が2~8℃であることから、持ち運ぶ際には、保冷剤入りのバッグに入れて持ち運んでください。
弊社ではケシンプタペン専用の保冷バッグと保冷剤を提供しています。専用廃棄バッグの請求は弊社カスタマーサポートデスクまでご連絡ください。
ノバルティスファーマ カスタマーサポートデスク
電話番号: 0120-965-101 (通話料無料)
受付時間: 月~金 9:00~17:30 (祝日及び弊社休日を除く)
電話がご利用いただけない場合は、資材請求等の専用 お問い合わせフォームをご利用ください。
ケシンプタはラテックスを使用していますか?
ケシンプタはラテックス(天然ゴム)やラテックス類縁物質(乾燥天然ゴム)を使用していません。
ケシンプタの針キャップはスチレンブタジエンゴムを使用しています1)。
(参考)
1) ケシンプタインタビューフォーム IV-10.(4)
ケシンプタを在宅自己投与した後の廃棄方法を教えてください
使用済みのケシンプタは専用廃棄バッグに入れ、各医療施設のルールに従い、医療廃棄物として適切に廃棄してください1)。
使用済み注射器入れとして専用廃棄バッグを弊社より提供しています。廃棄バッグがない場合はビンや缶などの硬い容器などで代用してください。
専用廃棄バッグの請求は弊社カスタマーサポートデスクまでご連絡ください。
ノバルティス ファーマ カスタマーサポートデスク
電話番号 0120-965-101(通話料無料)
受付時間 月〜金 9:00〜17:30(祝日及び当社休日を除く)
電話がご利用いただけない場合は、資材請求等の専用 お問い合わせフォームをご利用ください。
(参考)
1) ケシンプタ適正使用ガイド 3. ケシンプタの「自己投与」の教育指導、適用可否の判断
