パンくず

記載されている薬剤の使用にあたっては、電子添文をご参照ください。 |
SPMSへの移行を防止するためには、EDSS 2.0以下に留めることが重要
2020年に関西多発性硬化症センターを受診した、MS患者953例を対象とした解析から得られた知見を紹介する。まず、全患者のうち94%が再発寛解型MS(RRMS)として発症した。
RRMSは再発と寛解を繰り返すMSだが、徐々に障害が進行し二次性進行型MS(SPMS)へ移行する。初期にRRMSと診断された患者のうち、21%がSPMSへ移行していた。SPMS移行時のEDSSの中央値は3.0(範囲:2.0~6.0)であった。EDSSが3.0に到達したときのSPMS移行リスクは0.52であり、EDSS 3.0に達した患者の半数以上が進行型MSに移行する。
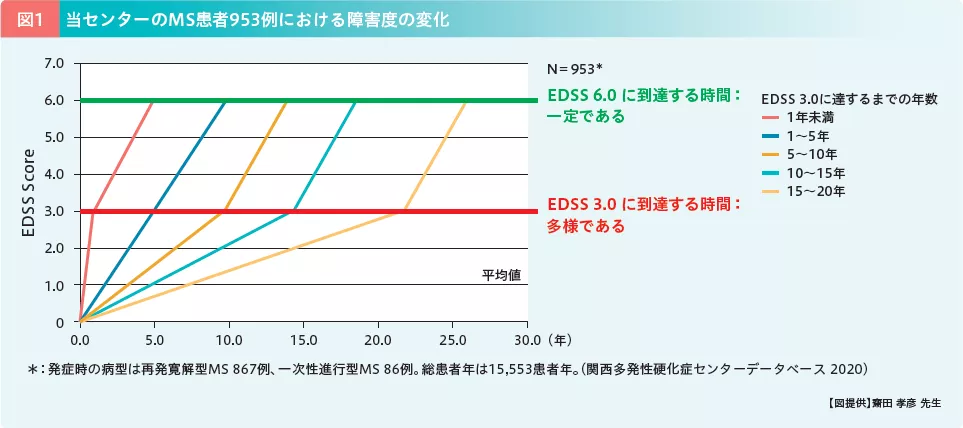
また、EDSS 3.0に到達するまでの年数によって、患者を5群(1年未満、1~5年、5~10年、10~15年、15~20年)に分けて、EDSS 3.0から6.0に達するまでに要した年数を計算し比較したところ、EDSS 3.0に到達するまでの障害進行速度はさまざまであった一方で、EDSS 3.0に達すると、以降の障害進行速度の平均値は一律であることが確認された(図1)。これらの結果から、我々はEDSS 2.0以下の段階で病勢をコントロールし、障害の蓄積を抑えることが、SPMSへの移行を防止するために重要であると結論づけた。
安全性と有効性を考慮したDMDの選択を
MSの疾患活動性を評価する概念としてNEDA(no evidence of disease activity:疾患活動性が認められない状態)が提唱されており、①臨床的再発がない、②障害進行がない、③MRI活動性がない、の3条件を満たすNEDA-3を達成することがMS治療の主要な目標とされている。
現行の有効性の高いMS治療を早期に開始することで、NEDA-3達成が高率に可能であるが、近年ではこれに④脳萎縮の進行がない(NEDA-4)1)、⑤ニューロフィラメント軽鎖(NfL)が正常値である(NEDA-5)2)を加えた、より高度な疾患活動性の制御を目指すことが提唱されている。しかし、日常的応用は容易でない。
日本で使用可能なMSに対する疾患修飾薬(DMD)は8種類あり、RRMSに使用できるのは7種類である。DMDを選択する上で重視すべき要素の第一が安全性である。MS治療において、最も深刻な副作用は進行性多巣性白質脳症(PML)である。
有効性を考慮した治療選択も重要である。Samjooらは、RRMSに対する疾患修飾療法(DMT)の相対的な有効性について、ネットワークメタ解析を用いて包括的に検討した3)。年間再発率(ARR)を検討し、その結果、抗CD20抗体製剤が再発の抑制に有効であることが示された。このようなDMDの有効性に関する情報を収集し、早期から有効性の高いDMDを用いることで障害進行の抑制が期待できる。
当センターでは、疾患活動性に応じて安全性と有効性を考慮したDMDの選択を行っている。2018年以降、現時点(2025年5月)までに急性再発や増悪により入院を要した症例や、重大な副作用が認められた症例、PML発症を認めていないが、今後も引き続き注意が必要である。
オファツムマブの薬理特性とASCLEPIOS試験の検証
近年、MS治療においてB細胞除去療法が寛解維持に有効であることが示されている4)。完全ヒト型抗CD20モノクローナル抗体であるオファツムマブは、プレB細胞から形質芽細胞に至るまでのB細胞表面に発現するCD20抗原に特異的に結合し、補体依存性細胞傷害(CDC)活性および抗体依存性細胞傷害(ADCC)活性を介して、CD20陽性B細胞およびCD20陽性T細胞の溶解を誘導する5)。リツキシマブは抗ヒトCD20ヒト・マウスキメラ型モノクローナル抗体であり、B細胞除去作用を有するが、MSに対して本邦では適応外である。オファツムマブとはエピトープや親和性が異なりCDC活性も異なる6)。
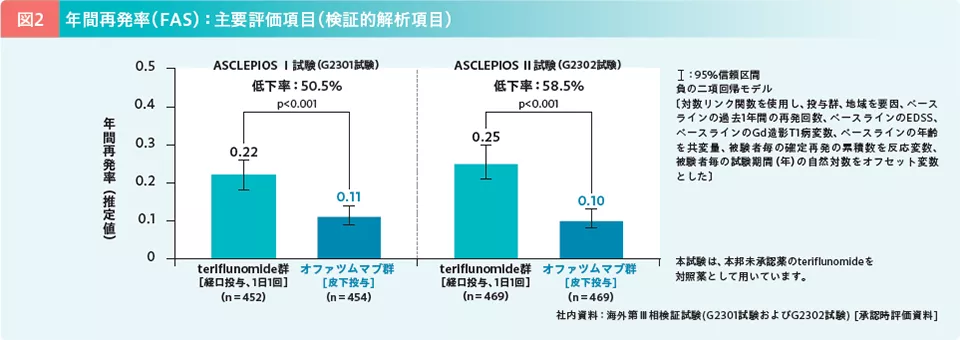
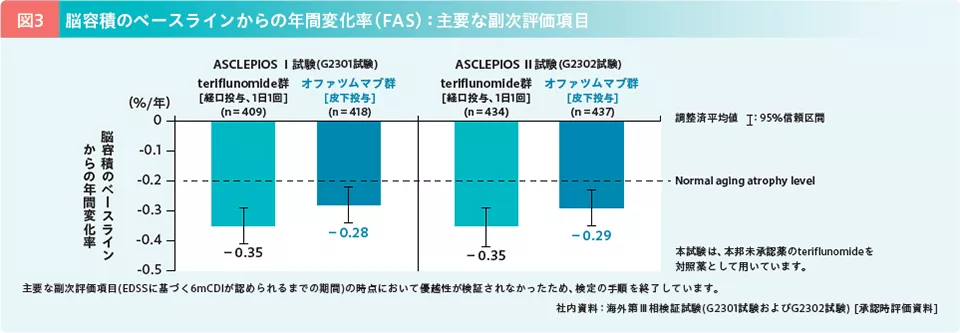
海外第Ⅲ相検証試験[ASCLEPIOS Ⅰ試験(G2301試験)・ASCLEPIOS Ⅱ試験(G2302試験)]は、再発を伴うMS患者を対象に、オファツムマブのteriflunomide(本邦未承認)に対する優越性を検証した試験である7)。両試験の主要評価項目(検証的解析項目)であるARR(1年あたりの確定再発数と定義)の推定値は、ASCLEPIOS Ⅰ試験ではteriflunomide群の0.22に対し、オファツムマブ群では0.11、ASCLEPIOS Ⅱ試験ではteriflunomide群の0.25に対し、オファツムマブ群では0.10と、両試験ともに2群間で有意差が認められ(いずれもp<0.001、負の二項回帰モデル)、ARRの低下率はそれぞれ50.5%および58.5%であった。主要評価項目(検証的解析項目)について、teriflunomide群に対するオファツムマブ群の優越性が検証された(図2)。また、主要な副次評価項目の1つである脳容積のベースラインからの年間変化率(調整済平均値)は、ASCLEPIOS Ⅰ試験でteriflunomide群-0.35%、オファツムマブ群-0.28%、ASCLEPIOS Ⅱ試験でそれぞれ-0.35%、-0.29%であった(図3)(なお、先に検証されたEDSSに基づく6ヵ月持続する障害改善(6mCDI)が認められるまでの期間では、オファツムマブ群のteriflunomide群に対するハザード比が1.35(95% CI:0.950-1.924)と優越性が検証されなかったため、検定は打ち切られ、脳容積のベースラインからの年間変化率は、名目的な扱いとなった)。
なお、健常人の老化による脳容積の年間変化率は-0.2%程度8)であることを考慮すると、オファツムマブ群はteriflunomide群に比べて脳萎縮を抑制していることが示唆された。
MSの慢性進行を明確に定義するのは依然として困難であるが、その病態を臨床的に捉えるための概念として、PIRA(progression independent of relapse activity:再発に関連しない障害進行)が提唱されている。MSの障害進行のドライバーとして再発以上にPIRAをいかに捉えるかが重要である。
海外第Ⅲ相検証試験(ASCLEPIOS Ⅰ試験・ASCLEPIOS Ⅱ試験)の詳細についてはこちらをご覧ください。
関西多発性硬化症センターにおけるオファツムマブのリアルワールドデータ
当センターを受診した、活動性が平均的または平均以上のMS患者510例を対象に、wash-out期間を設けずにオファツムマブへ切り替えた際の有効性および安全性について検討した。
治療期間中央値は875日、最長治療期間は5.6年で、対象患者の年齢は15~86歳であった。前治療は、ナタリズマブが60.4%で最も多く、次いでシポニモド15.5%、フマル酸ジメチル12.0%、フィンゴリモド7.5%であった。オファツムマブへの切り替え理由として、疾患活動性の抑制状態を維持できる可能性、進行抑制への期待、さらに自己注射による利便性といった点が挙げられた。抗JCV抗体陽性率は92%(440/478例)であった。また、抗JCV抗体検査は保険適用外であることから、オファツムマブへの切り替えにより抗JCV抗体陰性患者において6ヵ月毎の定期検査が不要となる点が切り替えの一因となっていた。なお、オファツムマブは電子添文にて重大な副作用として、PMLが挙げられているが、2025年5月23日現在、MS患者での発生事例の報告はない。
ただし、電子添文上には、「慢性リンパ性白血病患者に対し点滴静注するオファツムマブ製剤を含む他の抗CD20抗体製剤及び他の多発性硬化症治療薬を投与した患者においてJCウイルス感染によるPMLが報告されている」と記載されており、オファツムマブによる治療期間中および治療終了後は患者の状態を十分に観察する必要がある。
B型肝炎ウイルス(HBV)感染とオファツムマブ治療における留意点
B型肝炎ウイルス(HBV)キャリア患者および既往感染者(HBs抗原陰性かつHBc抗体またはHBs抗体陽性)においては、オファツムマブ投与中にHBV再活性化による肝炎が発症する可能性がある。また、活動性B型肝炎患者においても同様のリスクがあるため、投与開始前にはHBV感染歴の評価が必須である。B型肝炎治療ガイドライン(第4版)9)では、活動性B型肝炎患者およびHBV DNA量が20 IU/mL以上のキャリア・既往感染者に対して核酸アナログ製剤の投与が推奨されている。HBV DNA量が20 IU/mL未満の場合でも、治療開始後および治療変更時(中止を含む)から少なくとも6ヵ月間は月1回、以降は3ヵ月毎のHBV DNA モニタリングが望ましいとされている。当センターにおいても、既往感染者15例に対してオファツムマブ治療を実施しており、うち9例は治療中止または他剤への切り替えが行われ、6例は現在も治療を継続している。
オファツムマブ投与中の妊娠と出産
妊娠に関しては、当院ではこれまでに12例、最近1例増えて13例を経験している。12例は妊娠中に薬剤投与を中断しており、その中断時期は妊娠判明時が9例、妊娠20週時が3例であった。妊娠8週までに3例が流産し、9例は正常出産にて健常児を出産し、新生児異常や奇形は認められなかった。
また、授乳についても、出産直後から通常通り行われている。電子添文における妊婦および授乳婦への注意事項については、本ページ内にも掲載しているので、あわせて確認されたい。
オファツムマブ治療下におけるB細胞数と再発リスク
オファツムマブの海外第Ⅱ相および第Ⅲ相試験の5試験から得られた1,486例のデータを解析した結果、オファツムマブ投与にてB細胞数が32 cells/μLを超えている状態では、MRI上の新規炎症性病変が抑制されにくくなり、治療効果が不十分であることが示されている10)。このため、臨床的には8 cells/μL以下に維持することが強く推奨されている。
当センターにおいて、MRI造影病巣が出現したMS患者17例のB細胞数を検討したところ、全例で8 c ells/μL以下であった。このことから、MRI造影病巣の出現(つまり再発)には、B細胞数抑制不十分以外の要因が関与している可能性が考えられた。
さらに、IgG・IgM値と感染症発症の間に相関性はなく、発癌増加も現在までのところ認められていない。今後もさらなる安全性データの蓄積が必要と考えている。
1)Kappos L, et al. Mult Scler. 2016;22(10):1297-1305.
2)Newsome SD, et al. Neurol Ther. 2023;12(6):1909-1935.
3)Samjoo IA, et al. J Comp Eff Res. 2023;12(7):e230016.
4)de Sèze J, et al. Front Immunol. 2023;14:1004795.
5)Comi G, et al. Ann Neurol. 2021;89(1):13-23.
6)Teeling JL, et al. J Immunol. 2006;177(1):362-371.
7)Hauser SL, et al. J Engl J Med. 2020;383(6):546-557.
8)Kirov II, et al. Neurobiol Aging. 2021;98:42-51.
9)日本肝臓学会 肝炎診療ガイドライン作成委員会 編. B 型肝炎治療ガイドライン(第4版), 2022年6月.
(https://www.jsh.or.jp/lib/files/medical/guidelines/jsh_guidlines/B_v4_20220817.pdf)(2025年6月アクセス)
10)Yu H, et al. CNS Drugs. 2022;36(3): 283-310.
ご所属、ご講演内容については2025年9月作成時点のものです
| 1. 警告 1.1 慢性リンパ性白血病の治療のためにオファツムマブを点滴静注したB型肝炎ウイルスキャリアの患者において、B型肝炎ウイルスの再活性化により肝不全に至り死亡した例が報告されている。 [8.1 参照] , [9.1.1 参照] |
| 8. 重要な基本的注意 8.1 B型肝炎ウイルスの再活性化による肝炎があらわれるおそれがあるので、本剤投与に先立ってB型肝炎ウイルス感染の有無を確認すること。 [1.1 参照] , [9.1.1 参照] |
| 9. 特定の背景を有する患者に関する注意 9.1 合併症・既往歴等のある患者 9.1.1 活動性B型肝炎患者、B型肝炎ウイルスキャリアの患者又は既往感染者(HBs抗原陰性、かつHBc抗体又はHBs抗体陽性) 活動性B型肝炎患者では、肝炎の治療を優先すること。本剤の治療期間中及び治療終了後は、継続して肝機能検査値や肝炎ウイルスマーカーのモニタリングを行うなど、B型肝炎ウイルスの再活性化の徴候や症状の発現に注意すること。B型肝炎ウイルスキャリアの患者又は既往感染者(HBs抗原陰性、かつHBc抗体又はHBs抗体陽性)ではB型肝炎ウイルスの再活性化により肝炎があらわれるおそれがある。[1.1 参照], [8.1 参照] 9.4 生殖能を有する者 妊娠可能な女性に対しては、本剤投与中及び本剤最終投与後6ヵ月間は適切な避妊法を用いるよう指導すること。[9.5.1 参照] 9.5 妊婦 9.5.1 妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。サルを用いた胚及び胎児発生・拡充型出生前及び出生後の発生並びに母体の機能に関する試験においてオファツムマブは胎盤を通過することが確認されており、胎児・乳児で末梢血B細胞数の枯渇及び脾臓重量の減少、乳児でキーホールリンペットヘモシアニン(KLH)に対する液性免疫応答の低下が認められている。臨床曝露量の160倍(AUCを指標)で母動物(サル)の乳児において、免疫調節による感染症を起因とした早期死亡が認められている。[9.4 参照], [9.5.2 参照] 9.6 授乳婦 治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。本剤の母乳中への移行は不明であるが、ヒトIgGは母乳中に移行することが知られている。 |
ケシンプタ皮下注20mgペン電子添文(2024年6月改訂:第5版)
