パンくず

目的
再発を伴う多発性硬化症患者を対象に、年間再発率(確定再発の頻度)を指標として、オファツムマブ(20mgを4週毎皮下投与)のteriflunomide(14mgを1日1回経口投与:本邦未承認薬)に対する優越性を検証する。なお、副次目的として、総合障害度スケール(EDSS)に基づく障害関連項目については、治験実施計画書に記載の通り、ASCLEPIOS Ⅰ試験とASCLEPIOS Ⅱ試験との併合データ(海外第Ⅲ相併合データ)に基づいて評価し、EDSSに基づく障害関連以外の項目については試験毎に評価する。
対象
再発を伴う多発性硬化症患者1,882例(ASCLEPIOS Ⅰ試験:927例、ASCLEPIOS Ⅱ試験:955例)
<選択基準>
1. スクリーニング時の年齢:18~55歳
2. McDonald診断基準(2010年改訂版)で多発性硬化症と診断された患者
3. 再発を伴う多発性硬化症患者:再発寛解型多発性硬化症または疾患活動性を伴う二次性進行型多発性硬化症患者
4. スクリーニング前1年以内に1回以上または2年以内に2回以上、新規の神経学的異常または既存の神経学的異常の悪化が認められた患者、または、ランダム化前1年以内に脳MRIで疾患活動性〔ガドリニウム(Gd)造影T1病変〕が認められた患者
5. スクリーニング時のEDSS:0~5.5
6. ランダム化前1ヵ月以内に神経学的に安定している患者
試験デザイン
第Ⅲ相、多施設共同、ランダム化、二重盲検、ダブルダミー、実薬対照、並行群間比較、event-driven試験。
海外第Ⅲ相検証試験は、ASCLEPIOS Ⅰ試験およびASCLEPIOS Ⅱ試験の2試験で構成され、両試験は試験デザイン、選択・除外基準、用法・用量すべてが同じとなっている。また、両試験ともに、スクリーニング期(最長45日)、二重盲検投与期(最長30ヵ月)、追跡調査期(最短9ヵ月)の3期で構成されている。
投与方法
スクリーニング期の評価で適格と判断された被験者は、二重盲検投与期の1日目に、オファツムマブ群またはteriflunomide群に1:1の比でランダム化された。二重盲検投与期において、オファツムマブ群では、オファツムマブ20mgを初回(1日目)、1週後、2週後、4週後、以降は4週毎に皮下投与した。teriflunomide群では、teriflunomide 14mgを1日目から1日1回経口投与した。
なお、初回投与の1日目は、院内にて医療施設のスタッフが皮下投与したが、1週後、2週後、4週後は被験者の希望に応じて、院内にてスタッフの指導下で被験者/介護者が自己投与、2ヵ月後以降は被験者の希望に応じて、医師の判断により、被験者/介護者による在宅での自己投与を許容した。また、注射に伴う反応を軽減させるため、皮下投与前に、アセトアミノフェンおよび/または抗ヒスタミン剤(または同等の薬剤)の経口投与を推奨注1)し、初回投与時のみメチルプレドニゾロン100mg(または同等の薬剤)の静脈内投与も許容注1)した。ただし、本試験で使用した皮下投与製剤は、安全装置付きのプレフィルドシリンジ製剤注2)である。
注1)「注射に伴う全身反応の軽減」に対しては本邦未承認
注2)ケシンプタ皮下注20mgペンは、プレフィルドシリンジを組み込んだオートインジェクター製剤である。
評価項目
◎ 主要評価項目(検証的解析項目):年間再発率※
※:年間再発率は、1年あたりの確定再発数と定義した。
◎ 主要な副次評価項目(検証的解析項目):EDSSに基づく3ヵ月持続する障害増悪(3mCDW)が認められるまでの期間、EDSSに基づく6ヵ月持続する障害増悪(6mCDW)が認められるまでの期間、EDSSに基づく6ヵ月持続する障害改善(6mCDI)が認められるまでの期間、1スキャンあたりのGd造影T1病変数、年間の新規または拡大T2病変数、血清ニューロフィラメントL鎖(NfL)濃度、脳容積のベースラインからの年間変化率
◎ その他の副次評価項目:No Evidence of Disease Activity(NEDA)-4など
◎ 安全性評価項目:有害事象、臨床検査、心電図、バイタルサイン、免疫原性
解析計画
有効性の主要な解析対象集団は最大の解析対象集団(FAS)とし、ランダム化されたすべての被験者、安全性解析対象集団は治験薬が1回以上投与されたすべての被験者とした。
◎ 多重性の調整
主要評価項目および主要な副次評価項目の仮説検定は、第一種の過誤を個々の試験レベルおよび同一デザインの試験(ASCLEPIOS Ⅰ試験およびASCLEPIOS Ⅱ試験)を合わせたレベルで管理するために、下図に示す階層的な順序で実施した。各試験では、主要評価項目の帰無仮説が棄却された場合、MRIおよびNfL関連の仮説は、進行中の仮説が有意水準0.05(両側)ですべて棄却される限り、各試験内で逐次的な順序で検証した。障害増悪/改善に関する評価項目の仮説は、両試験ともに主要評価項目の帰無仮説が棄却された場合に、両試験を併合した海外第Ⅲ相併合データを用いて有意水準0.04875(両側)で検証した。
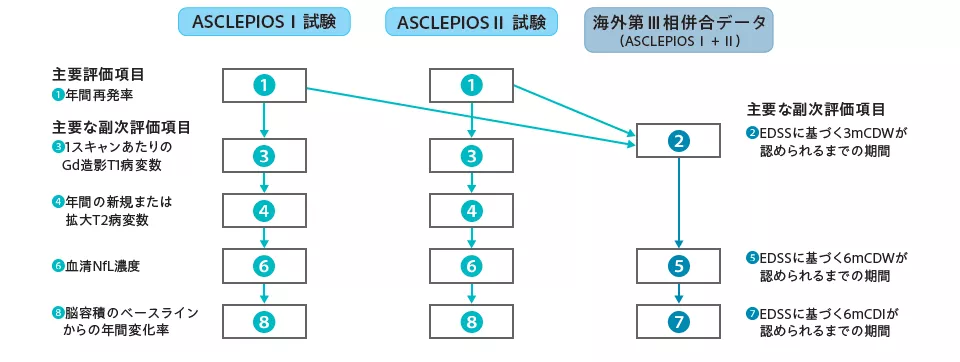
◎ 主要評価項目:年間再発率
オファツムマブ群のteriflunomide群に対する優越性を、帰無仮説「年間再発率に基づき評価した確定再発の頻度の抑制効果が投与群間で差がない」に対する対立仮説「投与群間で差がある」を設定して検証した。なお、患者背景(年齢、性別、体重、地域、MS病型、ベースラインのEDSS、過去2年間の再発回数、ベースラインのGd造影T1病変数、ベースラインのT2病変容積、DMDの前治療歴)別に評価したサブグループ解析は事前に計画されていたものであり、被験者数の確保のため、海外第Ⅲ相併合データを用いて解析した。
◎ 主要な副次評価項目
・障害増悪/改善に関する主要な副次評価項目
EDSSに基づく障害増悪/改善に関する主要な副次評価項目については、評価に必要な被験者数を確保するため、治験実施計画書で事前に規定した通り、海外第Ⅲ相併合データを用いて解析した。オファツムマブ群のteriflunomide群に対する優越性を、帰無仮説「障害増悪(または改善)が認められるまでの期間が投与群間で差がない」に対する対立仮説「投与群間で差がある」を設定して検証した。試験を層、投与群、地域を要因、ベースラインのEDSSを連続共変量とした、層別Cox比例ハザードモデルを用いて解析した。
なお、3mCDW/6mCDWについて、患者背景(年齢、性別、体重、地域、MS病型、ベースラインのEDSS、過去2年間の再発回数、ベースラインのGd造影T1病変数、ベースラインのT2病変容積、DMDの前治療歴)別に評価したサブグループ解析は事前に計画されており、試験を層、投与群、検討対象の部分集団、部分集団と投与群の交互作用を要因としたCox比例ハザードモデルを用いて解析するとともに、部分集団と投与群の交互作用を伴う拡張モデルをデータに適合させ、試験間の相違を部分集団毎の投与群の交互作用のtype-3 testを用いて検定し、p値を算出した。
・脳容積のベースラインからの年間変化率
オファツムマブ群のteriflunomide群に対する優越性を、帰無仮説「脳容積の変化率が投与群間で差がない」に対する対立仮説「投与群間で差がある」を設定して検証した。脳容積は頭蓋容積により補正した値を用いた。投与群、地域を固定効果(要因)、時間、ベースラインのGd造影T1病変数、ベースラインのT2病変容積、ベースラインの脳容積を連続共変量、投与群と時間の交互作用も含めたランダム係数モデルを用いて解析した。
◎ その他の副次評価項目
・NEDA-4
海外第Ⅲ相併合データで評価し、投与群、地域を要因、年齢、ベースラインのEDSS、ベースラインのGd造影T1病変数を共変量としたロジスティック回帰モデルを用いて解析した。
◎ 安全性評価項目
海外第Ⅲ相検証試験(ASCLEPIOS Ⅰ試験およびASCLEPIOS Ⅱ試験)は、同時期に実施された同一デザインの検証試験であり、被験者の組入れ基準および目標被験者数も同一で、人口統計学的特性、曝露期間、安全性の結果も類似していた。オファツムマブの安全性を評価する上で、試験毎では傾向が評価しにくい安全性プロファイル、特に発現率が低いものの重要な有害事象を包括的に評価するために、これら2試験の安全性データを併合し、海外第Ⅲ相併合データで評価した。また、オファツムマブ投与に関連する安全性の問題やリスクを検討すべく、オファツムマブおよびその類薬で懸念されるリスクに該当する事象(注射に関連する反応、感染症、良性・悪性・詳細不明の新生物)を「注目すべき有害事象」と定義して、海外第Ⅲ相併合データで評価した。
安全性
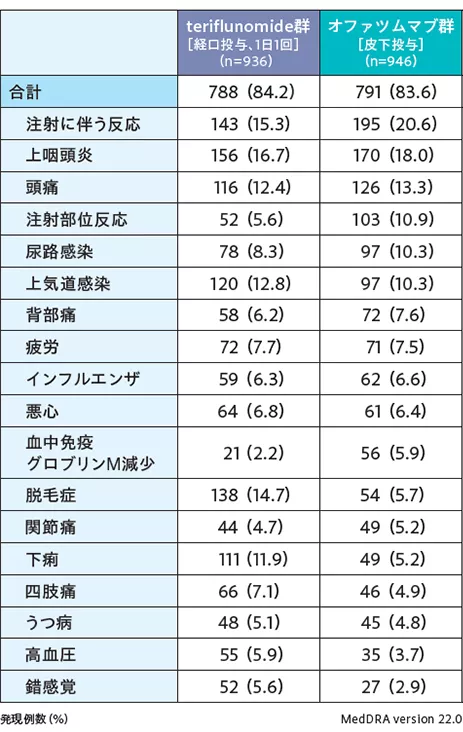
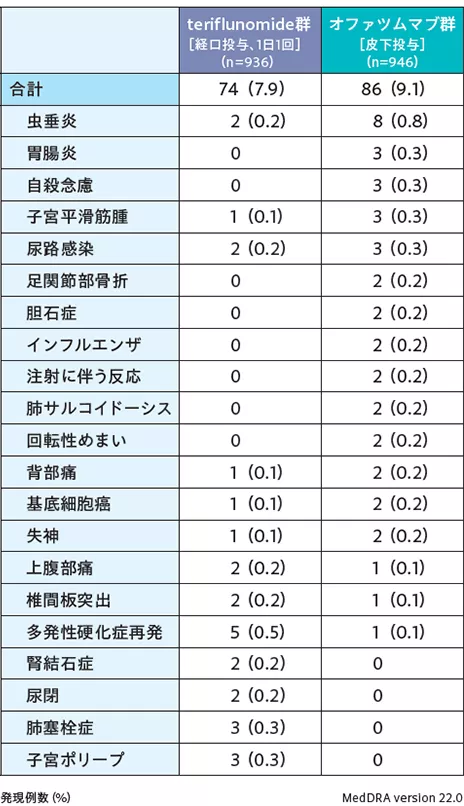
2試験の安全性データを併合した海外第Ⅲ相併合データを用いた安全性解析対象集団1,882例における有害事象、重篤な有害事象、投与中止に至った有害事象、死亡の発現状況は下表の通りであった(データカットオフ日:ASCLEPIOS Ⅰ試験 2019年7月5日、ASCLEPIOSⅡ試験 2019年7月10日)。
■有害事象〔いずれかの群で発現率5%以上〕
(海外第Ⅲ相併合データ:安全性解析対象集団)
■重篤な有害事象〔いずれかの群で2例以上〕
(海外第Ⅲ相併合データ:安全性解析対象集団)
■投与中止に至った有害事象〔いずれかの群で2例以上〕(海外第Ⅲ相併合データ:安全性解析対象集団)
■死亡(海外第Ⅲ相併合データ:安全性解析対象集団)
海外第Ⅲ相併合データにおける死亡の報告は、下表の通りであった。

★:ASCLEPIOSⅡ試験(G2302試験)の追跡調査期(治験薬投与中止後153日目)に、teriflunomide群の1例が大動脈解離により死亡したが、治験薬との関連はないと判断された。
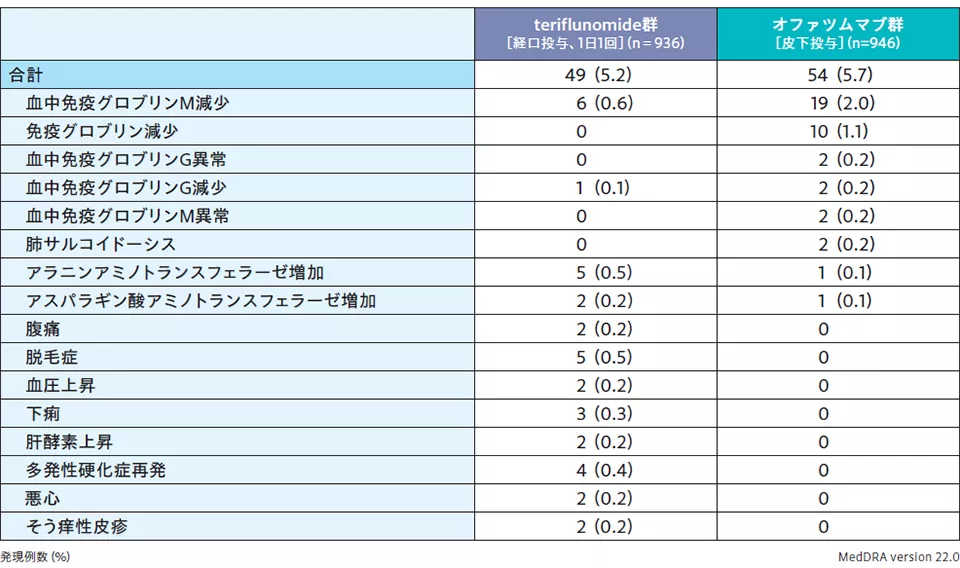
■オファツムマブの投与で注目すべき有害事象(海外第Ⅲ相併合データ:安全性解析対象集団)
オファツムマブ投与に関連する安全性の問題やリスクを検討すべく、オファツムマブおよびその類薬で懸念されるリスクに該当する事象(注射に関連する反応、感染症、良性・悪性・詳細不明の新生物)を「注目すべき有害事象」と定義して、2試験の安全性データを併合した海外第Ⅲ相併合データを用いて評価したところ、オファツムマブの投与で注目すべき有害事象の発現状況は下表の通りであった。
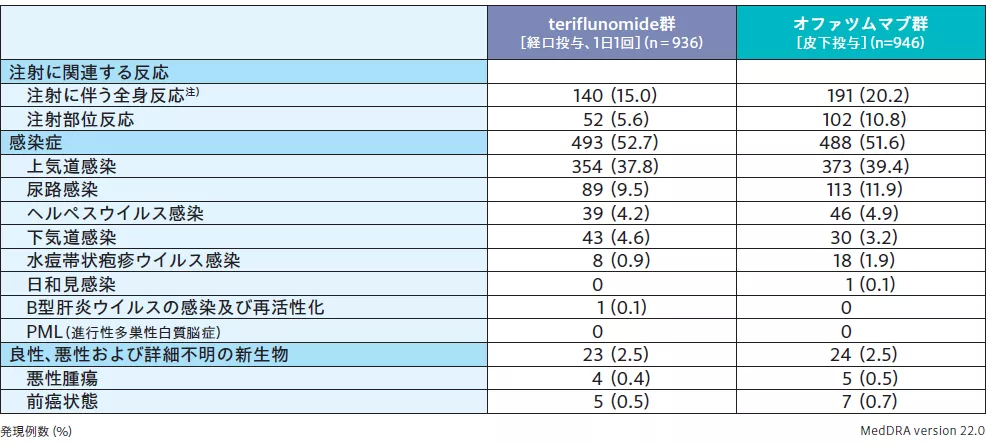
注)「注射に伴う全身反応」は、投与後24時間以内に発現した反応または症状を集計した。投与時刻、反応または症状の発現時刻、または症状が欠測の被験者7例(teriflunomide群3例、オファツムマブ群4例)は集計から除外した。
1)社内資料:海外第Ⅲ相試験(G2301試験)[承認時評価資料]
2)社内資料:海外第Ⅲ相試験(G2302試験)[承認時評価資料]
本試験は、本邦未承認薬のteriflunomideを対照薬として用いています。
