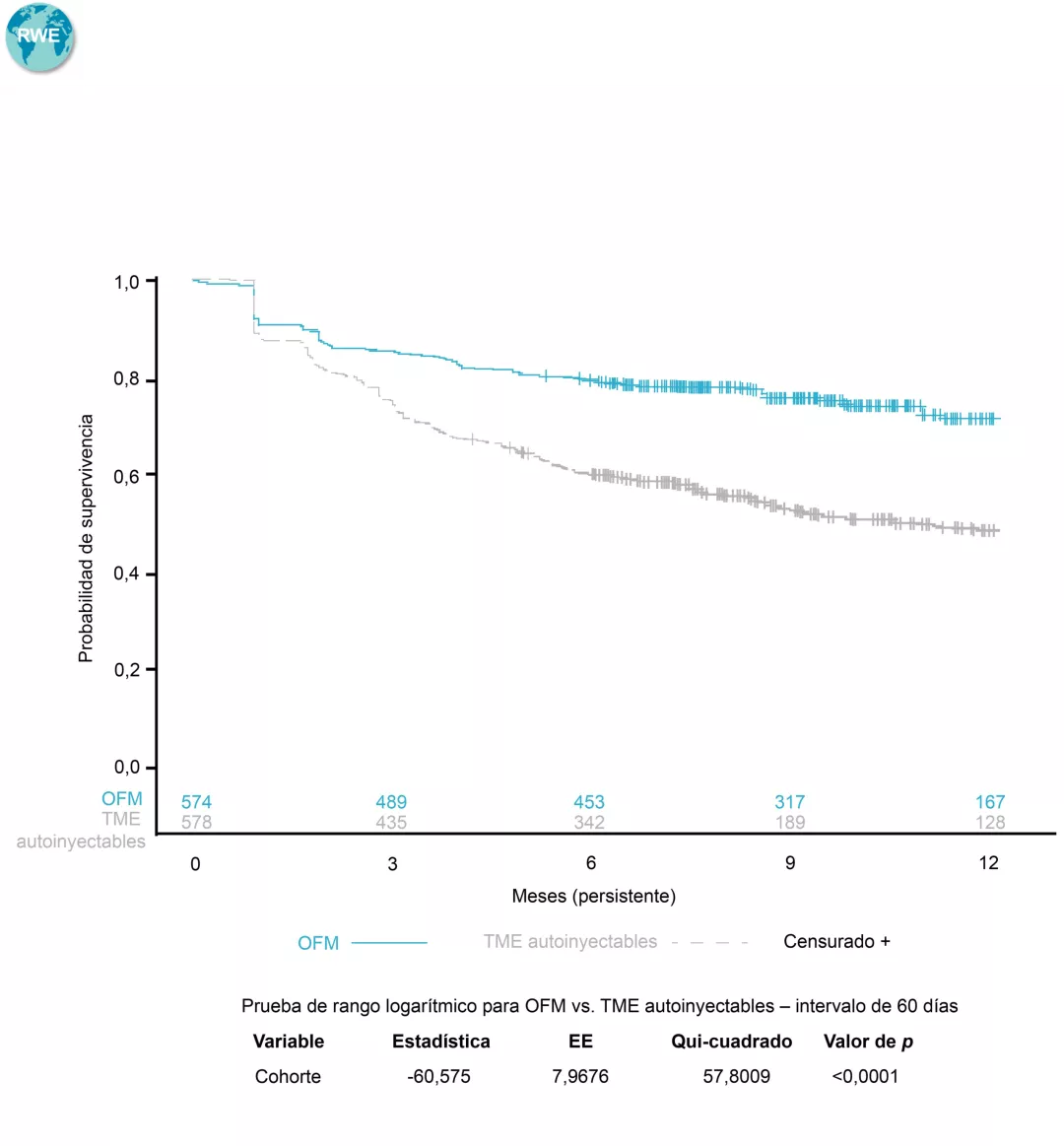
Sobre policitemia vera
La policitemia vera (PV) es una neoplasia mieloproliferativa crónica (NMPc) Filadelfia-negativa caracterizada por la proliferación clonal de hematíes, leucocitos y plaquetas. En su manifestación más típica, la PV se caracteriza por una eritrocitosis asociada de forma variable a leucocitosis y trombocitosis.
La PV se origina por la mutación en la célula madre hematopoyética, afectando a las pluripotenciales, lo que conduce a un crecimiento anormal de células progenitoras que llegan a ser capaces de formar colonias eritroides in vitro en ausencia de eritropoyetina exógena (EPO).
Fase pre-policitémica. Fase prodrómica caracterizada por una eritrocitosis en los límites altos de la normalidad o leve.
Fase policitémica. Esta fase se caracteriza por un aumento significativo del recuento de glóbulos rojos, aunque los principales síntomas a nivel de sangre periférica y médula ósea son atribuibles tanto a la proliferación efectiva de los linajes eritroide, como granulocítico y megacariocítico.
Fase post-policitémica. En este estadio de la enfermedad la eritropoyesis disminuye progresivamente. En consecuencia, la masa de glóbulos rojos se normaliza y luego disminuye y el bazo incrementa aún más su tamaño. Normalmente estos cambios se acompañan de alteraciones relacionadas a nivel de la médula ósea. Las citopenias, incluyendo la anemia, se asocian a la hematopoyesis ineficaz, la fibrosis de la médula ósea, la hematopoyesis extramedular y la esplenomegalia. El patrón de progresión de la enfermedad más común (se da en hasta el 10% de pacientes en 10 años) es la MF post-PV con metaplasia mieloide.
Edad avanzada
Leucocitosis
Anomalías en el cariotipo
Hemorragia grave.
Trombocitosis intensa (> 1-500 x 109/L).
Esplenomegalia dolorosa.
Sintomatología microvascular que no se controla con antiagregantes.
Síntomas constitucionales.
Prurito acuagénico intenso que no responde a antihistamínicos.
Requerimientos frecuentes de flebotomías (> 10 en un año) o mala tolerancia.
Leucocitosis marcada (>15x109/L).
Empeoramiento del hematocrito tras la administración de hierro.
Fisiopatología e incidencia
Bases fisiopatológicas
Bases fisiopatológicas y cambios celulares en la PV
El descubrimiento de la mutación JAK2V617F y su incidencia elevada en PV supuso un gran avance en la patogénesis de las NMPs, conduciendo a la demostración que la enfermedad era causada por una alteración de la regulación de la vía JAK-STAT.
Más del 95% de los pacientes de PV presentan la mutación JAK2V61F |
La evolución de la PV se puede dividir en tres fases:
Referencias:
1. Levine RL, et al. Nat Rev Cancer. 2007;7:673-83.
2. Michiels JJ, et al. World J Hematol 2015; 4(3): 16-53
3. Gianelli U et al. Mod Pathol. 2012 Sep;25(9):1193-202.
Bases moleculares
El desarrollo normal de las células sanguíneas está mediado por vías dependientes de JAK2, vía común de los receptores de eritropoyetina, trombopoyetina y el factor estimulante de granulocitos. En la policitemia vera, se produce una desregulación de esta vía de señalización JAK/STAT, aumentando la proliferación celular y haciendo que la estimulación sea independiente de la unión de los ligandos. La mutación principal es la JAK2V617F V617F en el exón 14 (95% de los casos) y por diferentes mutaciones en el exón 12 (4% de los casos) del gen JAK2.
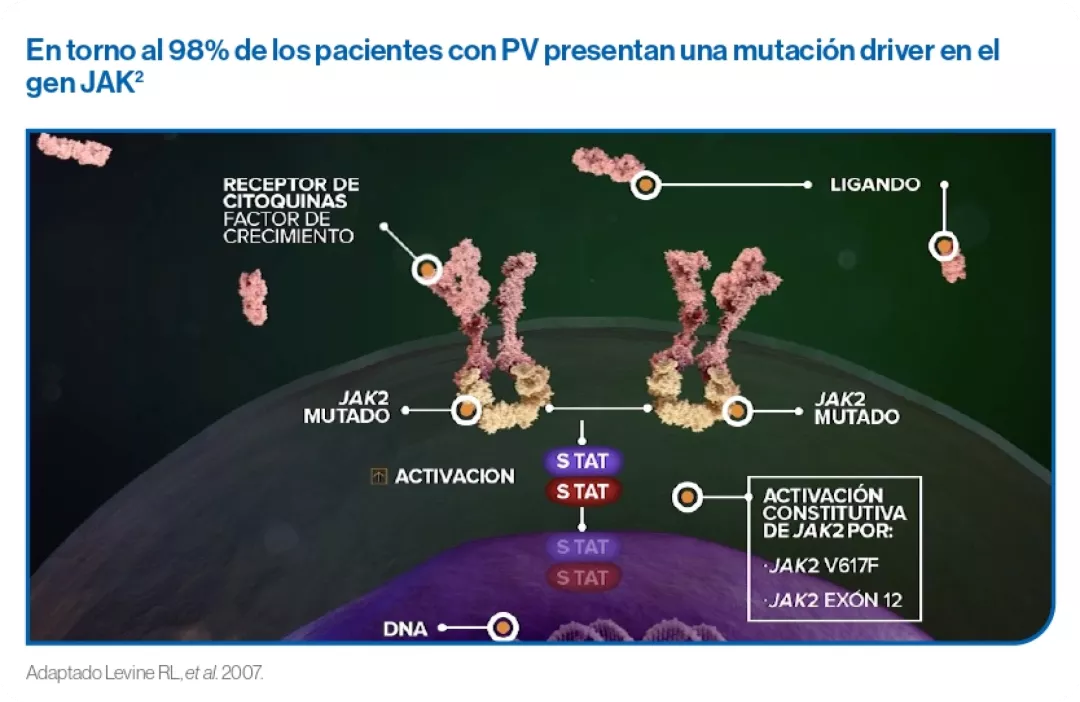
Con una menor frecuencia, algunos pacientes pueden presentar mutaciones driver en TET2, DNMT3a o ASXL1. El uso de secuenciación masiva ha permitido identificar y describir numerosas alteraciones implicadas en la patogénesis de PV como las que afectan a LNK o SOCS.
Epidemiología
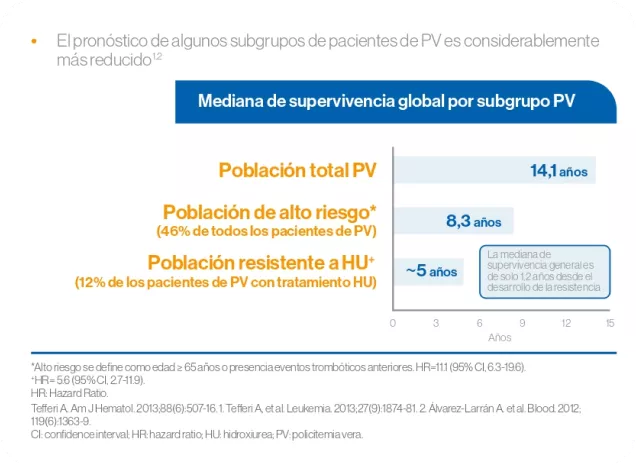
La PV puede darse en todas las poblaciones y grupos de edad. La mediana de edad en el momento del diagnóstico se sitúa entre los 60 años y la mediana de supervivencia global de los pacientes es de 14,1 años, si bien en pacientes mayores de 65 años y/o con trombosis previa se reduce a 8.3 años.
En la Unión Europea, se estima que la incidencia de la PV está entre 0,4 y 2,8 casos nuevos por cada 100.000 habitantes al año.
Referencias:
1. Levine RL et al.. Nat Rev Cancer. 2007 Sep;7(9):673-83.
2. Regimbeau, M. et al. Genes 2022, 13, 637.
3. Grinfield et al. N Engl J Med. 2018 Oct 11;379(15):1416-1430.
Diagnóstico y pronóstico
Diagnóstico
El diagnóstico de la PV se realiza actualmente de acuerdo con los criterios revisados en 2017 por la OMS.
Está indicado el estudio para confirmar/descartar la existencia de una policitemia vera cuando el hematocrito es > 0.48/l/l en mujeres y >0.51 l/l en hombres. El incremento en el número de hematíes, la microcitosis, la ferropenia y la coexistencia de leucocitosis y trombocitosis apoyan la sospecha de policitemia vera. En pacientes con historia de trombosis el estudio debe realizarse sin demora.
Los criterios de la OMS para el diagnóstico de la PV incluyen 3 criterios mayores y 1 criterio menor, exigiendo la presencia de todos los criterios mayores, o los dos primeros y el criterio menor.

Referencias:
1. Manual de recomendaciones en Neoplasias Mieloproliferativas Crónicas Filadelfia Negativas. 3ª Edición, 2020, Gemfin.
2. Tefferi A, Barbui T. Am J Hematol. 2015;90:162-73.
3. Moulard O, et al. Eur J Haematol. 2014;92(4):289-97.
4. Arber DA, et al.. Blood. 2016 May 19;127(20):2391-405.
5. Tefferi A. et al Leukemia 2013 Sep;27(9):1874-81
Pronóstico
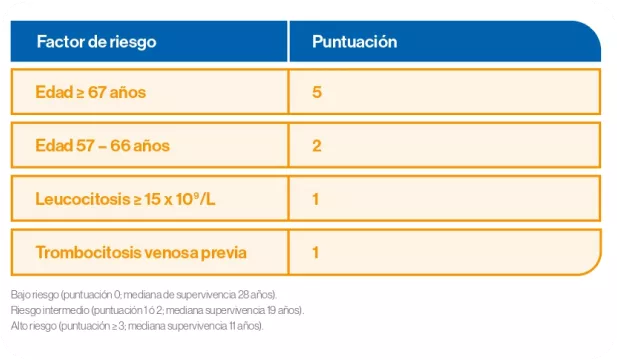
Respecto a los factores de riesgo leucémico:
La carga alélica de JAK2V617F >50% se asocia a mayor riesgo de progresión a mielofibrosis. Más recientemente, se han descrito variantes/mutaciones en genes distintos a JAK2 (ASXL1, SRSF2, e IDH2) que tienen un impacto en la supervivencia global y supervivencia libre de progresión (a mielofibrosis o leucemia).
Referencias:
1. Manual de recomendaciones en Neoplasias Mieloproliferativas Crónicas Filadelfia Negativas. 3ª Edición, 2020, Gemfin.
2. Tefferi A, Barbui T. Am J Hematol. 2015;90:162-73.
3. Moulard O, et al. Eur J Haematol. 2014;92(4):289-97.
4. Arber DA, et al.. Blood. 2016 May 19;127(20):2391-405.
5. Tefferi A. et al Leukemia 2013 Sep;27(9):1874-81.
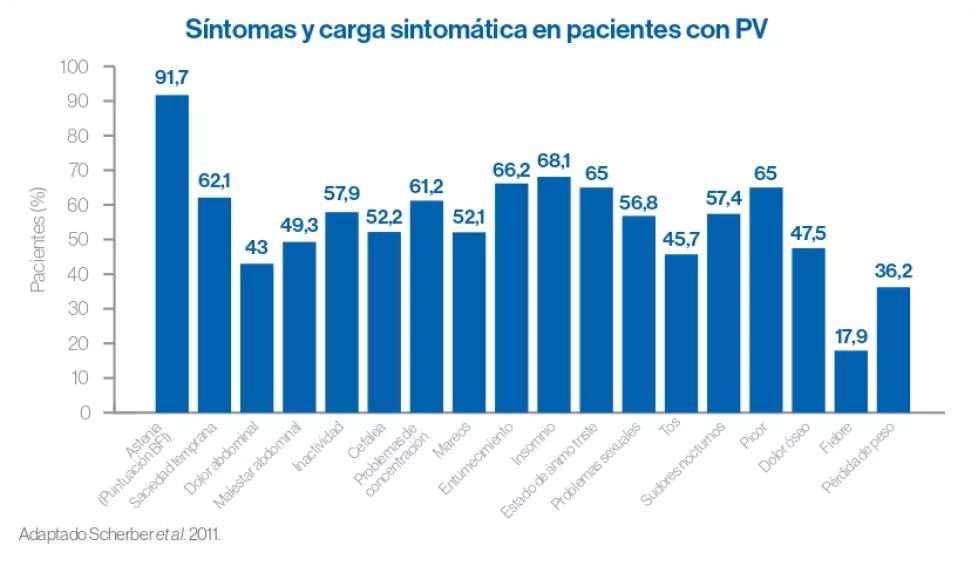
Fenómenos trombóticos y hemorrágicos
Esplenomegalia
La esplenomegalia está presente de un 35%-45% de los pacientes con PV. Numerosos síntomas clínicos derivan de la esplenomegalia, incluyendo dolor abdominal, saciedad temprana, disnea, tos o infarto esplénico.
Es de destacar que la esplenomegalia se ha relacionado con la PV no controlada, debido a su asociación a un mayor riesgo a transformación a MF.
Manifestaciones neurológicas
Algunos pacientes sufren síntomas derivados de alteraciones microcirculatorias, que son causadas por la obstrucción de la circulación sanguínea a través de vasos sanguíneos pequeños. Estos síntomas incluyen eritromelalgia, dolor de cabeza, mareos, alteraciones visuales y auditivas, fenómenos de tipo Raynaud o tromboflebitis superficial, parestesia y accidente isquémico transitorio.
Transformación a MF secundaria o a leucemia aguda mieloblástica
La transformación en leucemia aguda mieloblástica o síndromes mielodisplásicos (LAM/SMD) es una de las posibles evoluciones de la PV. Sin embargo, es más probable la transformación a MF secundaria. Después de más de 10 años de tratamiento, un 10% de pacientes desarrollan MF secundaria con esplenomegalia y citopenia, mientras que hasta un 6% de pacientes evolucionan a LAM.
Referencias:
1. Swerdlow SH, et al, eds. WHO Classification of Tumours of Haematopoietic and Lymphoid Tissues. 4th ed. Lyon, France: IARC; 2008. 2. Chou YS, et al. Eur J Haematol. 2013;90:228-236. 3. Tefferi A, et al. Leukemia. 2013;27:1874-1881. 4. Luo EJ, Levitt L. Hosp Physician. 2008;44:3. 5. Bhat, Vivek, et al. Journal of Stroke and Cerebrovascular Diseases 31.1 (2022): 106167. 6. Levine RL, et al. Nat Rev Cancer. 2007;7:673-83. 7. Lodish H, et al. Molecular Cell Biology. 6th ed. New York, NY, USA: W. H. Freeman & Co Ltd; 2008. 8. McMullin MF, et al. Br J Haematol. 2016;172(3):337-49.
Objetivos del tratamiento
El objetivo principal del tratamiento de la policitemia vera es la prevención de los eventos cardiovasculares trombóticos y hemorrágicos, sin incrementar el riesgo de transformación a mielofibrosis (~10% a los 10 años) o leucemia aguda (~5% a los 10 años) ni el desarrollo de neoplasias sólidas secundarias (~20%).
Estudios observacionales clásicos y un estudio aleatorizado han demostrado que el riesgo de muerte por evento cardiovascular o trombosis es menor en los pacientes que mantienen un hematocrito por debajo del 45% (incidencia 3,91 veces menor vs. hematocrito de entre 45% y 50%), por lo que este debe ser el objetivo de tratamiento cualquiera que sea la modalidad terapéutica seleccionada.
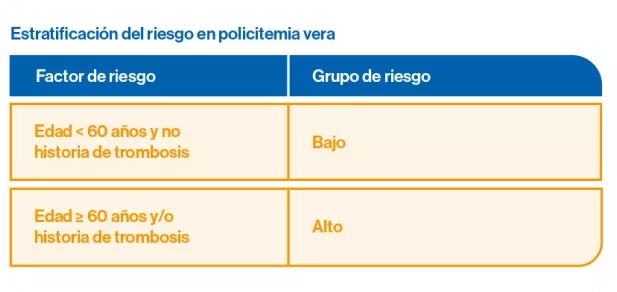
El tratamiento inicial depende del riesgo de estratificación del paciente, siendo los factores de riesgo más relevantes la edad (>60 años) y la historia previa de trombosis.
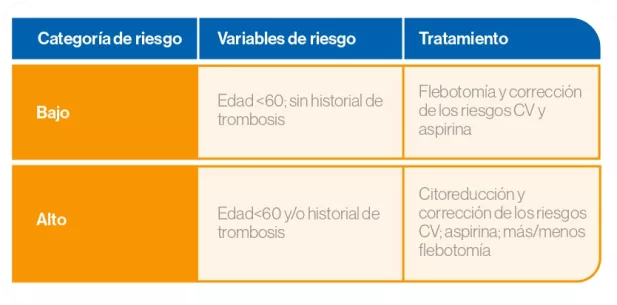
Según las guías vigentes de la ELN, todos los pacientes con PV deben ser manejados con flebotomías para mantener un hematocrito <45% y tratados con ácido acetilsalicílico (AAS) a dosis bajas.
La citorreducción está indicada para pacientes de alto riesgo (mayores de 60 años y/o trombosis previa) y en algunas situaciones concretas si el paciente es de bajo riesgo:
El objetivo principal del tratamiento de la PV es prevenir las complicaciones trombohemorrágicas sin incrementar el riesgo de transformación. Mantener un hematocrito por debajo de 45% debe ser el objetivo de tratamiento cualquiera que sea la modalidad terapéutica. |
Referencias:
1. Manual de recomendaciones en Neoplasias Mieloproliferativas Crónicas Filadelfia Negativas. 3ª Edición, 2020, Gemfin.
2. Barbui T, Leukemia. 2018 May;32(5):1057-1069.
Tratamiento farmacológico
Antiagregación
El AAS sigue siendo la terapia estándar para la antiagregación en PV.
El AAS bloquea la síntesis de tromboxano del ácido araquidónico de las plaquetas a través de la acetilación irreversible y la inhibición de la ciclooxigenasa, una enzima clave en la síntesis de prostaglandina y tromboxano. Esta supresión dura la vida útil de una plaqueta.
El estudio ECLAP demostró que el AAS a dosis bajas puede prevenir de manera segura las complicaciones trombóticas en pacientes de PV. Por este motivo su uso está recomienda en todos los pacientes salvo contraindicación.
Según las recomendaciones vigentes, todos los pacientes de PV deben ser tratados con AAS a dosis bajas salvo contraindicación médica. |
Flebotomía
Es el tratamiento de elección para mantener el hematocrito <45% en pacientes de bajo riesgo. Consiste en la extracción de 450 ml de sangre venosa (300 ml, en pacientes de edad avanzada o con cardiopatía) una o dos veces por semana hasta obtener un hematocrito ≤ 42% (mujeres) o ≤ 45% (hombres). La pauta de mantenimiento se adaptará a las necesidades del paciente (en caso de mala tolerancia o elevada frecuencia de flebotomías, se considerará tratamiento citorreductor). Alternativamente, se puede utilizar la eritroaféresis.
En ocasiones, la ferropenia resultante puede dar lugar a una trombocitosis reactiva. En el caso de desarrollo de síntomas graves por ferropenia se aconseja suplementar con hierro oral siempre con un control estrecho del hematocrito (máximo 4 semanas).
Hidroxiurea (HU)
La HU se utiliza comúnmente en pacientes con PV que requieren terapia citorreductora.
La dosis inicial es de 500-1000 mg/día vía oral, con titulación posterior para normalizar el hematocrito, el recuento de plaquetas y de leucocitos y la esplenomegalia, sin provocar leucopenia.
Alrededor de un 11% desarrolla resistencia a HU, debido a la aparición de citopenias que obligan a ajustar la dosis del fármaco o a la falta de eficacia a la dosis óptima consensuada por la ELN (2g al día durante 3 meses).
Un 13% tiene que suspender la HU por intolerancia (las úlceras maleolares u orales son la causa más frecuente).
Aproximadamente, el 25% de los pacientes desarrollan resistencia o intolerancia a HU. |
Criterios de resistencia/intolerancia a la hidroxiurea

Riesgo trombótico en policitemia vera
 VIDEO
VIDEO
¿Sabías que…?
Mide tus conocimientos en trombosis con estas cinco vídeo cápsulas
Capítulo 1: Mortalidad en PV
 VIDEO
VIDEO
La principal causa de morbi-mortalidad en policitemia vera son los eventos trombóticos. Aproximadamente el 40% de los pacientes con PV sufren un evento trombótico a lo largo de su enfermedad. Más de 1 de cada 3 muertes se asocian a dichos eventos.
Capítulo 2: Impacto HTC > 45%
 VIDEO
VIDEO
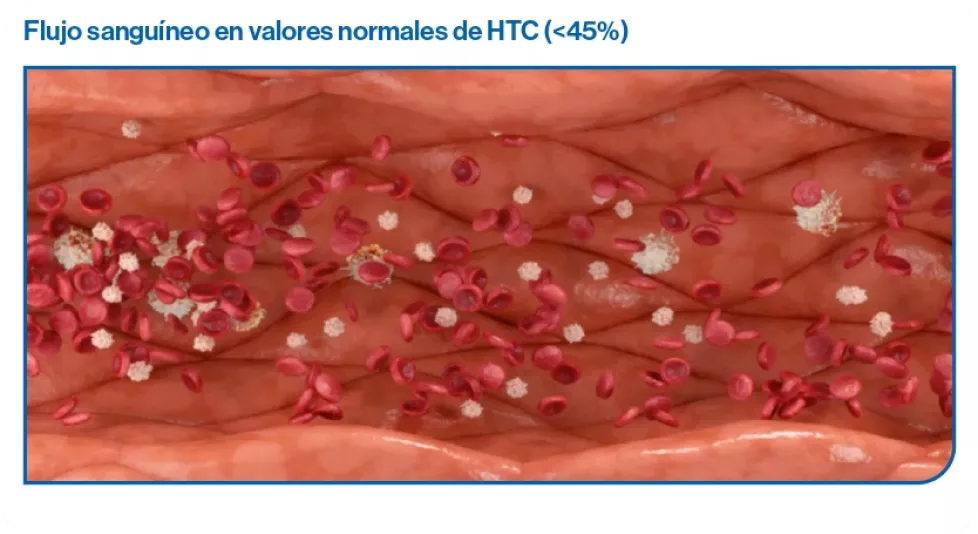
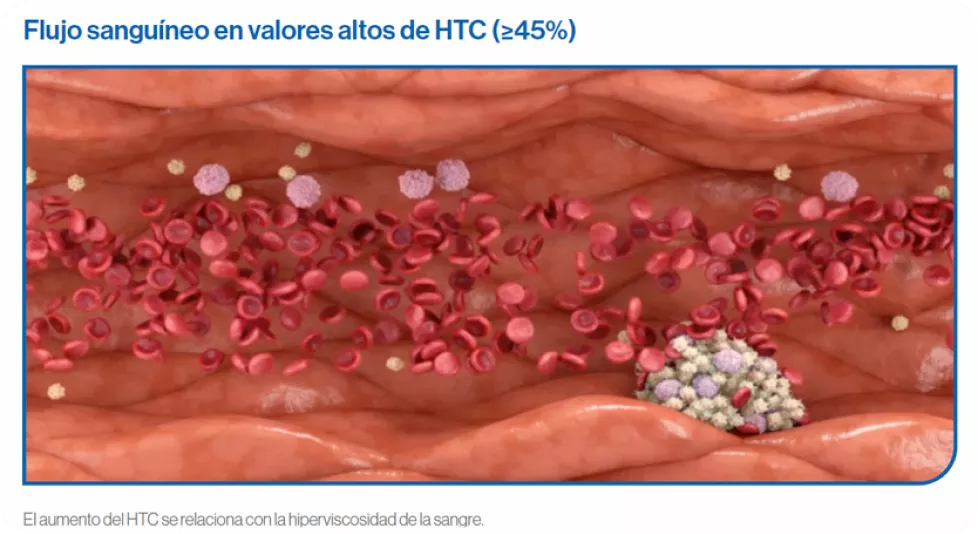
Un hematocrito igual o superior a 45%, provoca un aumento en la viscosidad sanguínea y una alteración de la hemodinámica natural. Los hematíes se agrupan en el centro de la luz del vaso y marginan al lecho vascular a las otras células, ocasionando un cambio del flujo hemodinámico, de lineal a turbulento.
Capítulo 3: Activación JAK2
 VIDEO
VIDEO
La activación de JAK2 favorece la expresión de factores procoagulantes, una mayor adhesión de las células sanguíneas al endotelio dañado y la sobreproducción de microvesículas eritrocitarias que provocará vasoespasmo. Además, esta activación produce un aumento del factor tisular junto con la activación permanente de los leucocitos y plaquetas.
Capítulo 4: Neutrófilos y trombogénesis
 VIDEO
VIDEO
Las trampas extracelulares de neutrófilos (NETs) son estructuras extracelulares conformadas por DNA e histonas que favorecen la activación directa de factores procoagulantes, promoviendo la activación y la agregación plaquetaria y degradando o bloqueando la producción de sustancias anticoagulantes naturales.
Capítulo 5: Control del riesgo trombótico
 VIDEO
VIDEO
La PV es una enfermedad protrombótica multifactorial. Los pacientes con PV deben ser mantenidos con un hematocrito inferior a 45% y antiagregados salvo contraindicación médica. La anticoagulación tiene un papel importante en la prevención secundaria y es fundamental el control de la leucocitosis y de los factores de riesgo cardiovascular.
Los básicos de la trombosis
Fenómenos trombóticos y hemorrágicos
Las complicaciones trombohemorrágicas son la principal causa de morbilidad y mortalidad en PV en su historia natural.
La causa de la trombosis en PV es la producción anómala de células sanguíneas que resulta en un incremento de la viscosidad sanguínea, junto con las anomalías cuantitativas y cualitativas observadas a nivel de plaquetas y leucocitos y el estado inflamatorio.
El aumento de la viscosidad de la sangre en casos con hematocritos más elevados y un volumen sanguíneo en el rango normal, altera el flujo sanguíneo y reduce el transporte de oxígeno.
El aumento del volumen sanguíneo por eritrocitosis amplia el lecho vascular, disminuye la resistencia periférica y aumenta el gasto cardíaco. Además, provoca que el flujo sanguíneo sea axial, con un flujo central de glóbulos rojos circulantes que se desliza sobre una capa periférica de plasma lubricante.
La mutación de JAK2 produce una sobreestimulación de la vía, lo que conduce a un aumento de la proliferación celular. Esta mutación provoca que la estimulación de la vía sea independiente de la unión de los factores a su receptor y por tanto esté activa en presencia o ausencia de los ligandos. La consecuencia de esta hiperestimulación, entre otras, es la hipercoagulabilidad, provocada por hiperviscosidad celular, cambios en los factores del endotelio y en la adhesión y función celular.
Referencias:
1. Levine RL, et al. Nat Rev Cancer. 2007 Sep;7(9):673-83. 2. Lodish H, et al. Molecular Cell Biology. 6th ed. New York, NY: W. H. Freeman; 2008. 3. Vardiman JW, et al. Blood. 2009 Jul 30;114(5):937-51. 4. Stuart BJ, Viera AJ. Am Fam Physician. 2004 May 1;69(9):2139-44. 5. Hensley B, et al. Expert Opin Pharmacother. 2013 Apr;14(5):609-17. 6. Swerdlow SH, et al, eds. WHO Classification of Tumours of Haematopoietic and Lymphoid Tissues. 4th ed. Lyon, France: IARC; 2008. 7. Spivak J. N Engl J Med. 2004 Jan 8;350(2):99-101. 8. Falanga A, et al. Blood. 2000;96:7. 9. Alvarez-Larrán A, et al. Br J Haematol. 2004;124:329-35.10. Arellano-Rodrigo E, et al. Haematologica. 2006;169.75. 11. Falanga A, et al. Exp Hematol. 2007;35:702-11. 12. Alvarez-Larrán A, et al. Ann Hematol. 2008;87:269- 76. 13. Torregrosa JM, et al. Br J Haematol. 2016 Mar:172(5):813-5. 14. Guy A, et al. Leukemia. 2019;33:2544-8. 15. Jensen MK, et al. Br J Haematol. 2000;110:116-24. 16. Arellano-Rodrigo E, et al. Am J Hematol. 2008;84:102-8. 17. Charpentier A, et al. Haematologica 2016;101:e365-8. 18. Trappenburg MC, et al. Haematologica. 2009;94:911-8. 19. Tong D, et al. Ann Hematol. 2018;97:605-16. 20. Barbui T, Falanga A. Thromb Res. 2016 Apr:140 Suppl 1:S71-5. 21. Falanga A, Marchetti M. Hematology Am Soc Hematol Educ Program. 2012;2012-571-81. 22. Zawrotniak M, Rapala-Kozik M. Acta Biochim Pol. 2013;60(3):277-84. Epub 2013 Jul 1. 23. Gordeuk VR, et al. Haematologica 2019 Apr;104(4):653-658. 24. Lodish H et al. Molecular Cell Biology. 6th ed. New York, NY: W. H. Freeman; 2008. 25. Levine RL, et al. Nat Rev Cancer. 2007 Sep;7(9):673-83. 26. Perner F, et al. Cells. 2019 Aug 8;8(8):854.
Manejo y prevención de trombosis en PV
FA-11307138 - 11/2024
Información general de patología
La policitemia vera es una NMP crónica Filadelfia negativa englobada dentro del grupo de NMP, según la clasificación establecida por la OMS.

La PV se considera la NMP más común en Europa.
La PV está causada por una desregulación de la vía JAK/STAT. Prácticamente todos los pacientes presentan la mutación somática JAK2V617F del gen JAK2 (gen de la proteína quinasa Janus 2) que da lugar a una proteína con actividad constitutiva u otra mutación de JAK2 con consecuencias funcionales similares.
Estas mutaciones resultan en un aumento de la proliferación del linaje eritroide mayoritariamente y del linaje granulocítico y megacariocítico en menor medida.