Dette nettstedet er kun for helsepersonell som lege, offentlig godkjent sykepleier og farmasøyt
Avansert behandling av pasienter med HR+/HER2- tidlig brystkreft2
Kisqali er indisert for behandling av: kvinner med HR+, HER2- lokalavansert eller metastatisk brystkreft sammen med aromatasehemmer eller fulvestrant, som innledende endokrinbasert behandling, eller hos kvinner som tidligere har fått endokrin behandling.
Hos pre- eller perimenopausale kvinner skal endokrin behandling kombineres med en luteiniserende hormonfrigjørende hormon (LHRH)-agonist.
CDK4/6-hemmere i behandling av HR+/HER2- metastatisk brystkreft – i tråd med Beslutningsforums vedtak og nasjonale anbefalinger
Tabellen under gir en oversikt over CDK4/6-hemmere som er innført av Beslutningsforum for behandling av pasienter med hormonreseptorpositiv, HER2-negativ lokalavansert eller metastatisk brystkreft. Rangeringen reflekterer posisjonen i det nasjonale legemiddelanbudet.
Abemaciclib (Verzenios) er rangert som førstevalg og kan brukes i kombinasjon med enten aromatasehemmer eller fulvestrant. 1
Ribociclib (Kisqali) er rangert som andrevalg og er godkjent for bruk i første- og andrelinje, i kombinasjon med endokrin behandling. Hos pre- og perimenopausale kvinner skal behandlingen kombineres med LHRH-agonist.1
Palbociclib (Ibrance) er ikke rangert i anbudet, men er fortsatt innført for relevante indikasjoner. 1
Behandlingsvalg bør baseres på en helhetlig vurdering av pasientens sykdomsbilde, tidligere behandling, tolerabilitet og preferanser. Alle tre CDK4/6-hemmere er godkjent av Beslutningsforum og kan forskrives innenfor sine respektive indikasjoner.3
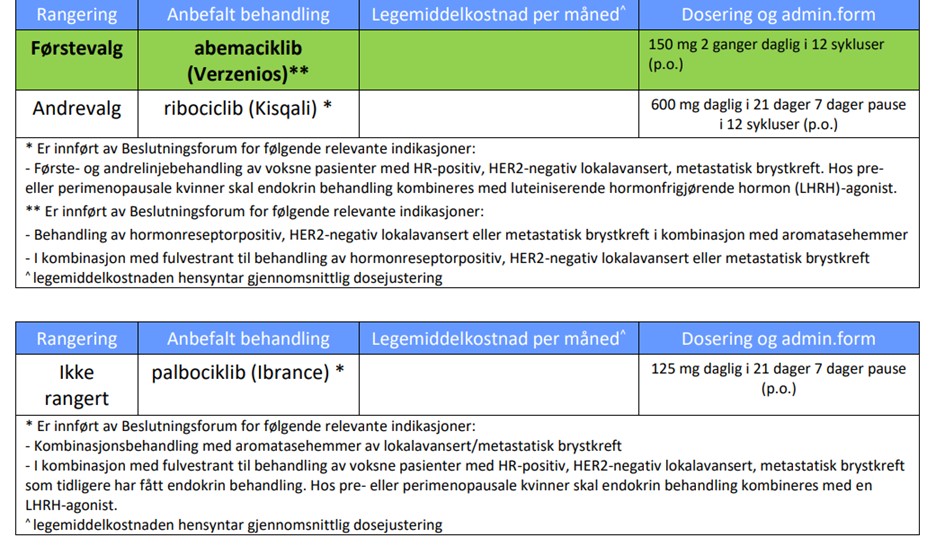
Dosering2
Kisqali i kombinasjon med aromatasehemmer
- De fleste pasientene starter med en dose på 600 mg (3 Kisqali tabletter à 200 mg) + aromatasehemmer samtidig.
- Pasientene må ta Kisqali + en aromatasehemmer i tre uker. I uke fire tas kun aromatasehemmeren. Deretter gjentas syklusen.*
* Se fullstendig SPC for aromatasehemmer for ytterligere informasjon.
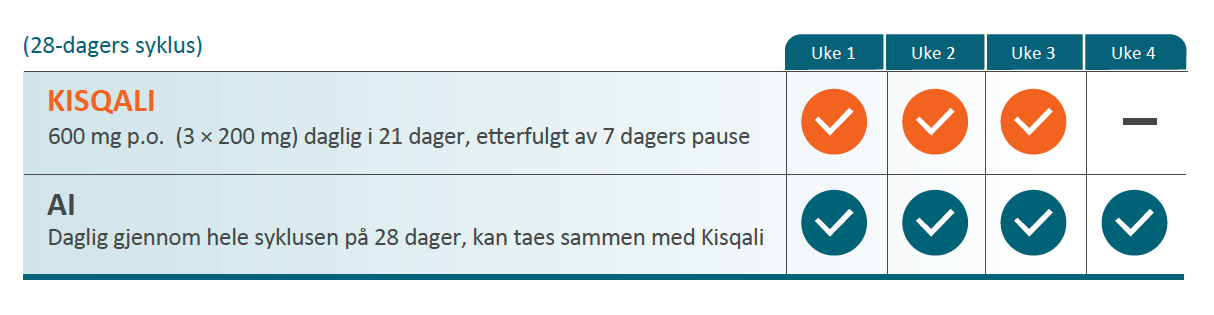
Kisqali i kombinasjon med fulvestrant2
Anbefalt dose er 600 mg (tre tabletter à 200 mg) + fulvestrant som skal administreres intramuskulært dag 1, 15 og 29, deretter en gang i måneden.*
* Se fullstendig SPC for fulvestrant for ytterligere informasjon.
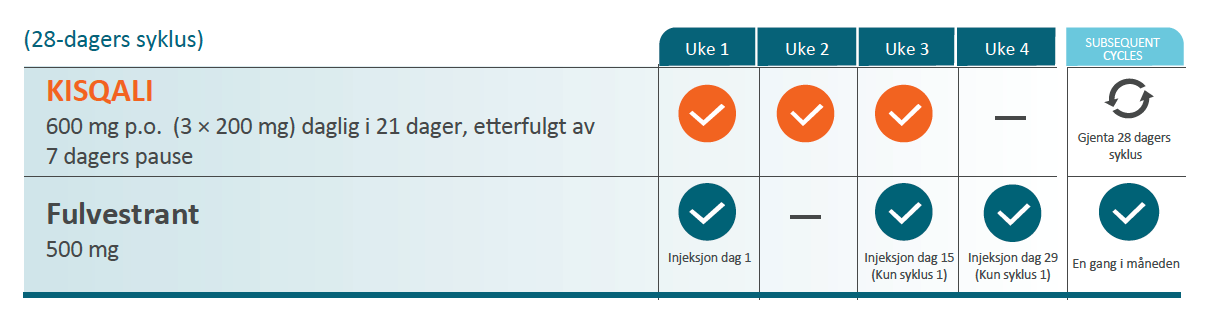
Monitorering med Kisqali2
Pasientene skal følges opp med jevnlige kontroller under behandling med Kisqali, spesielt de første månedene. Dette omfatter blant annet blodprøver for å overvåke benmargens og leverens funksjon. I tillegg skal elektrolyttstatus observeres og det skal utføres to EKG-kontroller i løpet av pasientens første måned. Dette skal gjøres på dag 1 og dag 14 i første syklus, deretter ved behov (se skjema *).
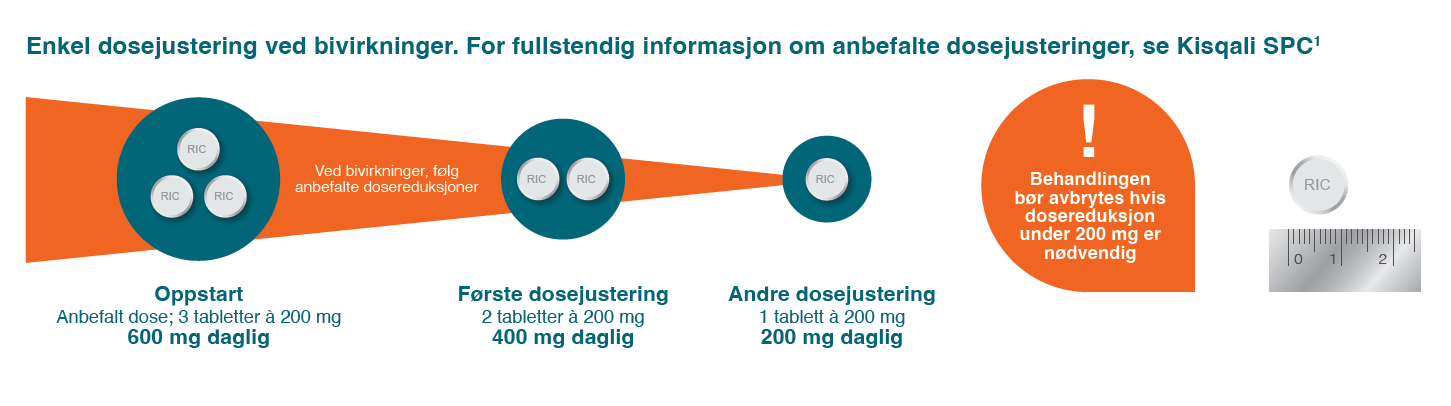
Dosereduksjon2
Effekt og sikkerhet ved bruk av Kisqali
Effekt og sikkerhet ved bruk av Kisqali har blitt studert i tre store fase-3-studier med, til sammen, over 2000 pasienter. Monaleesa studieprogrammet består av tre store randomiserte, dobbeltblindede, placebokontrollerte, klinisk fase III-multisenterstudier. De endelige totaloverlevelse analysene (OS, overall survival) fra de tre fase-3 studiene, viste til en signifikant overlevelsesgevinst.4,5
Kisqali viste gjennom disse studiene at pasienter med metastatisk brystkreft hadde ca ett år lenger overlevelse enn med komparator alene.4,5
Monaleesa-2: førstelinjebehandling til pasienter som ikke hadde fått tidligere behandling for metastatisk sykdom, i kombinasjon med letrozol sammenlignet med letrozol alene.4,5
Monaleesa-3: første- og andrelinjebehandling til pasienter som hadde fått ingen eller kun én linje med tidligere endokrin behandling i kombinasjon med fulvestrant vs. fulvestrant alene.4,5
Monaleesa-7: førstelinjebehandling til pre- og perimenopausale kvinner. Pasientene fikk enten en ikke-steroid aromatasehemmer eller tamoksifen og goserelin vs. placebo i kombinasjon med en ikke-steroid aromatasehemmer eller tamoksifen og goserelin.4,5
Kisqali har har med dette vist en konsistent overlevelsesgevinst for både pre-, peri- og postmenopausale brystkreftpasienter. Kisqali kan benyttes som førstelinjebehandling sammen med valgfri aromatasehemmer eller fulvestrant, eller som andrelinjebehandling sammen med fulvestrant.4,5
Bivirkninger
De vanligste bivirkningene av grad 3/4 var nøytropeni, leukopeni, unormale leverfunksjonstester, lymfopeni, infeksjoner, ryggsmerter, anemi, fatigue, hypofosfatemi og oppkast.2
Referanser:
1. Sykehusinnkjøp HF. Onkologi – Avtaler legemidler [Internett]. Oslo: Sykehusinnkjøp HF; [oppdatert 1.oktober 2025; sitert 7.oktober 2025. Tilgjengelig fra: https://www.sykehusinnkjop.no/avtaler-legemidler/onkologi
2. European Medicine Agency. Preparatomtale (SPC) Kisqali (ribosiklib). Tilgjengelig fra: https://www.ema.europa.eu/no/documents/product-information/kisqali-epar-product-information_no.pdf
3. Helsedirektoratet. Brystkreft – handlingsprogram [Internet]. Oslo: Helsedirektoratet; [sitert 7.oktober 2025]. Tilgjengelig fra: https://www.helsedirektoratet.no/retningslinjer/brystkreft--handlingsprogram
4. Im SA, Lu YS, Bardia A, et al. Overall Survival with Ribociclib plus Endocrine Therapy in Breast Cancer. N Engl J Med. 2019 Jul 25;381(4):307-316. doi: 10.1056/NEJMoa1903765.
5. Slamon D, Lipatov O, Nowecki Z, et al. Ribociclib plus Endocrine Therapy in Early Breast Cancer. N Engl J Med. 2024 Mar 21;390(12):1080-1091. doi: 10.1056/NEJMoa2305488.
Sikkerhetsinformasjon
Dosering:
Tidlig brystkreft: Anbefalt dose 400 mg 1 × daglig i 21 påfølgende dager etterfulgt av 7 dager uten behandling (28-dagers syklus). Behandlingen bør pågå i 3 år eller inntil sykdomstilbakefall eller uakseptabel toksisitet oppstår. Avansert/metastatisk brystkreft: Anbefalt dose 600 mg 1 × daglig i 21 påfølgende dager etterfulgt av 7 dager uten behandling (28-dagers syklus). Behandlingen bør pågå så lenge klinisk nytte vises eller til uakseptabel toksisitet oppstår.1
Dosejustering ved bivirkninger: Håndtering av alvorlige eller ikke tolererbare bivirkninger kan kreve midlertidig behandlingsavbrudd, dosereduksjon eller seponering.1
• Tidlig brystkreft: Startdose 400 mg → reduseres til 200 mg ved behov1
• Avansert/Metastatisk brystkreft: Startdose 600 mg → kan reduseres trinnvis til 400 mg og deretter 200 mg ved behov. Laveste anbefalte dose er 200 mg/døgn. Seponering vurderes ved behov for ytterligere reduksjon.1
Administrering: Tas peroralt til samme tid hver dag, helst om morgenen. Tas med eller uten mat. Unngå grapefrukt og johannesurt (prikkperikum). Skal svelges hele. Skal ikke tygges, knuses eller deles. 1
Kontraindikasjoner: Overfølsomhet for innholdsstoffene, peanøtter eller soya.
Vanligst rapporterte bivirkninger: Tidlig brystkreft: Nøytropeni, infeksjoner, kvalme, hodepine, fatigue, leukopeni og unormale leverfunkskjonstester og for avansert/metastatisk brystkreft: Nøytropeni, infeksjoner, kvalme, fatigue, diarè, leukopeni, oppkast, hodepine, forstoppelse, alopesi, hoste, utslett, ryggsmerter, anemi og unormale leverfunksjonstester.1
Forsiktighetsregler: Levertoksisitet: Leverfunksjonstester skal tas før behandlingsstart, og leverfunksjonen skal overvåkes etter behandlingsstart. QT-forlengelse: EKG ved oppstart og dag 14 i første syklus. Bruk av Kisqali bør unngås ved eksisterende eller signifikant risiko for utvikling av QTc-forlengelse. QT-forlengelse under behandlingen kan føre til behandlingsavbrudd, dosereduksjon eller seponering. Lungesykdom: Vær oppmerksom på tegn til lungebetennelse, da interstitiell lungesykdom/pneumonitt er observert under behandling. CYP3A4: Ribosiklib metaboliseres hovedsakelig av CYP3A4 og dosereduksjoner kan være nødvendig ved interaksjoner med andre legemidler. 1
Pakninger og priser: 21 stk. (blister) kr 17772, 42 stk. (blister) kr 35509, 63 stk. (blister) kr 53246.
Refusjon og vilkår: Refusjon: Reseptgruppe C. H-resept: L01E F02_1. Vilkår (216): Refusjon ytes kun etter resept fra sykehuslege eller avtalespesialist. Rekvirering skal følge nasjonale handlingsprogrammer, faglige retningslinjer og anbefalinger fra RHF/LIS spesialistgruppe.2
Tidlig brystkreft. Godkjent av Beslutningsforum (Sak 123 – 2025, ID2024_026): Til adjuvant behandling av pasienter med hormonreseptor (HR)-positiv, human epidermal vekstfaktorreseptor 2 (HER2)-negativ tidlig brystkreft med høy risiko for tilbakefall. Se SPC pkt. 5.1 for seleksjonskriterier.1
Avansert eller metastatisk brystkreft: Godkjent av Beslutningsforum (Sak ID2017_024, ID2017_024B og ID2019_007): I kombinasjon med aromatasehemmer eller fulvestrant til behandling av kvinner med HR-positiv, HER2-negativ lokalavansert eller metastatisk brystkreft, enten som
• innledende endokrinbasert behandling (førstelinje), eller
• hos kvinner som tidligere har fått endokrin behandling (andrelinje).
Hos pre- eller perimenopausale kvinner skal endokrin behandling kombineres med en LHRH-agonist.
Se felleskatalogen for mer informasjon.
