パンくず

MSの画像診断における課題
多発性硬化症(MS)診断の基本は、脳や脊髄の複数部位における病変の存在(空間的多発性:DIS)と、異なる時点での新規病変出現(時間的多発性:DIT)の証明である。MRI所見は診断の中心的役割を担うが、特異度は限定的であり、特に発症初期には典型的画像所見が欠如する場合が多く、MRI所見単独での確定診断は困難である。また、他の中枢神経疾患も類似のMRI所見を呈する可能性があり、誤診のリスクが存在する。こうした背景から、より高精度な診断と治療方針決定を可能にする新たなバイオマーカーの探索が進められてきた。近年では高特異度のMRIバイオマーカーとしてcentral vein sign(CVS)、paramagnetic rim lesion(PRL)の有用性が認知され、2024年改訂マクドナルド診断基準にも正式に採用された。さらに、日常診療への普及を目指して、撮像技術とAI支援ツールの開発も進められている。
CVSの病理学的背景と撮像原理
MS病変の病理学的特徴として、多くの例で病巣中心部に静脈が認められる。静脈内の脱酸素化血液は常磁性体として機能し、磁場の不均一性に感度の高いT2*強調画像や磁化率強調画像(SWI)によって高コントラストで描出される。また、MSで認められる血管周囲腔の拡大や膠原線維沈着などの血管リモデリングも常磁性効果を増強する1)。中心静脈の標準的な放射線学的定義については、2016年のNorth American Imaging in Multiple Sclerosis(NAIMS) Cooperativeが発表したコンセンサス声明において明確に提示され(図1)、CVSの判定に広く用いられるようになった。特に、3Dエコープラナー法(3D-EPI)は短時間撮像では1~3分、高分析脳撮像では5~6分の短時間で高精度に静脈を三次元描出し、信号強度、位相、SWI、定量磁化率マッピング(QSM)といった複数のコントラスト再構成が可能である2)。FLAIR*画像は、高い白質病変コントラストを持つFLAIR画像と静脈コントラストに優れるT2*画像を位置合わせ後に、ボクセル単位で乗算して組み合わせた画像であり、両者の長所が最大化された画像所見が得られる3)。

CVSの特異度と影響因子
過去20年間の報告に基づくと、CVS陽性病変割合が40~50%以上の場合は、MSと放射線学的に類似所見を示す疾患との鑑別が可能と考えられる。ただし、使用するシーケンサーの種類(3D-EPIの有用性が高い)、ガドリニウム(Gd)造影の有無(静脈描出を増強)、MRI磁場強度(高磁場ほど有利)、脳小血管病など血管性併存症の存在(CVS陰性病変を増加させ、CVS陽性病変の割合が低下)などの因子によって判定が影響を受ける点に注意が必要である。脳小血管病のリスク因子の中で、特に年齢と高血圧はMSにおけるCVS陽性病変割合の低下と関連している4)。
CVSの臨床応用と測定の簡素化
患者によっては40~60個以上の病変が認められることもあり、全病変のCVS評価は時間と労力を要するため、簡素化する手段が検討されている。MRI所見上で、NAIMSの適格基準に基づき少なくとも3個以上の病変が特定され、それらすべてがCVS陽性と判定される3病変ルール(Select 3*)や、同様に6個以上のCVS陽性病変があればCVS陽性とする6病変ルール(Select 6*)が提案され、後者は診断基準の最新版にも正式に組み込まれた。Select 3*およびSelect 6*の特異度は各93%および95%、感度は各97%および89%である5)。
また、CVS陽性を判定するAI支援ツールとしてCVSnetが開発されている。CVSnetは3D畳み込みニューラルネットワーク(3D-CNN)に基づいており、手動で判定された病変を用いて学習し、中心静脈の存在を直接認識する深層学習モデルである。CVSnetの有用性は多施設観察研究で検証されており、従来の血管強調フィルタ法に比べて高精度かつ誤判定が少なく、手動読影の約600倍の速度で判定可能であった6)。
PRLの病理学的背景と撮像原理
MSの慢性活動性病変では、中心部は炎症が沈静化する傾向があるが、辺縁には活性化ミクログリアが持続的に集積し、ミクログリア内の鉄沈着によってコントラストが生じる。PRLは慢性活動性病変に相当し、3D-EPI位相画像やSWIで病変辺縁に連続する黒色の輪状構造として描出される(図2)。
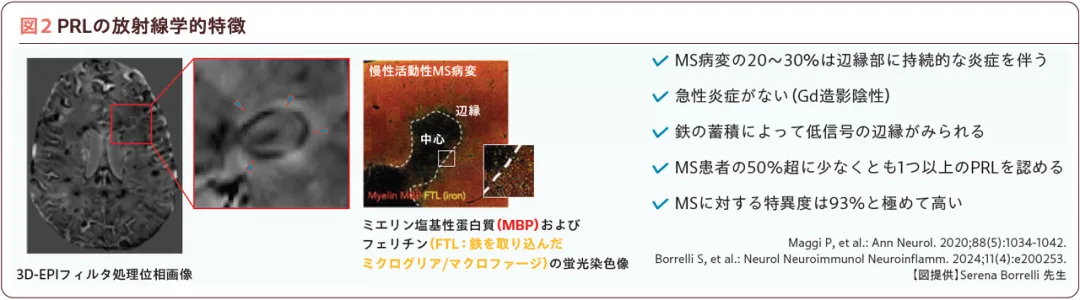
PRLを用いたMSの診断と注意点
2024年のNAIMS Cooperativeによるコンセンサス声明7)では、PRLの診断基準として、1.5テスラ以上のSWIで輪状低信号が病変外縁の2/3以上を占める、2D撮像では連続した2スライス以上、3D撮像では2つの直交面以上の確認が必要、急性病変(Gd造影で増強される病変)は除外、静脈走行部位や磁化率アーチファクトが生じる部位では誤認に注意するなどの項目を提唱している。また、3D撮像では等方性分解能1mm未満、2D撮像ではスライス厚3mm未満の高解像度かつ3テスラ/7テスラMRIが推奨されている。2020年の報告では、MS症例の50%超に1つ以上のPRLが認められ、非MS疾患では稀であり、特異度は93%であった(図2)。一方、感度は低く、単独での診断利用は限定的なことから、診断精度向上のためにはCVSや皮質病変など他のバイオマーカーとの併用が望ましい。PRLについてもAI支援ツールRimNetが開発されている。RimNetはFLAIR画像と位相画像を入力するCNNで、精密なアノテーションデータセット作成を経て学習し、専門医評価と同等以上の感度・特異度、誤判定が少ない堅牢性が確認されている8)。
参考文献
1) Absinta M, et al.: Ann Neurol. 2019;85(6):934-942.
2) Sati P, et al.: Magnetom FLASH 2017;68:26‒32.
3) Sati P, et al.: Radiology. 2012;265(3):926-932.
4) Guisset F, et al.: Mult Scler. 2021;27(7):1057-1065.
5) Borrelli S, et al.: Neurol Neuroimmunol Neuroinflamm. 2024;11(4):e200253.
6) Maggi P, et al.: NMR Biomed. 2020;33(5):e4283.
7) Bagnato F, et al.: Brain. 2024;147(9):2913-2933.
8) Barquero G, et al.: Neuroimage Clin. 2020;28:102412.
ご所属、ご講演内容については2025年7月作成時点のものです
