パンくず

記載されている薬剤の使用にあたっては、電子添文をご参照ください。
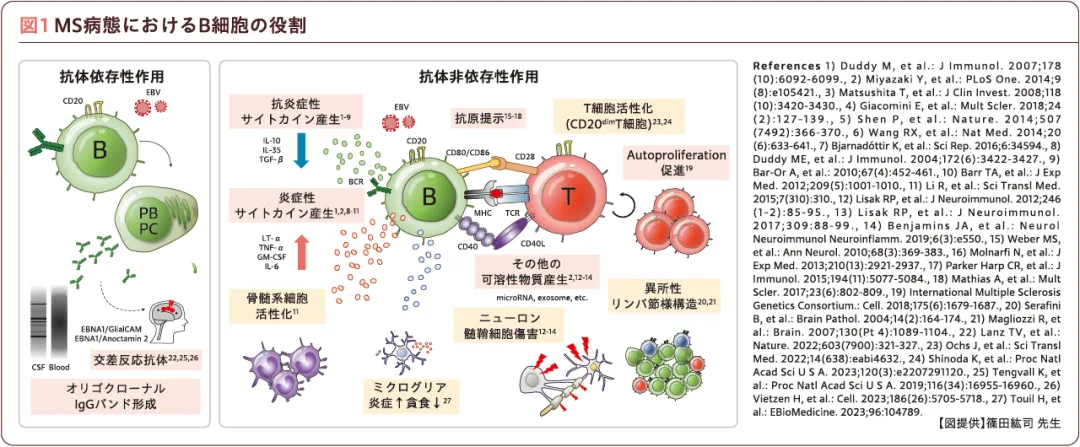
MS病態におけるB細胞の役割
多発性硬化症(MS)は、古典的にはT細胞主体の向炎症性病態と解釈されていたが、MS患者に対する抗CD20抗体薬の第Ⅰ相試験で新規病変が抑制され1)、これを契機にB細胞の役割に関する研究が進展した。B細胞の機能は抗体依存性作用と抗体非依存性作用に大別され、発症後は抗体非依存性作用がより重要となる(図1)。MSでは髄液中に特徴的に出現するオリゴクローナルバンド(OCB)と病態の関連が疑われていたが、現在ではOCBは非特異的な細胞内蛋白に結合する免疫グロブリンと考えられている2)。
MS病態におけるB細胞の抗体依存性作用
Epstein-Barrウイルス(EBV)感染に伴うMS発症リスクの上昇は古くから知られていたが、大規模な米国軍人コホート研究においてEBV感染後にMS発症リスクが32倍に上昇し、EBV感染とMS発症の直接的な因果関係が示された3)。その機序は、EBVのEBNA1蛋白の386~405番アミノ酸と、グリア細胞に発現するGlialCAM蛋白の370~389番アミノ酸の分子相同性に基づいており、形質芽細胞由来の抗EBNA抗体がGlialCAMにも交差反応していた(図1;左)。このEBNA386-405/GlialCAM370-389特異的抗体は、健常者ではNKG2C+NK細胞により除去されるが、MS患者ではこの機構が障害されており、MS発症に至ると考えられる4)。
MS病態におけるB細胞の抗体非依存性作用
抗体非依存性作用の代表はサイトカイン産生異常であり、MS患者におけるエフェクターB細胞による炎症性サイトカイン(TNF-α、GM-CSFなど)の産生亢進や、抗炎症性サイトカイン(IL-10など)の産生抑制、B細胞の可溶性物質産生異常などが相次いで報告されてきた(図1;右)。
最近では、B細胞とT細胞の相互作用で産生されるCD20+T細胞(CD20dimT細胞)も注目されている。CD20dimT細胞はCD4+T細胞よりもCD8+T細胞に多くみられ、中枢神経系に移行しやすい細胞接着因子やケモカイン受容体の発現パターンを示し、Th1/Tc1サイトカイン産生能が高いエフェクターメモリーT細胞が中心である5)。抗CD20抗体療法でCD20dimT細胞群を除去すると、T細胞画分においても細胞の表現型が抗炎症性に変化することが示されている5)。さらに、抗CD20抗体療法に伴う変化として、抗炎症性遺伝子の発現上昇を伴う髄液マクロファージの濃縮、末梢血におけるCD16+単球やCD4+Tregの増加も報告されている6)。
そのほか、活動性が高いMS患者のB細胞における抗原提示に関与するCD40、HLA-DRの発現亢進、T細胞のautoproliferation促進、髄膜の異所性リンパ節様構造の形成などが認められる(図1;右)。異所性リンパ節様構造は進行性病態や皮質病変数と密接に関連し、このリンパ節様構造から炎症が波及して直下の皮質に脱髄が引き起こされる7)。
抗CD20抗体療法の臨床的意義
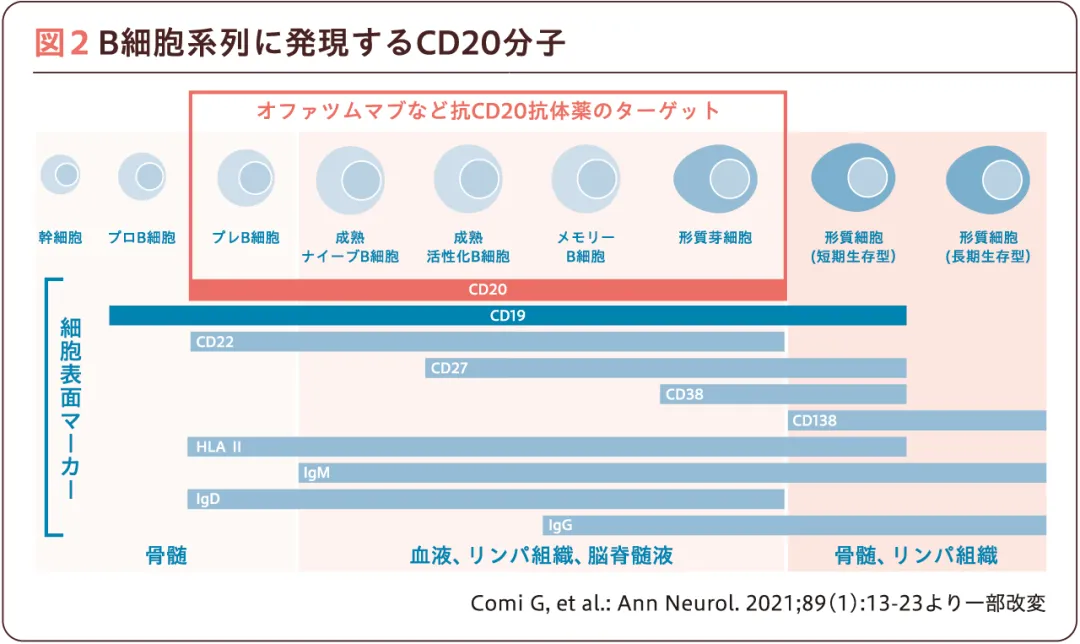
オファツムマブはCD20を特異的に認識する、遺伝子組換えヒト型IgG1κモノクローナル抗体である。CD20はB細胞分化過程においてプレB細胞から形質芽細胞に発現するが、成熟形質細胞には発現していない(図2)。そのため、造血幹細胞および抗体産生に重要な形質細胞を温存しつつ、CD20+B細胞の選択的な除去が可能と考えられている。また、MSではhigh efficacy therapyの早期開始による予後改善が示唆されている8)。各種薬剤の年間再発率のネットワークメタ解析では、オファツムマブは既存のhigh efficacy薬剤と同様の効果を示していることから9)、早期からのオファツムマブ治療による予後改善が期待される。
抗CD20抗体療法による寛解誘導の可能性
従来の疾患修飾療法(DMT)は、その効果を維持するために継続投与が必要であった。これに対して、近年では治療中止後も疾患活動性の安定が持続し得る免疫再構築療法(IRT)が注目されている。50歳以上の非活動性MS患者の大規模試験において抗CD20抗体薬群(本試験で使用されたリツキシマブはMSに対して本邦では適応外、ocrelizumabは本邦未承認)では治療中止後も継続時と同様の再発率で推移していることから10)、免疫再構築の可能性が推察される。IRTの背景となる機能変化として、B細胞サブセットや表面分子発現の変化から、MS活動性を誘導しにくいB細胞集団への再構成が示唆されている5)。疾患活動性と関連の高いCD20dimCD8+T細胞についても、再出現時のエフェクターメモリーT細胞の減少や、IFN-γ/TNF-α産生能の低下が示されている5)。
MS診療の課題
MSにおける障害の進行パターンは、臨床的再発に関連して増悪するrelapse associated worsening(RAW)と、再発とは無関係に増悪するprogression independent of relapse activity(PIRA)に区別され、PIRAの予後は不良である。PIRAに対しては抗CD20抗体薬の効果も限定的であるが、治療中にB細胞の割合や数が多い症例ではPIRAの割合が高いことから、不十分なB細胞除去はPIRAの予測因子となる11)。したがって、確実なB細胞除去が慢性進行病態抑制に重要であると考えられ、さらに有効な治療アプローチを探索する必要がある。
参考文献
1) Bar-Or A, et al.: Ann Neurol. 2008;63(3):395-400.
2) Brändle SM, et al.: Proc Natl Acad Sci U S A. 2016;113(28):7864-7869.
3) Bjornevik K, et al.: Science. 2022;375(6578):296-301.
4) Vietzen H, et al.: Cell. 2023;186(26):5705-5718.e13.
5) Shinoda K, et al.: Proc Natl Acad Sci U S A. 2023;120(3):e2207291120.
6) Wei J, et al.: J Clin Invest. 2025;135(11):e182790.
7) Magliozzi R, et al.: Brain. 2007;130(Pt 4):1089-104.
8) He A, et al.: Lancet Neurol. 2020;19(4):307-316.
9) Samjoo IA, et al.: J Comp Eff Res. 2021;10(6):495-507.
10) Jouvenot G, et al.: JAMA Neurol. 2024;81(5):490-498.
11) Revie L, et al.: Mult Scler. 2025;31(7):813-820.
ご所属、ご講演内容については2025年7月作成時点のものです
