パンくず

記載されている薬剤の使用にあたっては、電子添文をご参照ください。 |
McDonald診断基準の改訂で、より早期にMSの診断が可能に
多発性硬化症(MS)は早期診断・早期治療が極めて重要である。Cobo-Calvoらは最初の脱髄イベント発生日から初回治療開始日までの経過時間が6ヵ月以内の患者(早期治療開始群)、6.1~16ヵ月の患者、16.1ヵ月以降の患者(後期治療開始群)の3群に分け、早期治療開始群と後期治療開始群を比較したところ、Expanded Disability Status Scale(EDSS) 3.0への到達期間、二次性進行型MS(SPMS)へ移行するまでの期間、治療開始から持続的障害進行(SDP)が発現するまでの期間が、早期治療開始群で有意に延長したと報告した(p<0.05、重み付きCox比例ハザードモデル)1)。KapposらはMSの初回発作であるclinically isolated syndrome(CIS)発症直後からインターフェロンベータ(IFNβ)を導入した患者と、CIS発症2年後またはMSと診断されてからIFNβを導入した患者を11年間経過観察した結果、CIS発症直後からのIFNβ導入が障害進行抑制に寄与することを示した2)。これらの結果から、MSに対していかに早く治療するかが大事であることが示唆される。
MSの国際的な診断基準であるMcDonald診断基準は2001年に提唱されてから、これまで2005年、2010年、2017年に改訂されている。かつてはCISとしか診断できなかった症例が2017年改訂のMcDonald診断基準の導入により、より早期の段階でMSと診断可能となった。これにより、初回発作時から疾患修飾療法(DMT)などの早期治療開始を積極的に検討できるようになった3)。早期治療の重要性に関するエビデンスが構築されたことにより、McDonald診断基準はより診断感度を高め、より早期にMSを診断できるよう変遷を遂げている。
予後不良因子などを考慮し、early high efficacy therapyを開始すべきか検討を
「多発性硬化症・視神経脊髄炎スペクトラム障害診療ガイドライン2023」では、CQ1として「再発寛解型MS(RRMS)患者の診断早期にナタリズマブないしオファツムマブで治療を開始するのは推奨されるか?」が提示されている。これに対して、「診断早期に再発頻度やMRI活動が高い、さらにはEDSSが高い、脳萎縮が強いなどのRRMS患者においては、ナタリズマブないしオファツムマブで治療を開始することを推奨する(条件付き)」との記載があり、推奨の強さは「2 弱い」、エビデンスの確実性は「C 弱い」とされている。また、注記として「予後不良因子、進行性多巣性白質脳症(PML)の発症リスク、患者の生活背景や価値観などを十分勘案する」ことが求められている4)。
無効や効果不十分と判断された場合に、より高い治療効果が期待できる薬剤に切り替える“escalation therapy”と、有効性の高い疾患修飾薬(DMD)から開始する“early high efficacy therapy”のどちらを選択すべきか、有用性を検討するRCTが進行中であるが、未だ結論はでていない。early high efficacy therapyを開始する上で参考の1つになるものが予後不良因子である(表1)5)。予後不良因子は多々あるが、なかでもT2病巣が多い、Gd造影病変がある、再発頻度が高い、オリゴクローナルバンド陽性に注目し、個々の症例に応じて優先順位をつけ、early high efficacy therapyを開始すべきか判断していかなければならないと考えている。

さらなるinitial high efficacy therapyが求められている
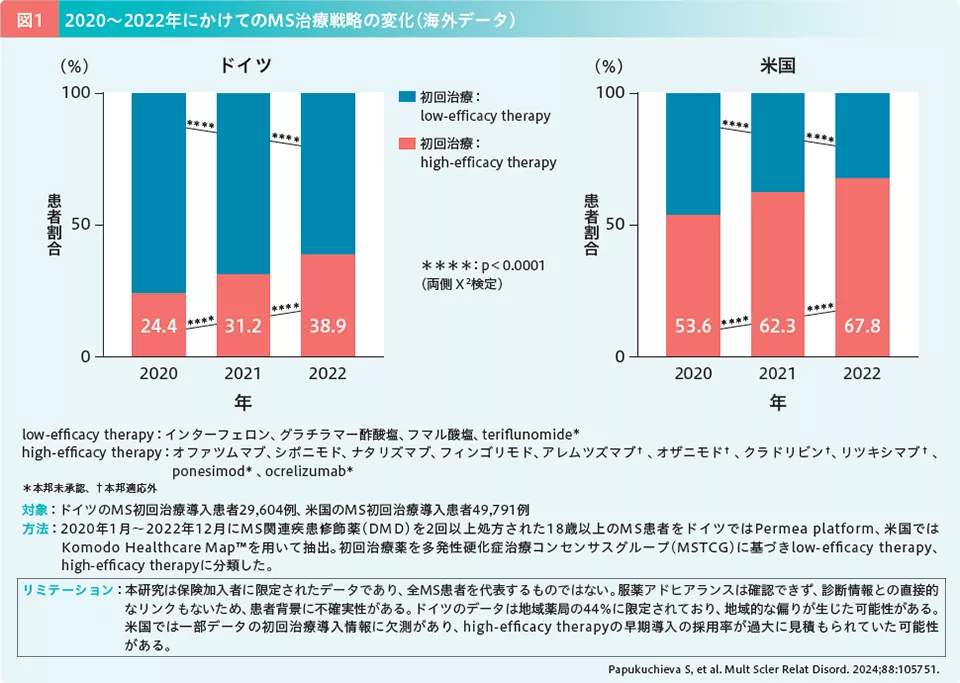
MSBaseおよびスウェーデンMSレジストリを用いたレトロスペクティブ解析では、ナタリズマブなどのhigh efficacy DMD(本邦未承認薬を含む)を発症から2年未満に導入した群(早期導入群)と、発症から4~6年後に導入した群(後期導入群)を比較した。その結果、導入が遅れるほど障害進行抑制が困難になることが示された6)。このエビデンスを裏付けるかのように、米国では初回治療からhigh efficacy therapyを選択する割合(initial high efficacy therapy)が2020年には53.6%、2022年には67.8%へと増加しており、ドイツでも同様の傾向がみられ、early high efficacy therapy / initial high efficacy therapyが主流になりつつあることが示唆されている(図1)7)。
early high efficacy therapy/ initial high efficacy therapyの治療効果に言及した論文は多数報告されているが、安全性プロファイルについては、Pipekらによるメタ解析により、従来の漸増的治療と同様であることが報告されている8)。さらに、米国のレトロスペクティブコホート研究では、moderate-efficacy DMDと比較して、high-efficacy DMDでは重篤な感染症[調整HR:1.24、95%信頼区間(CI):1.06-1.44]および尿路感染症(調整HR:1.21、95% CI:1.14-1.30)のリスクが上昇することが示された9)。
患者の希望を把握し、満足度の高い治療を目指す
現在、MS治療において日本で使用可能なDMDは8種類ある。治療選択肢の拡大は喜ばしいものの、どのDMDを選択したらよいか、明確なアルゴリズムはない。DMDを選択する上で、薬剤それぞれの有効性や安全性、アドヒアランス、患者の年齢や生活背景、併存疾患、疾患活動性、予後不良因子を考慮するが、病状経過の多様性、不確実性を伴うMSに対しては最善の選択が一律ではないなどから、shared decision making(SDM)が求められている。
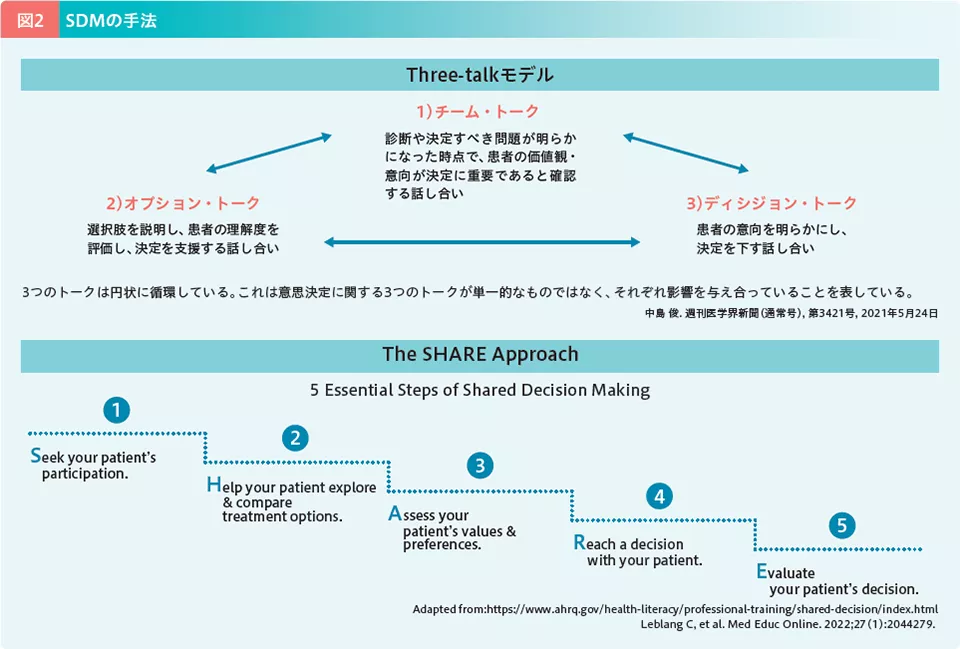
SDMにはThree-talkモデル10)やSHAREアプローチ11)といった具体的な手法がある(図2)。Three-talkモデルでは、問題の共有から始まり、選択肢の提示、そして意思決定支援という3段階を踏む。一方、SHAREアプローチでは、患者の治療参加促進(S)、治療選択の支援(H)、価値観・意向の確認(A)、合意形成(R)、意思決定の評価(E)という5つの段階が示されている。いずれも患者の価値観・意向を尊重し、医療者と協働して意思決定を行うことが重視されている。
SDMとは一方的に情報を提供して患者に選択を委ねるのではなく、患者の仕事、結婚、妊娠・出産の予定や希望、家族構成などを伺い、患者の価値観・意向を把握し、患者にとってどの治療薬がベストか提案する。ときには行動科学的アプローチ(ナッジ:nudge、直訳すると「肘で軽くつつく」を意味し、個人の選択を妨げることなく、望ましい行動を促す手法)をして、陰ながらサポートしつつ患者と協力しながら治療を進めていくことで、満足度かつアドヒアランスの高い治療を目指していければと思っている。
1)Cobo-Calvo A, et al. Neurology. 2023;101(13):e1280-e1292.
2)Kappos L, et al. Neurology. 2016;87(10):978-987.
3)Sorensen PS, et al. Brain. 2020;143(9):2637-2652.
4)日本神経学会監修. 多発性硬化症・視神経脊髄炎スペクトラム障害診療ガイドライン2023. 医学書院, 2023, p.114.
5)Rotstein D, et al. Nat Rev Neurol. 2019;15(5):287-300.
6)He A, et al. Lancet Neurol. 2020;19(4):307-316.
7)Papukuchieva S, et al. Mult Scler Relat Disord. 2024;88:105751.
8)Pipek LZ, et al. Mult Scler Relat Disord. 2023;71:104581.
9)Li J, et al. Clin Pharmacol Ther. 2025;117(2):561-569.
10)中島 俊. 週刊医学界新聞(通常号), 第3421号, 2021年5月24日
11)Leblang C, et al. Med Educ Online. 2022;27(1):2044279.
ご所属、ご講演内容については2025年9月作成時点のものです
