クロザリル FAQ
製品FAQは医療に従事する先生方からよくご質問いただく内容をまとめたものです。記載している情報はあくまで参考情報としてお取り扱いいただき、医療上のご判断は医療従事者の裁量と責任のもとに行っていただきますようお願い致します。
製品のご使用にあたっては、最新の電子化された添付文書(電子添文)をご確認ください。製品に関してご不明な点がございましたら、弊社お問い合わせ窓口にお問い合わせください。
1.特定の背景を有する患者
クロザリルを腎機能障害患者へ投与してもいいですか?
クロザリルの投与により腎機能が低下するおそれがあるので、重度の腎機能障害のある患者には禁忌となります。軽度から中等度の腎機能障害のある患者においては、慎重に投与する必要があります1)。
腎機能障害を伴う患者を対象としたクロザリルの薬物動態や有効性、安全性は検討しておらず2)、腎機能障害を伴う患者への投与方法は定まっていません。
(参考)
1) クロザリル電子添文 2.12、9.2
2) クロザリル申請資料概要 2.7.2 臨床薬理の概要 3.6.5腎臓機能障害
クロザリルを透析患者へ投与してもいいですか?
電子添文上、透析患者への投与に関する規定はございませんが、腎機能障害患者への投与に関する注意喚起があります1)。
クロザリル電子添文
2.禁忌(次の患者には投与しないこと)
2.12 重度の腎機能障害のある患者[腎機能が悪化するおそれがある。]
9.2 腎機能障害患者
9.2.1 重度の腎機能障害がある患者
投与しないこと。
9.2.2 軽度から中等度の腎機能障害のある患者
腎機能障害が悪化するおそれがある。
透析により腎機能が回復する可能性がある場合には、腎機能の程度や患者の状態に配慮の上、最終的には医師のご判断で決定してください。
(参考)
1) クロザリル電子添文 2.12、9.2
2.効能又は効果
反応性不良の基準の考え方を教えてください
2種類以上の抗精神病薬を十分な期間、十分な量投与したにもかかわらず、十分な改善を示さない場合、反応性不良と考えます1), 2)。
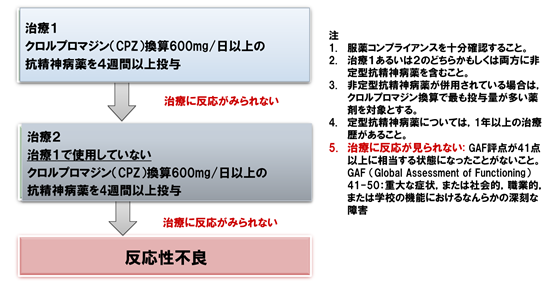
クロザピン(クロザリル)適正使用ガイダンスより一部改変
(参考)
1) クロザリル電子添文 5.1.1
2) クロザピン(クロザリル)適正使用ガイダンス(作成日:2023年12月14日)
https://www.clozaril-tekisei.jp/materials
抗精神病薬のクロルプロマジン換算値の確認方法を教えてください
クロザピン(クロザリル)適正使用ガイダンス1)の抗精神病薬の等価換算表-稲垣・稲田2017年版-2)で確認できます。
この等価換算表から算出した場合、クロルプロマジン600 mg換算量は以下の通りです。
非定型抗精神病薬(mg) | レボメプロマジン | 600 | |
アリピプラゾール | 24 | モサプラミン | 198 |
アセナピン | 15 | ネモナプリド | 27 |
ブロナンセリン | 24 | オキシペルチン | 480 |
クロザピン | 300 | ペルフェナジン | 60 |
オランザピン | 15 | ピモジド | 24 |
パリペリドン | 9 | ピパンペロン | 1,200 |
ペロスピロン | 48 | プロクロルペラジン | 90 |
クエチアピン | 396 | プロペリシアジン | 120 |
リスペリドン | 6 | レセルピン | 0.9 |
定型抗精神病薬(mg) | スピペロン | 6 | |
ブロムペリドール | 12 | スルピリド | 1,200 |
クロルプロマジン | 600 | スルトプリド | 1,200 |
クロカプラミン | 240 | チアプリド | 600 |
フルフェナジン | 12 | チミペロン | 7.8 |
ハロペリドール | 12 | ゾテピン | 396 |
稲垣中,稲田俊也:臨床精神薬理 20(1):89-97, 2017 より改変
(注:元の表より2017年4月現在販売されていない薬剤は削除した)
(参考)
1) クロザピン(クロザリル)適正使用ガイダンス(作成日:2023年12月14日)
https://www.clozaril-tekisei.jp/materials
2) 稲垣中,稲田俊也:臨床精神薬理 20(1):89-97, 2017
3.用法及び用量
クロザリルを飲み忘れた場合の対処方法を教えてください
クロザリルの服用を忘れてしまった場合、気がついたときにできるだけ早く飲んでください。ただし、次の通常飲む時間が近い場合は、忘れた分は飲まないで1回分を飛ばしてください。
絶対に2回分を一度に飲まないでください。
(参考)
クロザリルくすりのしおり
クロザリルを休薬後に、どのように再開すればよいでしょうか?
休薬が2日以上の場合は、治療開始時と同様に低用量から漸増してください。
(参考)
クロザリル電子添文 7.5
クロザリルの有効血中濃度の目安はありますか?
電子添文では、血中濃度の目安に関して規定はございません。
海外で出版されているガイドラインでは、血中濃度モニタリングは治療の最適化に有用であり、トラフ値を350-500 μg/Lに調節し、「治療域」の上限は定められていませんが、600-800 μg/L前後が提案されています1)。
(参考)
1) モーズレイ処方ガイドライン 第14版 Chapter11 薬物動態p729-757 (2022)
クロザリル開始後、定常状態に達するまでの期間は?
クロザリル投与後の血中濃度が安定するには、投与量が安定してから5〜7日と考えられています1)。
(参考)
1) Schulte P. et al.:Clin Pharmacokinet. 2003;42(7):607-18
4.安全性
クロザリルによる無顆粒球症(血球減少)の発現頻度と対処方法を教えてください
【発現頻度】
無顆粒球症発現頻度は特定使用成績調査の最終集計で、1.13%(21/1860例)です1)。
【対処方法】
無顆粒球症が発現した場合はCPMS 規定に従い、中止基準の白血球数・好中球数を認めた場合は、本剤の投与を中止し、血液内科医等との連携の上、対処してください2)。
詳細は以下のサイトより「クロザピン(クロザリル)適正使用ガイダンス」や「クロザピン(クロザリル)による好中球減少症/無顆粒球症対処マニュアル」をご覧ください。
クロザリル適正使用委員会 クロザリルに関する各種資材・様式
https://www.clozaril-tekisei.jp/materials
(参考)
1) クロザリル特定使用成績調査 (CLEX123J1401,治療抵抗性統合失調症)の 最終集計結果(再審査終了)作成日 2019年12月25日
https://www.pro.novartis.com/jp-ja/products/clozaril/document
2) クロザピン(クロザリル)適正使用ガイダンス(作成日:2023年12月14日)
https://www.clozaril-tekisei.jp/materials
クロザリルによる心筋炎、心筋症の頻度、症例、発現機序を教えてください
【発現頻度】
心筋炎、心筋症は国内臨床試験では認められていないため、クロザリル電子添文では頻度不明としています1)。
国内臨床試験77例において、心膜炎が1例(1.3%)、心嚢液貯留が4例(5.2%)に認められています2)。
国内市販後の特定使用成績調査では、1,860例中心筋炎が2例(0.11%)、心筋症が2例(0.11%)、心膜炎が1例(0.05%)、心嚢液貯留が3例(0.16%)に認められています3)。
【症例】
国内市販後に認められた心筋炎、心筋症は、医療関係者向けサイトに症例一覧が公開されています。
https://www.pro.novartis.com/jp-ja/products/clozaril/safety/02
【発現機序】
クロザリル投与による心筋炎・心筋症の発症メカニズムは明らかになっておりません。
(参考)
1) クロザリル電子添文 11.1.2
2) クロザピン(クロザリル)適正使用ガイダンス(作成日:2023年12月14日)
https://www.clozaril-tekisei.jp/materials
3) クロザリル特定使用成績調査 (CLEX123J1401,治療抵抗性統合失調症)の 最終集計結果(再審査終了)作成日 2019年12月25日
https://www.pro.novartis.com/jp-ja/products/clozaril/document
クロザリルによる痙攣の発現頻度と対処方法を教えてください
【発現頻度】
国内開発時の臨床試験では77例中てんかん発作が1例(1.3%)、痙攣が2例(2.6%)、ミオクローヌス発作が1例(1.3%)認められていました1)。
特定使用成績調査の最終集計で、痙攣発作の発現頻度は6.45%(120/1860例)でした2), 3)。
痙攣発作の副作用の発現までの日数は中央値 112.0 日でした。
発現症例のうち回復又は軽快に至った症例は副作用発現症例の 94.17%(113/120 例)、
未回復で経過観察終了となった症例は 5.00% (6/120 例)、
後遺症あり若しくは死亡に至った症例はありませんでした。
なお、回復又は軽快の転帰までの日数は中央値 3.5日でした3)。
【対処方法】
クロザリルは用量依存的に痙攣閾値低下をもたらすことから、クロザリルを減量または中止し、抗痙攣剤を投与するなど適切な対応を行ってください1)。
(参考)
1) クロザリル電子添文 11.1.6
2) クロザリル特定使用成績調査 (CLEX123J1401,治療抵抗性統合失調症)の 最終集計結果(再審査終了)作成日 2019年12月25日
https://www.pro.novartis.com/jp-ja/products/clozaril/document
3) 鳥山和宏ら:臨床精神薬理 22(11) 1107-1139, 2019
クロザリルによる鎮静の発現頻度と対処方法を教えてください
【発現頻度】
特定使用成績調査の最終集計における鎮静の発現頻度は、7.37%(137/1860例)でした1), 2)。
【対処方法】
慎重に経過を観察していただきながら、クロザリルの休薬や減量をご検討ください3)。
海外で出版されているガイドラインでは、朝の用量を少なくする、朝の目覚めに問題がある場合は夜の服用時間を早くする、可能であればクロザリルを減量する、と提案されています4)。
(参考)
1) クロザリル特定使用成績調査 (CLEX123J1401,治療抵抗性統合失調症)の 最終集計結果(再審査終了)作成日 2019年12月25日
https://www.pro.novartis.com/jp-ja/products/clozaril/document
2) 鳥山和宏ら:臨床精神薬理 22(11) 1107-1139, 2019
3) クロザピン(クロザリル)適正使用ガイダンス(作成日:2023年12月14日)
https://www.clozaril-tekisei.jp/materials
4) モーズレイ処方ガイドライン第14版 日本語版 Chapter 1 クロザピンの副作用 p189-218, 2022
5.製剤
クロザリルは粉砕して投与してもいいですか?
クロザリルを粉砕して投与することは、承認外の用法となります。粉砕投与した際の有効性、安全性、薬物動態は確立していませんので、弊社からは推奨していません。
クロザリル錠100 mgについては粉砕後の安定性データがありますので、以下までお問い合わせください。
製品についてのお問い合わせ(ノバルティスダイレクト)
電話番号: 0120-003-293 (通話料無料)
受付時間:月~金 9:00~17:30 (祝日及び弊社休日を除く)
電話がご利用いただけない場合は、医療関係者の方専用 お問い合わせフォームをご利用ください。
クロザリルは簡易懸濁法で投与してもいいですか?
クロザリル錠を懸濁して投与することは、承認外の用法となります。懸濁投与した際の有効性、安全性、薬物動態は確立していませんので、弊社からは推奨していません。
また、簡易懸濁法における安定性やチューブの通過性のデータはありません。
クロザリルを経管投与してもいいですか?
クロザリル錠を経管投与することは、承認外の用法となります。また、経管投与した際の有効性、安全性、薬物動態は確立していませんので、弊社からは推奨していません。
なお、チューブ通過性のデータはありません。
クロザリルを一包化してもいいですか?
クロザリル錠を一包化して安定性を検討したデータはありません。
また、PTP包装から取り出し無包装状態で放置すると光により退色する1)ことがあるため、PTP包装から取り出した錠剤はなるべく速やかに使用してください2)。
退色が認められたものは使用しないでください。
(参考)
1) クロザリルインタビューフォーム IV-6
2) クロザリル電子添文 20
6.その他
保険薬局のCPMS登録手順を教えてください
クロザリルの院外処方箋を応需する保険薬局は、CPMS(クロザリル患者モニタリングサービス)登録が必要です1)。
保険薬局のCPMS登録までの流れや必要書類の様式は、クロザリル適正使用委員会ホームページをご参照ください。通常、登録完了まで1か月~1.5か月程度かかります。
クロザリル適正使用委員会 新規登録/Web講習
https://www.clozaril-tekisei.jp/clozaril-course
(参考)
1) CPMS運用手順 5.2.3 保険薬局および所属する薬剤師のCPMS登録
https://www.clozaril-tekisei.jp/operation-procedure
クロザリルの処方可能日数を教えてください
クロザリルの処方可能な日数は次回の血液検査実施日までです。
具体的には、クロザリルの投与期間と血液検査結果によって、次回検査日までの7日(1週間)以内、14日(2週間)以内もしくは28日(4週間)以内の日数になります。
しかし、条件を満たしたうえで事前に申請することにより、検査日変更(血液検査期限+1日)することが可能です1)2)。
詳細は条件や手順に関しては、CPMSセンターホームページ1)をご確認ください。
(参考)
1) CPMSセンターホームページ CPMS検査日変更
https://www.cpms.novartis.co.jp/interval_top
2) クロザリル適正使用委員会 FAQ Q29.
https://www.clozaril-tekisei.jp/faq
クロザリルは医療機関または薬局との間で譲渡・譲受していいですか?
クロザリルの譲渡・譲受はできません。
いかなる医療機関および保険薬局との間でも譲渡・譲受しないでください。
(参考)
CPMS運用手順 6.本剤の流通管理
https://www.clozaril-tekisei.jp/materials
薬食審査発第0422001号「クロザピン製剤の使用にあたっての留意事項について」(平成21年4月22日付厚生労働省医薬食品局審査管理課長通知)
eCPMSのログイン法や入力方法の問い合わせ先を教えてください
eCPMSの操作・入力方法、血液・血糖モニタリングの実施基準などに関するお問い合わせは、CPMSセンターにお問い合わせください。
TEL :0120-977-327(9:00~17:45土・日、祝日、弊社休日を除く)
FAX :03-6257-3624
お電話をご利用いただけない場合はCPMSセンターお問い合わせフォームからお問い合わせください
また、CPMSセンターホームページのeCPMS FAQもご参照いただけます。
https://www.cpms.novartis.co.jp/faq
