Učinkovitost
Pravodobno liječenje može spriječiti napredovanje gnojnog hidradenitisa do nepovratnog oštećenja kože. Lijek Cosentyx brzo i učinkovito prekida bolni upalni ciklus te dokazano smanjuje bol, učestalost
relapsa i nastanak novih drenirajućih tunela. Osim toga, kvaliteta života oboljelih od HS-a, mjerena DLQI indeksom,kontinuirano se poboljšava.#1,2
Brza i održana učinkovitost uz lijek Cosentyx1
Brzo i dugotrajno poboljšanje apscesa i upalnih čvorova (AN50)1
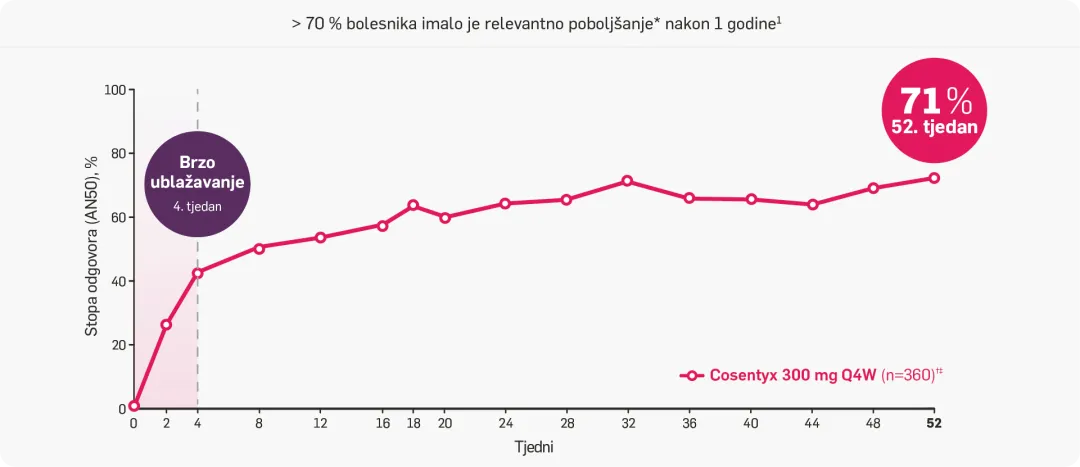
> 70 % bolesnika postiglo je AN50 nakon 1 godine liječenja1
Napomena:
U programu kliničkih ispitivanja SUNNY, na početku ispitivanja su bolesnici bili randomizirani na lijek Cosentyx 300 mg ili placebo i dobili udarne doze ispitivanog lijeka svakog tjedna tijekom 5 tjedana, nakon čega je uslijedio režim svaka 2 ili svaka 4 tjedna. U 16. tjednu bolesnici koji su bili randomizirani na placebo bili su prebačeni na tjedne doze lijeka Cosentyx 300 mg od 16. do 20. tjedna, a nakon toga na lijek Cosentyx svaka 2 ili svaka 4 tjedna.
*AN50, unaprijed određena evaluacijska mjera ishoda, definira se kao smanjenje za ≥ 50 % u broju apscesa i upalnih čvorova u odnosu na početne vrijednosti.1
†Objedinjeni podaci iz programa kliničkih ispitivanja SUNNY (Cosentyx 300 mg Q4W).1
‡Rezultati opaženi u bolesnika koji su primali lijek Cosentyx 300 mg Q4W tijekom 52 tjedna. U terapijskoj skupini Q4W (n=360), 330 bolesnika moglo je biti ocijenjeno nakon 16 tjedana, a 255 je moglo biti ocijenjeno nakon 52 tjedna.1
Održan učinak i nakon 1 godine liječenja: smanjenje boli, pogoršanja bolesti i nastanka novih tunela1

trajno ublažavanje boli1*
bez reaktivacije bolesti1#

bez razvijanja drenirajućih sinusnih kanala, čak i ako su ih imali na početku ispitivanja1$
Napomene:
Rezultati opaženi u bolesnika koji su primali lijek Cosentyx 300 mg Q4W (n=360) tijekom 52 tjedna. U pogledu reaktivacije bolesti, unaprijed određene evaluacijske mjere ishoda, 278 bolesnika moglo je biti ocijenjeno nakon 52 tjedna. Za sinusne kanale, koji su jedan od elemenata unaprijed određene primarne mjere ishoda, analizirani su podaci od 142 bolesnika bez drenirajućih sinusnih kanala na početku ispitivanja i 218 bolesnika s najmanje 1 drenirajućim sinusnim kanalom na početku ispitivanja.1 U programu kliničkih ispitivanja SUNNY, na početku su bolesnici bili randomizirani na lijek Cosentyx 300 mg ili placebo te dobivali udarne doze svog ispitivanog lijeka svaki tjedan tijekom 5 tjedana, nakon čega je uslijedio režim svaka 2 ili svaka 4 tjedna. U 16. tjednu bolesnici koji su bili randomizirani na placebo bili su prebačeni na tjedne doze lijeka Cosentyx 300 mg od 16. do 20. tjedna, a nakon toga na lijek Cosentyx svaka 2 ili svaka 4 tjedna.1
*Ublažavanje boli mjereno je odgovorom NRS30, smanjenjem kožne boli prema procjeni bolesnika za ≥ 30 % i smanjenjem za najmanje 2 jedinice u odnosu na početnu vrijednost. Smanjenje boli, unaprijed određena mjera sekundarnog ishoda, bilo je definirano kao postizanje odgovora NRS30 u pogledu kožne boli povezane s HS-om među bolesnicima koji su na početku imali NRS ≥ 3. Bez boli ili blaga bol: NRS ≤ 6; umjerena ili teška bol: NRS > 6.1
#Reaktivacija bolesti definira se kao povećanje broja AN-a za najmanje 25% uz minimalno povećanje od 2 u apsolutnom broju AN-a u odnosu na početne vrijednosti.1
$Sinusni kanali, određeni su kao mjera primarnog ishoda, nazivaju se i fistule ili tunelima ispod kože, definiraju se kao izdignuti, bolni, longitudinalni kanali različitih dužina i dubina i fluktuirajućeg sadržaja, koji su povezani s površinom kože i imaju gnojni iscjedak.
Održan HiSCR tijekom 52 tjedna liječenja (objedinjena analiza)1
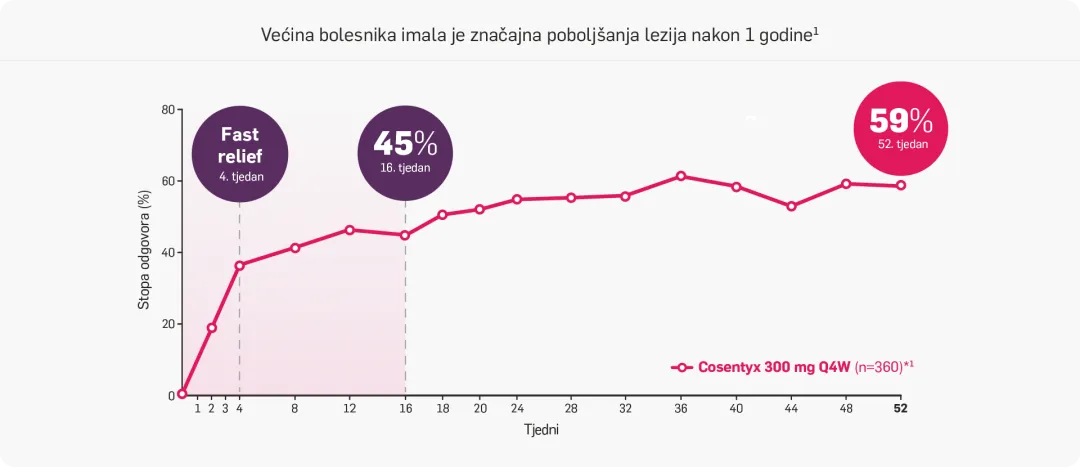
SEKQ2W je pokazao statistički značajnu superiornost u odnosu na placebo skupinu za HiSCR u oba ispitivanja, a SEKQ4W samo u ispitivanju SUNRISE u 16. tjednu.
Poboljšane stope HiSCR-a primijećene su u 16. tjednu u skupinama liječenim lijekom Cosentyx u usporedbi s placebom i održane su do 52. tjedna,bez obzira na prethodnu izloženost biološkim lijekovima. Brzo poboljšanje također je primijećeno u bolesnika koji su prešli s placeba u 16. tjednu te su postigli HiSCR do 52. tjedna.
Brzo i održano smanjenje boli (NRS30)1


Brojčano veći udio bolesnika liječenih lijekom Cosentyx postigao je smanjenje boli u 16. tjednu u odnosu na placebo. U 16. tjednu, postotak bolesnika s ublažavanjem boli tijekom liječenja lijekom Cosentyx Q4W bio je brojčano veći od placeba (33,5% u odnosu na 23%, nije značajno). Postignuto smanjenje boli održano je do 52. tjedna. Od 16. tjedna bol u skupini koja je primala placebo dodatno se smanjila kada su prešli na liječenje lijekom Cosentyx.
Napomene:
Ublažavanje boli mjereno je odgovorom NRS30, smanjenjem kožne boli prema procjeni bolesnika za ≥ 30 % i smanjenjem za najmanje 2 jedinice u odnosu na početnu vrijednost. Smanjenje boli, unaprijed određena mjera sekundarnog ishoda, bilo je definirano kao postizanje odgovora NRS30 u pogledu kožne boli povezane s HS-om među bolesnicima koji su na početku imali NRS ≥ 3. Bez boli ili blaga bol: NRS ≤ 6; umjerena ili teška bol: NRS > 6.1
Na početku ispitivanja, bolesnici su randomizirani u skupinu koja je primala 300 mg lijeka Cosentyx ili placeba i primali su udarne doze ispitivanog lijeka svaki tjedan tijekom 5 tjedana, nakon čega je uslijedio dvotjedni (n=361) ili četverotjedni (n=360) režim. U 16. tjednu, bolesnici randomizirani na placebo preraspoređeni su u skupinu koja je primala tjedne doze od 300 mg lijeka Cosentyx od 16. do 20. tjedna, nakon čega je slijedio Cosentyx jednom svaka dva ili jednom svaka četiri tjedna.1
Održano poboljšanje kvalitete života do 1 godine (DLQI)1


Napomene:
Poboljšanje kvalitete života, unaprijed određena mjera ishoda do 52. tjedna, definirala se je kao smanjenje DLQI rezultata za ≥ 5 bodova u odnosu na početnu vrijednost. Ta mjera uključuje domene svakodnevnih aktivnosti, slobodnog vremena, osobnih odnosa, simptoma i osjećaja, terapije te posla/škole.12
Brojčano više bolesnika liječenih lijekom Cosentyx postiglo je DLQI odgovor u usporedbi s placebom u 16. tjednu. Stope DLQI odgovora od 16. tjedna održane su do 52. tjedna. Od 16. tjedna kvaliteta života u skupini koja je primala placebo poboljšala se kada su prešli na liječenje lijekom Cosentyx.
Na početku ispitivanja, bolesnici su randomizirani u skupinu koja je primala 300 mg lijeka Cosentyx ili placeba i primali su udarne doze ispitivanog lijeka svaki tjedan tijekom 5 tjedana, nakon čega je uslijedio dvotjedni (n=361) ili četverotjedni (n=360) režim. U 16. tjednu, bolesnici randomizirani na placebo preraspoređeni su u skupinu koja je primala tjedne doze od 300 mg lijeka Cosentyx od 16. do 20. tjedna, nakon čega je slijedio Cosentyx jednom svaka dva ili jednom svaka četiri tjedna.1
Kratice:
AN, apscesi i upalni čvorovi (noduli); DLQI, dermatološki indeks kvalitete života; HiSCR50, smanjenje početnog broja AN-a za ≥ 50 % – bez povećanja broja apscesa i drenirajućih sinusnih kanala; HS, gnojni hidradenitis; NRS, brojčana ocjenska skala; SEQ2W, sekukinumab svaka 2 tjedna; SEQ4W, sekukinumab svaka 4 tjedna.
Literatura:
1. Kimball AB, Jemec GBE, Alavi A, et al. Secukinumab in moderate-to-severe hidradenitis suppurativa (SUNSHINE and SUNRISE): week 16 and week 52 results of two identical, multicentre, randomised, placebo-controlled, double-blind phase 3 trials. Lancet 2023; 401: 747-761.
2. Finlay AY et al. Dermatology Life Quality Index (DLQI) – a simple practical measure for routine clinical use. Clin Exp Dermatol 1994 May; 19(3): 210-6.3
prosinac 2025. | FA-11475175-1

