パンくず
CL-304試験
4)Ⅰ又はⅡ型と考えられるSMA患者を対象とした国際共同第Ⅲ相試験
〔CL-304試験:SPR1NT〕(日本人症例を含む)
| 承認時参考資料である、I又はII型SMA 患者を対象とした国際共同第III相試験(CL-304)が完了し、論文発表されたため、本項ではSMN2遺伝子2コピーのSMA 未発症治療例の最終結果を紹介する |
4-1)第Ⅲ相SPR1NT試験:SMN2遺伝子2コピーで臨床所見が発現していないがSMA I型発症リスクのある患者に対するオナセムノゲンアベパルボベクの治療(日本人症例を含む)1)
1)Strauss KA, et al. Nat Med. 2022.; 28(7): 1381-1389
COI:本試験は、Novartis Gene Therapiesの資金により行われた。著者にNovartis Gene Therapiesの社員及びNovartis/Novartis Gene Therapiesより謝礼/コンサルタント料/助成金を受領している者が含まれる。
1. 試験概要
目 的
臨床所見を発現していないが遺伝学的検査により発症が予測されるSMN2遺伝子2コピーのSMA患者に対するゾルゲンスマの有効性及び安全性の検討
対 象
SMN1遺伝子の両アレル変異を有し、SMN2遺伝子のコピー数が2で、臨床所見が発現しておらず、抗AAV9抗体を有さず、遺伝学的検査により発症が予測されるSMA患者
【主な選択基準】
単回投与時に生後6週間(42日目)以下;腓骨神経CMAPが2mV以上;在胎週数が35~42週;SMN2遺伝子のコピー数が2(コホート2は2コピーであり、3コピーの結果については次セクション参照)
【主な除外基準】
スクリーニング来院時の体重が2kg未満;低酸素血症が認められる;SMAを強く示唆する臨床徴候又は症状が認められると判断される;抗AAV9抗体の力価が1:50を超える
試験デザイン
第Ⅲ相、多施設共同、国際共同、非盲検、単群、単回投与試験
方 法
ゾルゲンスマ1.1×1014vg/kgを約60分をかけて静脈内に単回投与した。AAVを用いた遺伝子補充療法に対する患者の免疫反応を減弱させる目的で、プレドニゾロンをゾルゲンスマ投与24時間前から投与48時間後まで1mg/kg/日(2019年5月のプロトコル改訂後は2mg/kg/日)、その後少なくとも30日目まで1mg/kg/日の予防投与を行った。※1ゾルゲンスマ投与の1日前にベースラインを計測し、投与後18ヵ月齢時まで追跡調査した。

※1:ゾルゲンスマ投与30日後、γ-グルタミルトランスフェラーゼ(GGT)値、アラニンアミノトランスフェラーゼ(ALT)値、アスパラギン酸アミノトランスフェラーゼ(AST)値が基準値上限(ULN)の2倍未満の患者の場合、プレドニゾロンの用量を次の投与ガイドラインに従って漸減することができる:ゾルゲンスマ投与後の5週時と6週時に1mg/kg/日から0.5mg/kg/日へと漸減し、7週時と8週時に0.25mg/kg/日に漸減し、9週時にプレドニゾロンを中止する。GGT値、AST値又はALT値がULNの2倍超の場合は、GGT値、AST値及びALT値がULNの2倍未満に低下するまで、プレドニゾロンの用量(1mg/kg/日)を維持する。2倍未満に低下した時点で漸減を継続してもよい
安全性評価項目
有害事象及び重篤な有害事象の発現割合、臨床検査値のベースラインからの変化量
主要な有効性評価項目
18ヵ月齢時までの「30秒以上支えなしで座る」の運動マイルストーンを達成した患者の割合
副次的な有効性評価項目
14ヵ月齢時における永続的な呼吸補助※2を必要とせずに生存した患者の割合
18ヵ月齢時までに、非経口又は機械的栄養補助を必要とせずに体重を3パーセンタイル以上に維持した患者の割合
探索的評価項目
18ヵ月齢時までのいずれかの来院時に示された、WHO-MGRS基準※3で評価した運動マイルストーンの達成
18ヵ月齢時までのCHOP-INTENDスコア58点以上を達成した患者の割合
18ヵ月齢時までのBayleyスケール(第3版)の微細運動スコア及び粗大運動スコアで、15点以上改善した患者の割合等
※ 2 :永続的な呼吸補助は、14日以上連続して16時間/日以上の呼吸補助(非侵襲的な呼吸補助を含み、可逆的な急性疾患及び周術期の呼吸補助を除く)を必要とする状態、と定義した
※ 3 :「10秒以上支えなしで立つ」「自力で歩行する」など
判定基準

解析計画
解析はコホート別に行う。試験全体の有意水準はそれぞれのコホートで保つようにする
主要評価項目は、18ヵ月齢時までの「30秒以上支えなしで座る」の運動マイルストーンを達成した患者の割合である。患者コホートのうち運動マイルストーンを達成した患者の割合を片側正確二項検定を用い、α=0.025で検定する。p<0.025の場合に統計的有意な結果とみなし、その場合にのみ副次的評価項目の検定を行う。副次的評価項目は、14ヵ月齢時における永続的な呼吸補助を必要とせずに生存した患者の割合であり、患者コホート(SMNコピー数2の患者)と対照コホート(ヒストリカルデータPNCR※4)の間で2標本両側Fisher’s正確検定を用い、α=0.05で検定し、p<0.05の場合に限り、統計的有意な結果とみなす。この副次的評価項目で有意だった場合に限り、次の副次的評価項目である18ヵ月齢時までに、非経口又は機械的栄養補助を必要とせずに体重を3パーセンタイル以上に維持した患者の割合を検定する。片側正確二項検定を用い、α=0.025で検定し、帰無仮説が棄却された場合に限り、統計的有意とみなす。この階層的アプローチにより第一種過誤から保護する。
解析対象集団

ITT:Intent-to-Treat
※ 4 :SMA患者を対象にした大規模な自然観察試験であるPediatric Neuromuscular Clinical Research Network(PNCR)試験から抽出した患者データ
2. 試験登録状況
新生児44例がスクリーニングされ、うち14例※1が除外された
【主な除外理由】
- スクリーニング時点におけるSMA発症を示唆する臨床所見の発現(4例※2)
- ベースライン時の腓骨神経のCMAPが2mV未満(4例)
- 抗AAV9抗体価の高値(2例)
SPR1NT試験参加者30例のうちSMN2遺伝子が2コピーと同定された患者は14例であり、ゾルゲンスマで治療された
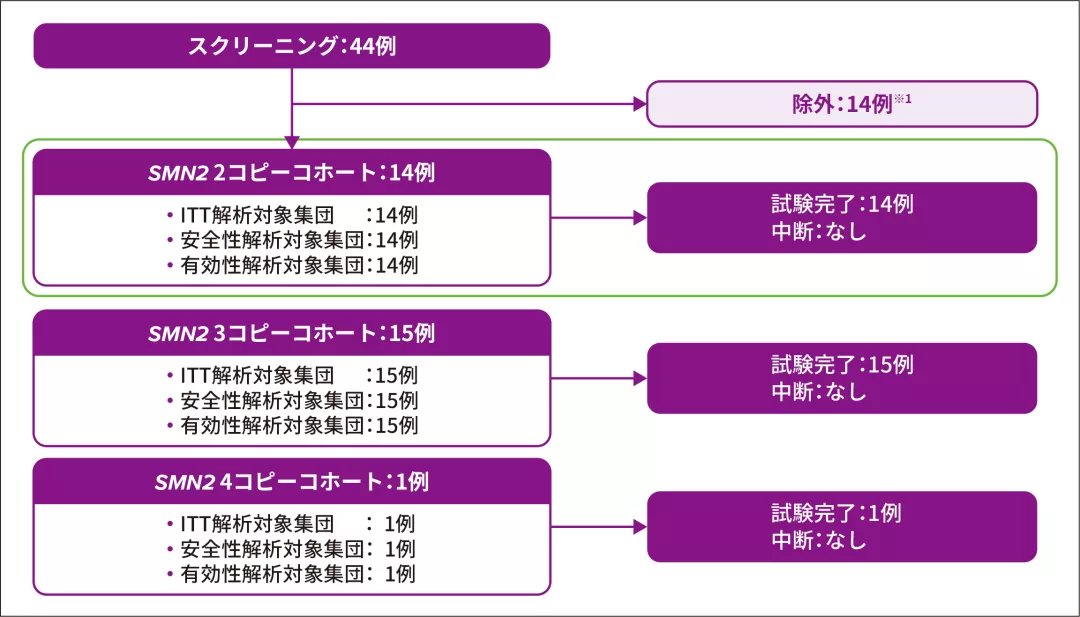
CMAP:複合筋活動電位、ITT:Intent-to-Treat
※ 1 :図のいずれのコホートからも除外された症例
※ 2 :2例は2種類の除外基準に該当していた(いずれもスクリーニング時点でSMAの臨床所見を呈しており、1例は嚥下障害、もう1例は腓骨神経のCMAPが2 mV未満であった)
患者背景 ITT
- 14例の参加者のベースライン時※3の日齢は8~34日(中央値 21)であった。うち5例は出生前診断、9例は新生児スクリーニングによりSMN1遺伝子の両アレルの欠損・SMN2遺伝子2コピーであることが検出された
- ベースライン時の体重は3.0~4.3kg(中央値 3.7)であった
- ベースライン時のCHOP-INTENDスコアは28~57点(中央値 49)、腓骨神経のCMAPは2.1~6.1mV(中央値3.9)であった
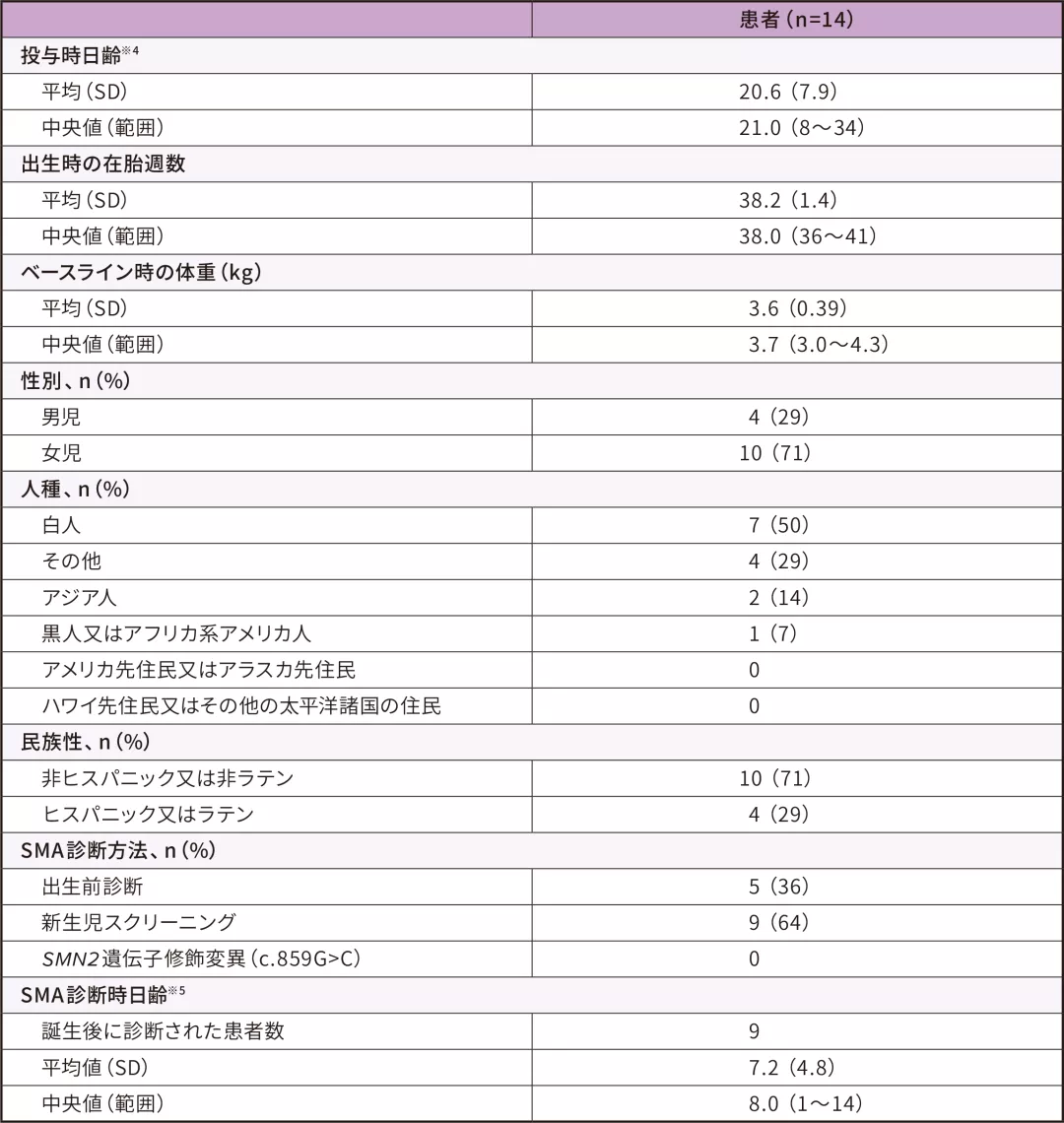
ITT:Intent-to-Treat
※ 3 :ゾルゲンスマ投与日の前日
※ 4 :投与時日齢=投与日ー誕生日+1
※ 5 :SMA診断時日齢=SMA診断日ー誕生日+1、誕生後にSMAと診断された患者について算出した
3. 有効性
(1)運動マイルストーンを達成した患者の割合
ITT 主要評価項目 探索的評価項目
- Bayleyスケール(第3版)では、全例(14/14)で、主要評価項目である、18ヵ月齢時までの「30秒以上支えなしで座る」の運動マイルストーンを達成した。PNCR自然経過集団※1(23例)には本項目を達成した患者はいなかった(p<0.0001※2、外部集団との比較による参考p値)
- WHO-MGRSの尺度で「10秒以上支えなしで立つ」ならびに「自力で歩行する」を達成した患者の割合はいずれも71%(10/14)であった
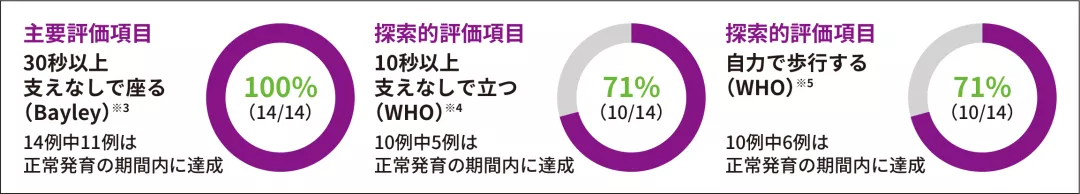
※ 1 :SMA患者を対象にした大規模な自然観察試験であるPediatric Neuromuscular Clinical Research Network(PNCR)試験から抽出した患者データ
※ 2 :片側正確二項検定(有意水準2.5%)
※ 3 :Bayleyスケール(第3版)運動領域 粗大運動マイルストーン#26。WHO-MGRSにおける正常発育の「支えなし座る」の達成期間(1~99パーセンタイル)は、3.8~9.2ヵ月である
※ 4 :WHO-MGRSによる「10秒以上支えなしで立つ」の運動マイルストーン。WHO-MGRSにおける正常発育の「支えなしで立つ」の達成期間(1~99パーセンタイル)は、6.9~16.9ヵ月である
※ 5 :WHO-MGRSによる「自力で歩行する」の運動マイルストーン。WHO-MGRSにおける正常発育の「自力で歩行する」の達成期間(1~99パーセンタイル)は、8.2~17.6ヵ月である
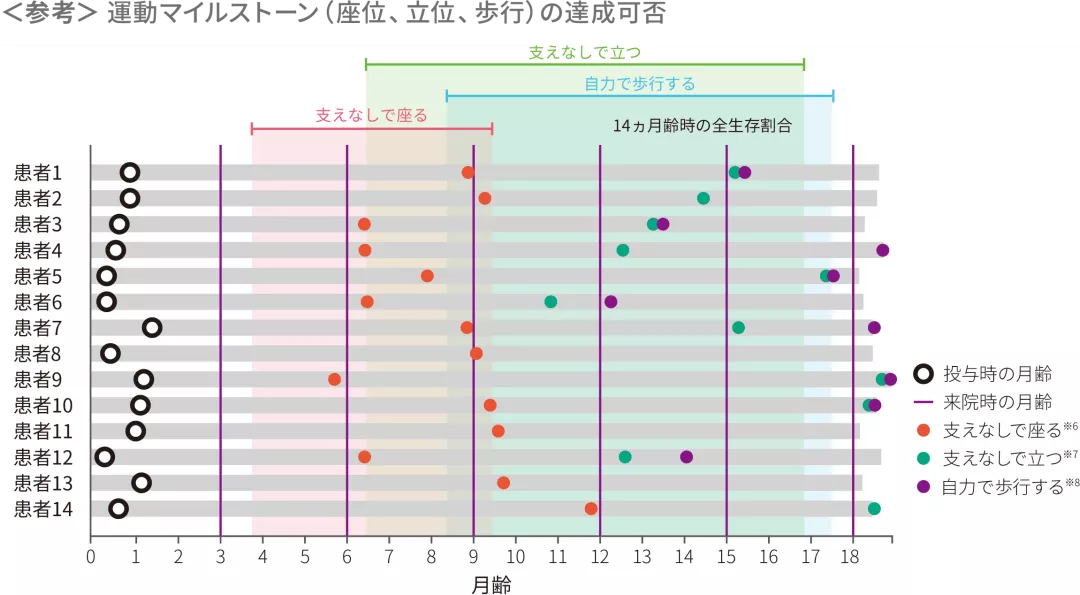
各運動マイルストーンに関して初めて達成した時点を示した達成月は日齢/30で算出した。塗りつぶしはWHO-MGRSにおける正常発育の各運動マイルストーンの達成期間を示す
※ 6 :30秒以上支えなしで座る〔Bayleyスケール(第3版)運動領域 粗大運動マイルストーン#26〕
※ 7 :支えなしで立つ(同#40)
※ 8 :自力で歩行する(同#43)
(2)永続的な呼吸補助を必要とせずに生存した患者の割合
ITT 副次評価項目
- 全例(14/14)が試験終了時まで生存した。
- 全例(14/14)が14ヵ月齢時に永続的な呼吸補助※1を必要とせず、その状態を試験終了時まで維持でき、PNCR自然経過集団※2(6/23)との有意差を認めた(p<0.0001※3、多重性調整あり)。なお、全例(14/14)が試験期間を通じて機械的な呼吸補助を必要としなかった

永続的な呼吸補助なしに生存した患者の割合
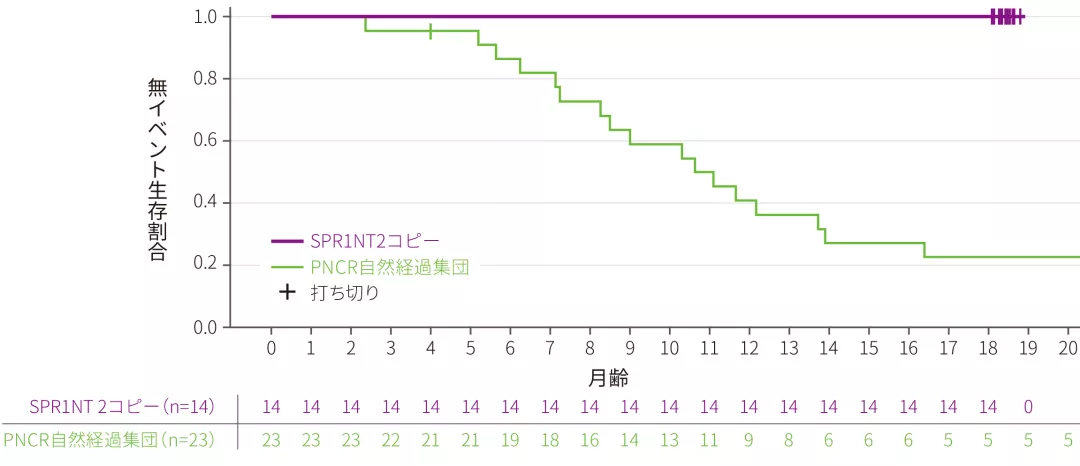
※ 1 :永続的な呼吸補助は、14日以上連続して16時間/日以上の呼吸補助(非侵襲的な呼吸補助を含み、可逆的な急性疾患及び周術期の呼吸補助を除く)を必要とする状態、と定義した
※ 2 :SMA患者を対象にした大規模な自然観察試験であるPediatric Neuromuscular Clinical Research Network(PNCR)試験から抽出した患者データ
※ 3 :Fisher’s正確検定(有意水準 両側5%)
(3)非経口又は機械的栄養補助を必要とせずに体重を3パーセンタイル以上維持した患者の割合
ITT 副次評価項目
- 93%(13/14)が18ヵ月齢時まで非経口又は機械的栄養補助を必要とせずにWHOが定める性別・年齢別体重を3パーセンタイル以上に維持でき、PNCR自然経過集団※1との有意差を認めた(p<0.0001※2、多重性調整あり)。なお、全例(14/14)が非経口又は機械的栄養補助を必要としなかった
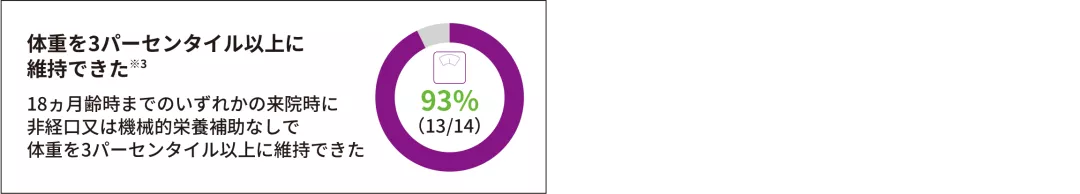
※ 1 :SMA患者を対象にした大規模な自然観察試験であるPediatric Neuromuscular Clinical Research Network(PNCR)試験から抽出した患者データ
※ 2 :片側正確二項検定(有意水準 2.5%)
※ 3 :ベースライン時に全例は低濃度液体の摂取が可能であった
(4)微細運動スコア及び粗大運動スコアで15点以上改善した患者の割合
ITT 探索的評価項目
- 全例(14/14)において、18ヵ月齢時までにベースライン時点から15点以上の粗大運動スコア、微細運動スコアの伸びを示した〔Bayleyスケール(第3版)〕
- 64%(9/14)の患者は正常発育と同レベル(図中グレー部分、2SD)の粗大運動スコアの伸びを示した
Bayleyスケールのベースラインからの変化
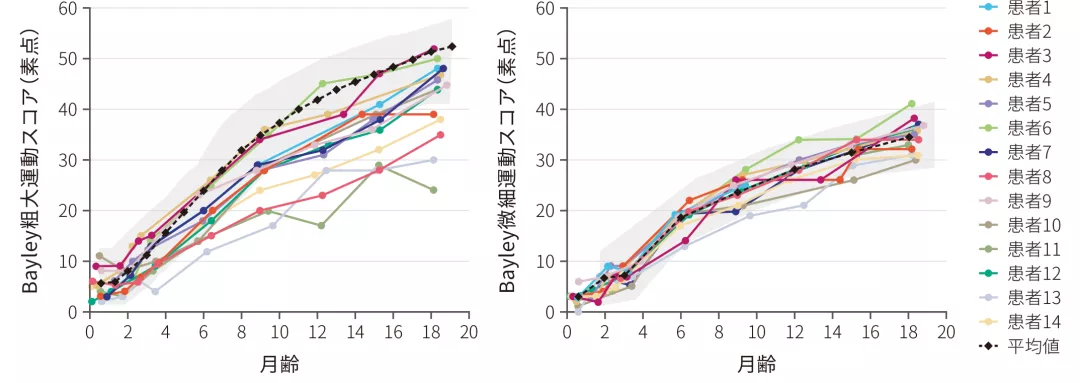
(5)CHOP-INTENDスコア58点以上を達成した患者の割合
ITT 探索的評価項目
- 全例(14/14)がCHOP-INTENDスコア※158点以上をゾルゲンスマ投与後18ヵ月以内に達成した。NeuroNEXT自然経過観察試験※2のSMN2遺伝子2コピーのコホートとの間に有意差が認められた(p<0.0001※3、多重性調整なし)

CHOP-INTENDスコアのベースラインからの変化
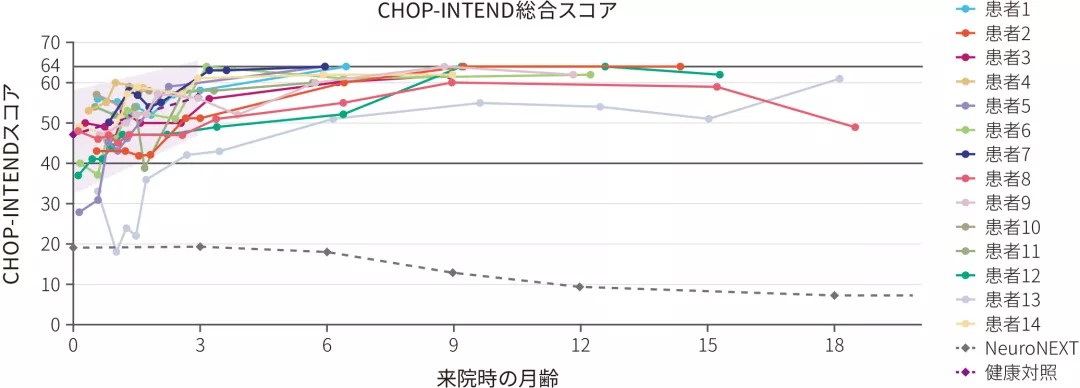
※ 1 :CHOP-INTENDスコアは64点満点である。なお、未治療Ⅰ型SMA患者がCHOP-INTENDスコア40点以上を達成することはない
※ 2 :NeuroNEXTとは、多施設共同前向き長期的な自然経過観察試験である。生後6ヵ月以下のSMA乳児患者26例(及び健康な対照乳児27例)が登録され、Test of Infant Motor Performance Screening Items (TIMPSI)やCHOP-INTENDで評価された
※ 3 :片側正確二項検定(有意水準2.5%)
4. 安全性
安全性解析対象集団 安全性評価項目
- いずれの肝毒性もゾルゲンスマとの因果関係が否定されず、軽度又は中等度、無症候性であり、軽快した
- 血小板減少症は軽度であり、介入なしで軽快した
- 心臓有害事象は軽度又は中等度で、無症候性であり、軽快した
- 反射消失(2例)と反射減弱(1例)は後根神経節障害に関連する有害事象として分類された
-いずれも軽度であり、ゾルゲンスマとの因果関係が否定された
-2例は軽快し、1例(反射消失)は試験終了時まで持続した - 血栓性微小血管症イベントは認められなかった
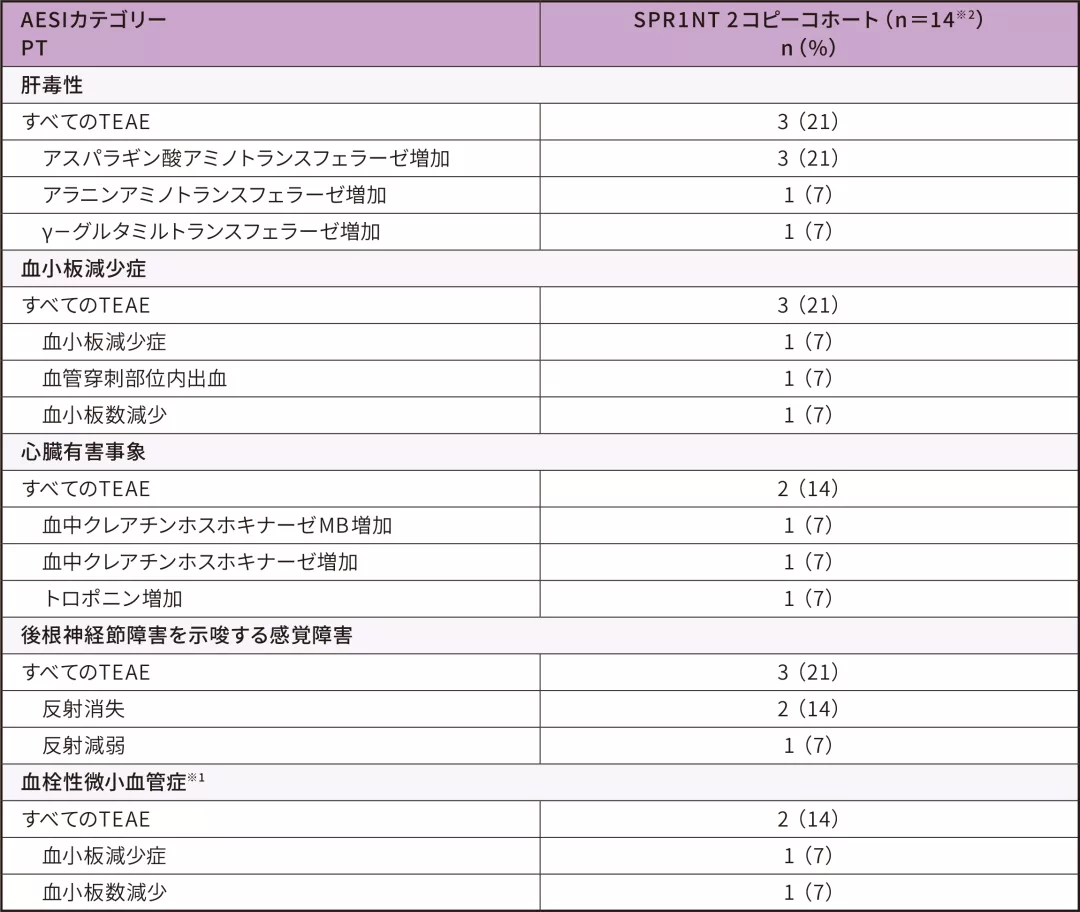
AESI:特に注目すべき有害事象、PT:事象、TEAE:治験薬投与後に発現した有害事象
※ 1 :カテゴリーとしての血栓性微小血管症で、血小板減少症、血小板数減少も含まれる
※ 2 :安全性解析対象集団は男児4例、女児10例であった。投与時日齢の平均値(SD)は20.6(7.9)であった
| 本品の電子添文では、「3. 不具合・副作用(1)重大な副作用」として、「1)肝機能障害、肝不全、2)血小板減少症、3)血栓性微小血管症」が設定され注意喚起が求められております。 |
| 承認時参考資料である、I又はII型SMA患者を対象とした国際共同第III相試験(CL-304)が完了し、論文発表されたため、本項ではSMN2遺伝子3コピーのSMA未発症治療例の最終結果を紹介する |
4-2)第Ⅲ相SPR1NT試験:SMN2遺伝子3コピーで臨床所見が発現していないがSMA発症リスクのある患者に対するオナセムノゲン アベパルボベクの治療(日本人症例を含む)2)
2)Strauss KA, et al. Nat Med. 2022.; 28(7): 1390-1397
COI:本試験は、Novartis Gene Therapiesの資金により行われた。著者にNovartis Gene Therapiesの社員及びNovartis/Novartis Gene Therapiesより謝礼/コンサルタント料/助成金を受領している者が含まれる。
1. 試験概要
目 的
臨床所見を発現していないが遺伝学的検査により発症が予測されるSMN2遺伝子3コピーのSMA患者に対するゾルゲンスマの有効性及び安全性の検討
対 象
SMN1遺伝子の両アレル変異を有し、SMN2遺伝子のコピー数が3で、臨床所見が発現しておらず、抗AAV9抗体を有さず、遺伝学的検査により発症が予測されるSMA患者
【主な選択基準】
単回投与時に生後6週間(42日目)以下;腓骨神経CMAPが2mV以上;在胎週数が35~42週;SMN2遺伝子のコピー数が3(コホート1は2コピーであり、2コピーの結果については前セクション参照)
【主な除外基準】
スクリーニング来院時の体重が2kg未満;低酸素血症が認められる;SMAを強く示唆する臨床徴候又は症状が認められると判断される;抗AAV9抗体の力価が1:50を超える
試験デザイン
第Ⅲ相、多施設共同、国際共同、非盲検、単群、単回投与試験
方 法
ゾルゲンスマ1.1×1014vg/kgを約60分かけて静脈内に単回投与した。AAVを用いた遺伝子補充療法に対する患者の免疫反応を減弱させる目的で、プレドニゾロンをゾルゲンスマ投与24時間前から投与48時間後まで1 mg/kg/日(2019年5月のプロトコル改訂後は2mg/kg/日)、その後少なくとも30日目まで1mg/kg/日の予防投与を行った。※1ゾルゲンスマ投与の1日前にベースラインを計測し、投与後24ヵ月齢時まで追跡調査した。

※ 1 :ゾルゲンスマ投与30日後、γ-グルタミルトランスフェラーゼ(GGT)値、アラニンアミノトランスフェラーゼ(ALT)値、アスパラギン酸アミノトランスフェラーゼ(AST)値が基準値上限(ULN)の2倍未満の患者の場合、プレドニゾロンの用量を次の投与ガイドラインに従って漸減することができる:ゾルゲンスマ投与後の5週時と6週時に1mg/kg/日から0.5mg/kg/日へと漸減し、7週時と8週時に0.25mg/kg/日に漸減し、9週時にプレドニゾロンを中止する。GGT値、AST値又はALT値がULNの2倍超の場合は、GGT値、AST値及びALT値がULNの2倍未満に低下するまで、プレドニゾロンの用量(1mg/kg/日)を維持する。2倍未満に低下した時点で漸減を継続してもよい
安全性評価項目
有害事象及び重篤な有害事象の発現割合、臨床検査値のベースラインからの変化量
主要な有効性評価項目
24ヵ月齢時までの「3秒以上支えなしで立つ」の運動マイルストーンを達成した患者の割合
副次的な有効性評価項目
24ヵ月齢時までに、「筋肉運動の協調とバランスを示しながら、5歩以上自力で歩行する」能力を達成した患者の割合
探索的評価項目
14ヵ月齢時における永続的な呼吸補助※2を必要とせずに生存した患者の割合
24ヵ月齢時までに、非経口又は機械的栄養補助を必要とせずに体重を3パーセンタイル以上に維持した患者の割合
24ヵ月齢時までのBayleyスケール(第3版)の微細運動スコア及び粗大運動スコアのベースラインからの変化等
※ 2 :永続的な呼吸補助は、14日以上連続して16時間/日以上の呼吸補助(非侵襲的な呼吸補助を含み、可逆的な急性疾患及び周術期の呼吸補助を除く)を必要とする状態、と定義した
判定基準

解析計画
解析はコホート別に行う。試験全体の有意水準はそれぞれのコホートで保つようにする
主要評価変数は24ヵ月齢時までに「3秒以上支えなしで立つ」の運動マイルストーンの達成割合である。患者コホート(SMNコピー数3の患者)と対照コホート(ヒストリカルデータPNCR※3)間で2標本両側Fisher’s正確検定を用い、α=0.05で比較し、p<0.05の場合は統計的に有意な結果とみなす。副次的評価変数は、24ヵ月齢時までに「筋肉運動の協調とバランスを示しながら、5歩以上自力で歩行する」能力を達成した患者の割合である。患者コホートと対照コホートを2標本両側Fisher’s正確検定を用い、α=0.05で比較する。主要評価項目が統計的に有意だった場合に限り、副次的評価項目の仮説検定で統計的に有意になる可能性を評価する。このように検定を階層的に実施することで、第一種過誤から保護する
解析対象集団

ITT:Intent-to-Treat
※ 3 :SMA患者を対象にした大規模な自然観察試験であるPediatric Neuromuscular Clinical Research Network(PNCR)試験から抽出した患者データ
2. 試験登録状況
新生児44例がスクリーニングされ、うち14例※1が除外された
【主な除外理由】
- スクリーニング時点におけるSMA発症を示唆する臨床所見の発現(4例※2)
- ベースライン時の腓骨神経のCMAPが2mV未満(4例)
- 抗AAV9抗体価の高値(2例)
SPR1NT試験参加者30例のうちSMN2遺伝子が3コピーと同定された患者は15例であり、ゾルゲンスマで治療された
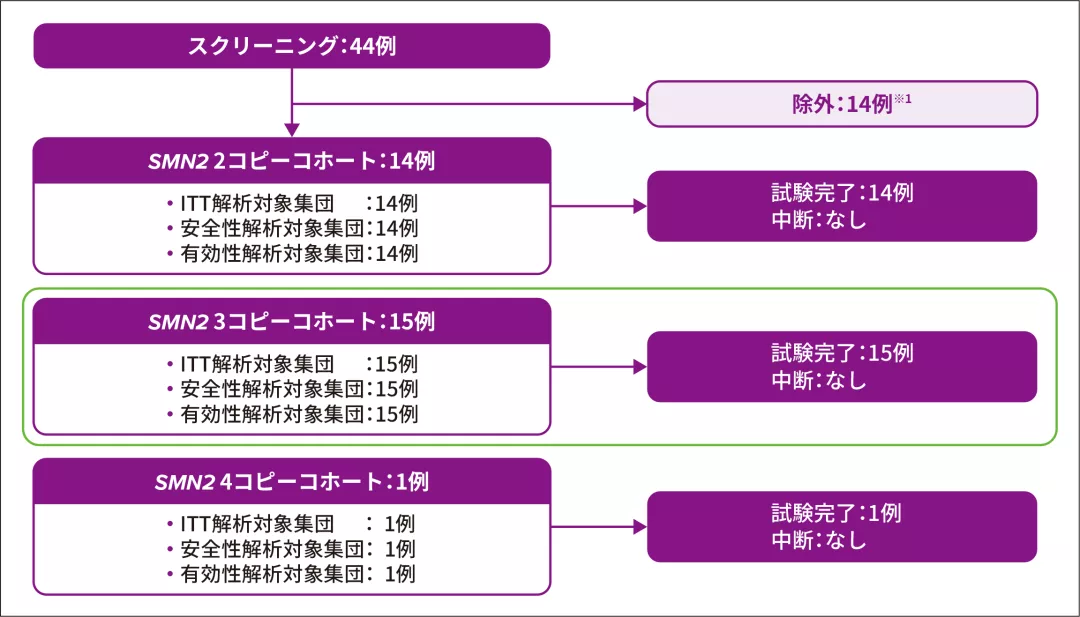
CMAP:複合筋活動電位、ITT:Intent-to-Treat
※ 1 :図のいずれのコホートからも除外された症例
※ 2 :2例は2種類の除外基準に該当していた(いずれもスクリーニング時点でSMAの臨床所見を呈しており、1例は嚥下障害、もう1例は腓骨神経のCMAPが2 mV未満であった)
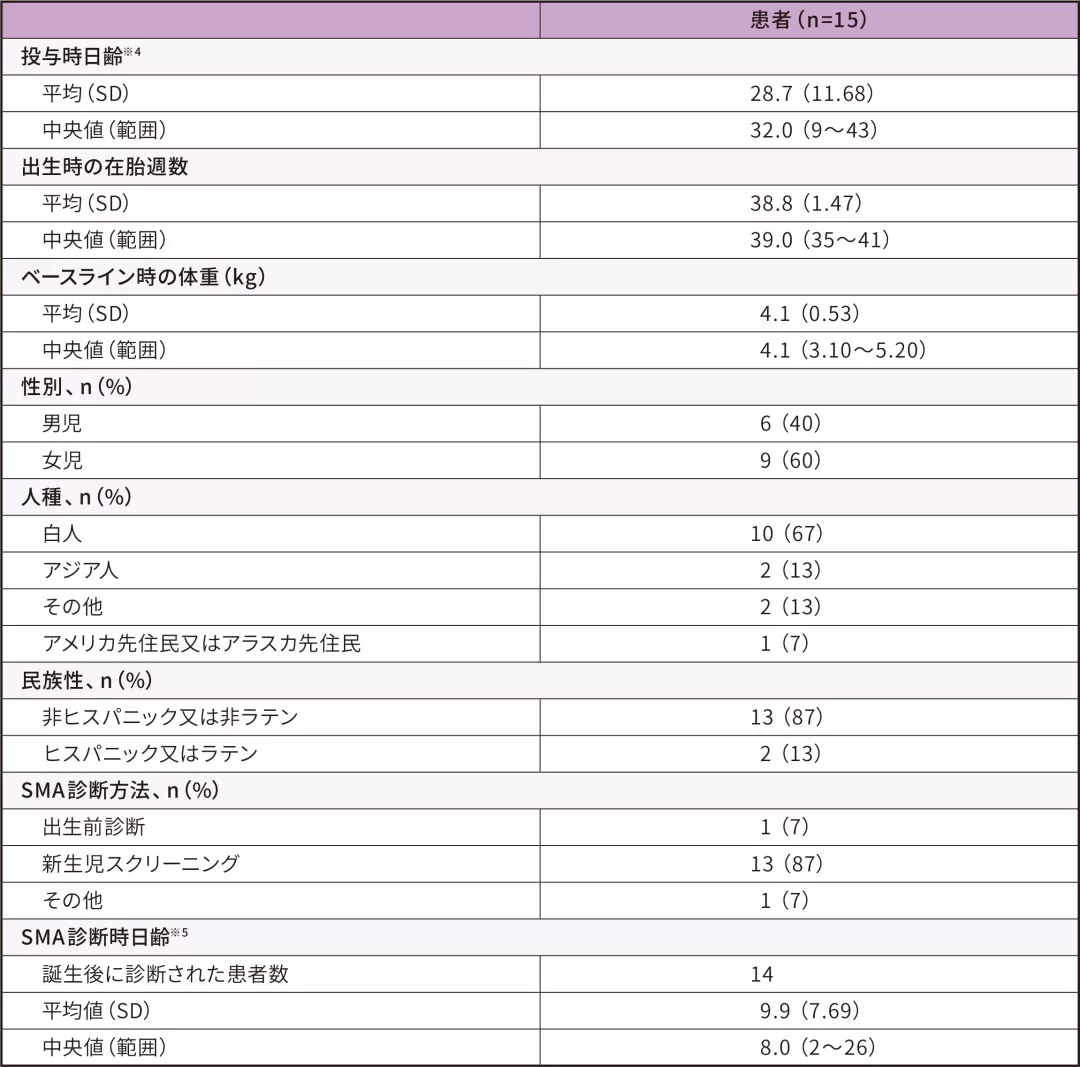
患者背景 ITT
- 15例の参加者のベースライン時※3の日齢は9~43日(中央値 32)であった。うち多く(13例)は新生児スクリーニングにより、SMN1遺伝子の両アレルの欠損・SMN2遺伝子3コピーと同定された
- ベースライン時の体重は3.1~5.2 kg(中央値 4.1)であった
- ベースライン時の腓骨神経のCMAPは2.7~7.0 mV(中央値 4.1)であった
ITT:Intent-to-Treat
※ 3 :ゾルゲンスマ投与日の前日
※ 4 :投与時日齢=投与日ー誕生日+1
※ 5 :SMA診断時日齢=SMA診断日ー誕生日+1、誕生後にSMAと診断された患者について算出した
3. 有効性
(1)運動マイルストーンを達成した患者の割合
ITT 主要評価項目 副次評価項目
- 全例(15/15)で、主要評価項目である、24ヵ月齢時までの「3秒以上支えなしで立つ」の運動マイルストーンを達成した。うち14例は正常発育の期間内であった。PNCR自然経過集団※1ではその割合は24%(19/81)であった(p<0.0001※2、外部集団との比較による参考p値)
- 93%の患者(14/15)※3で、副次評価項目である、24ヵ月齢時までに「筋肉運動の協調とバランスを示しながら、5歩以上自力で歩行する」能力を獲得した。うち11例は正常発育の期間内であった。PNCR自然経過集団※1ではその割合は21%(17/81)であった(p<0.0001※2、多重性調整あり)

※ 1 :SMA患者を対象にした大規模な自然観察試験であるPediatric Neuromuscular Clinical Research Network(PNCR)試験から抽出した患者データ
※ 2 :Fisher’s正確検定(有意水準 両側5%)
※ 3 :残り1例もビデオコールにて24ヵ月齢までに歩行が確認されている。ただ、ビデオ撮影がなされておらず、第三者のレビューができなかったため、本試験プロトコルに基づいた評価上は未達となっている
※ 4 :Bayleyスケール(第3版)運動領域 粗大運動マイルストーン#40。WHO-MGRSにおける正常発育の「支えなしで立つ」の達成期間(1~99パーセンタイル)は、6.9~16.9ヵ月である
※ 5 :Bayleyスケール(第3版)運動領域 粗大運動マイルストーン#43。WHO-MGRSにおける正常発育の「自力で歩行する」の達成期間(1~99パーセンタイル)は、8.2~17.6ヵ月である
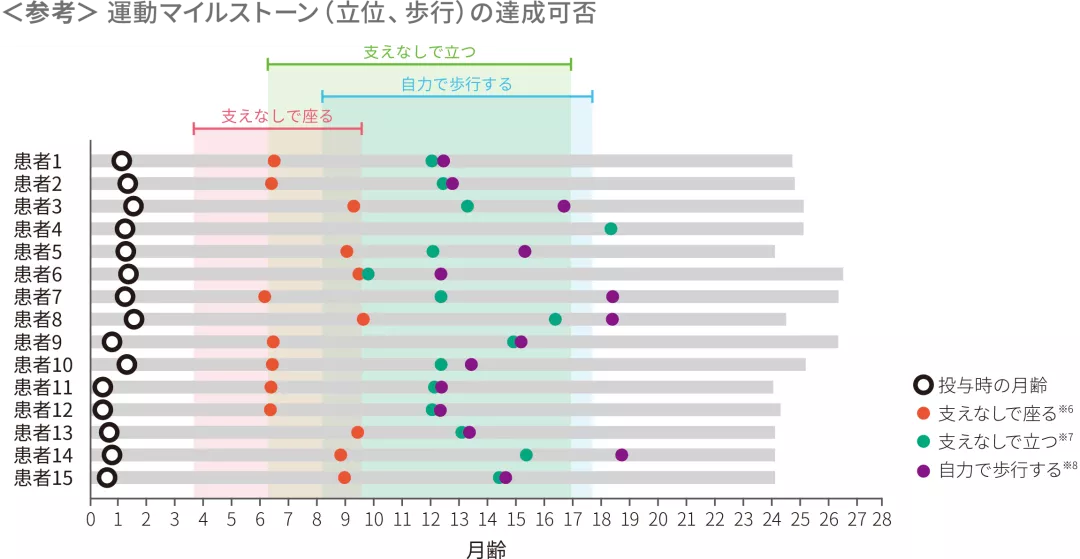
各運動マイルストーンに関して初めて達成した時点を示した。達成月は日齢/30で算出した。塗りつぶしはWHO-MGRSにおける正常発育の各運動マイルストーンの達成期間を示す
※ 6 :30秒以上支えなしで座る〔Bayleyスケール(第3版)運動領域 粗大運動マイルストーン#26〕
※ 7 :支えなしで立つ(同#40)
※ 8 :自力で歩行する(同#43)
(2)永続的な呼吸補助を必要とせずに生存した患者の割合
ITT 探索的評価項目
- ゾルゲンスマ投与により、全例(15/15)が14ヵ月齢時に永続的な呼吸補助※1を必要とせず、その状態を試験期間終了時まで維持できた

※ 1 :永続的な呼吸補助は、14日以上連続して16時間/日以上の呼吸補助(非侵襲的な呼吸補助を含み、可逆的な急性疾患及び周術期の呼吸補助を除く)を必要とする状態、と定義した
(3) 非経口又は機械的栄養補助を必要とせずに体重を3パーセンタイル以上維持した患者の割合
ITT 探索的評価項目
- 67%(10/15)が24ヵ月齢時までの全来院時に3パーセンタイルの体重を維持し、試験終了時には全例(15/15)の体重が3パーセンタイル以上であった(WHOにより定められた性別・年齢別の体重パーセンタイル)。また、全例(15/15)が試験期間中を通じて経管栄養を必要としなかった

※ 2 :ベースライン時に全例は低濃度液体の摂取が可能であった
(4)微細運動及び粗大運動スコアのベースラインからの変化
ITT 探索的評価項目
- 全例(15/15)※が正常発育と同程度(図中グレー部分)の粗大運動スコア、微細運動スコアの伸びを示した〔Bayleyスケール(第3版)〕
- 運動機能の獲得は電気生理学的検査の結果とも呼応しており、ゾルゲンスマ治療後の腓骨神経のCMAP最大値は4.2~8.5 mV(中央値 6.00 mV)であった
Bayleyスケールのベースラインからの変化
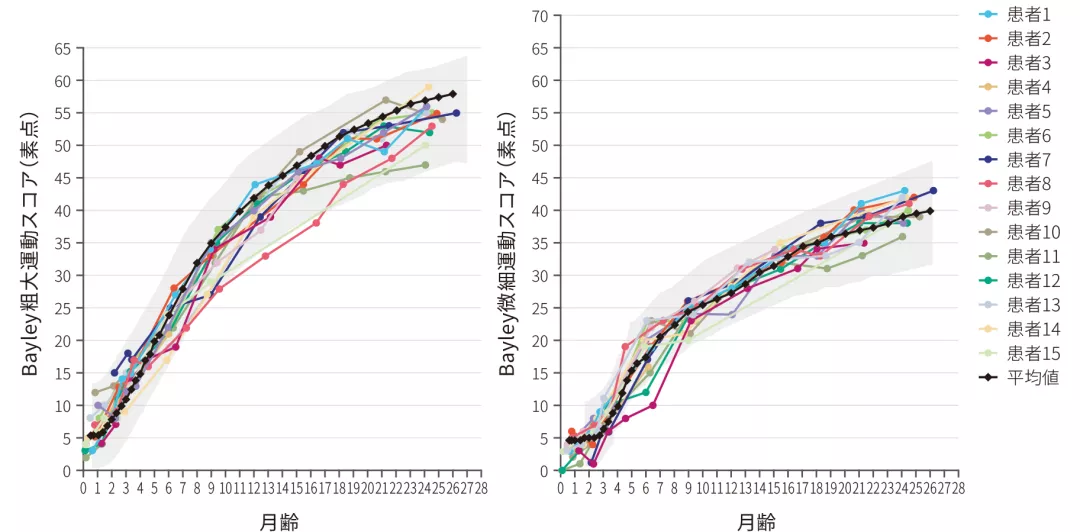
※:1例はベースライン時の計測忘れのため、ベースライン時からの差分の計測からは除外した
4. 安全性
安全性解析対象集団 安全性評価項目
- 患者4例で計13件のゾルゲンスマとの因果関係が否定できない肝毒性イベントが認められたが、いずれも軽快した
- 血小板減少症イベントは軽度又は中等度であり、ゾルゲンスマとの因果関係は否定された。いずれも軽快し、後遺症はなかった
- 心筋マーカー高値は軽度又は中等度であり、ゾルゲンスマとの因果関係が否定できない又は因果関係がある可能性が高いものであった
-2例は心筋マーカー高値が軽快し、後遺症はなかった
-1例は試験終了時までクレアチンホスホキナーゼMB高値が持続した - 血栓性微小血管症イベントは認められなかった
- 1例では軽度の反射消失が発現し、これは後根神経節障害との関連が示唆された。なお、ゾルゲンスマとの因果関係は否定されている
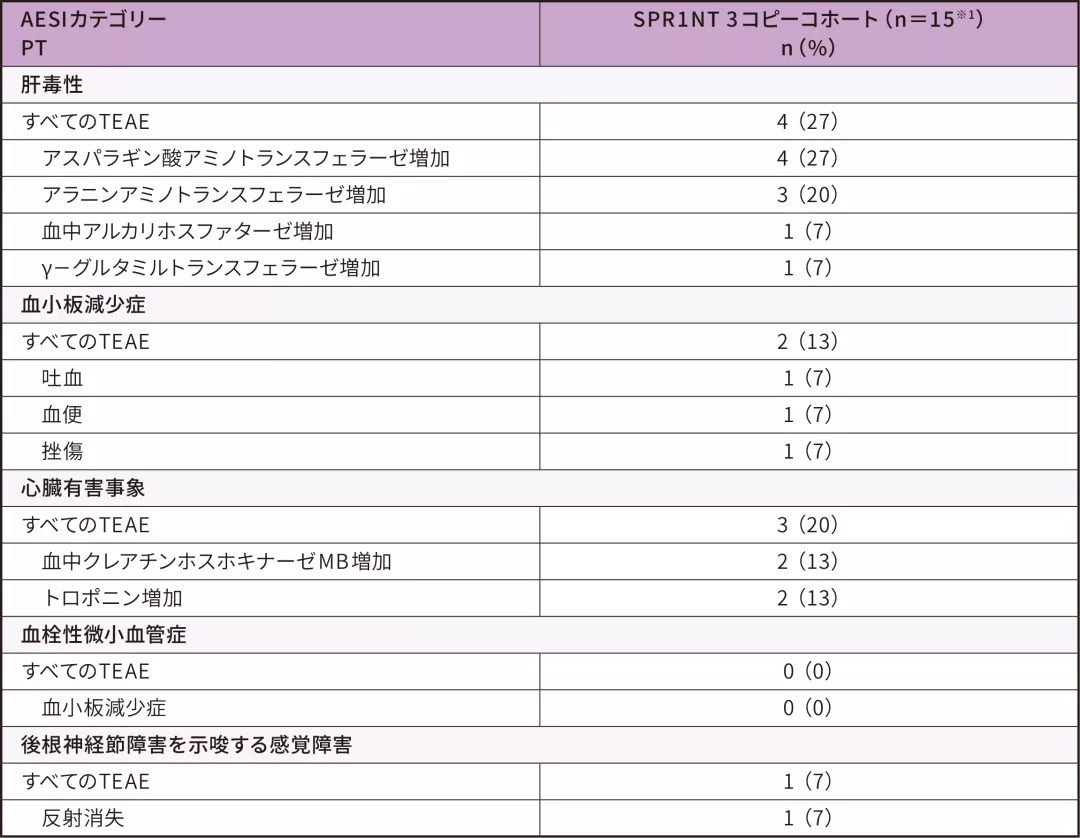
AESI:特に注目すべき有害事象、PT:事象、TEAE:治験薬投与後に発現した有害事象
※ 1 :安全性解析対象集団は男児6例、女児9例であった。投与時日齢の平均値(SD)は28.7(11.68)であった
| 本品の電子添文では、「3.不具合・副作用(1)重大な副作用」として、「1)肝機能障害、肝不全、2)血小板減少症、3)血栓性微小血管症」が設定され注意喚起が求められております。 |
<参考>日本人における有効性(2019年9月2日カットオフ)
ITT
承認時参考資料(承認時に評価された資料)
3)社内資料:遺伝子検査によりⅠ、Ⅱ又はⅢ型と考えられる脊髄性筋萎縮症患者を対象とした国際共同第Ⅲ相試験(CL-304試験)
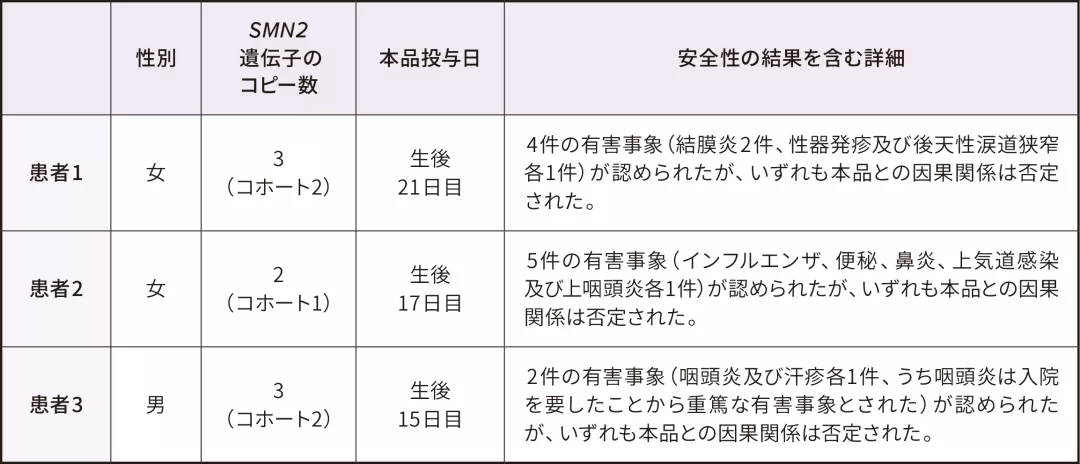
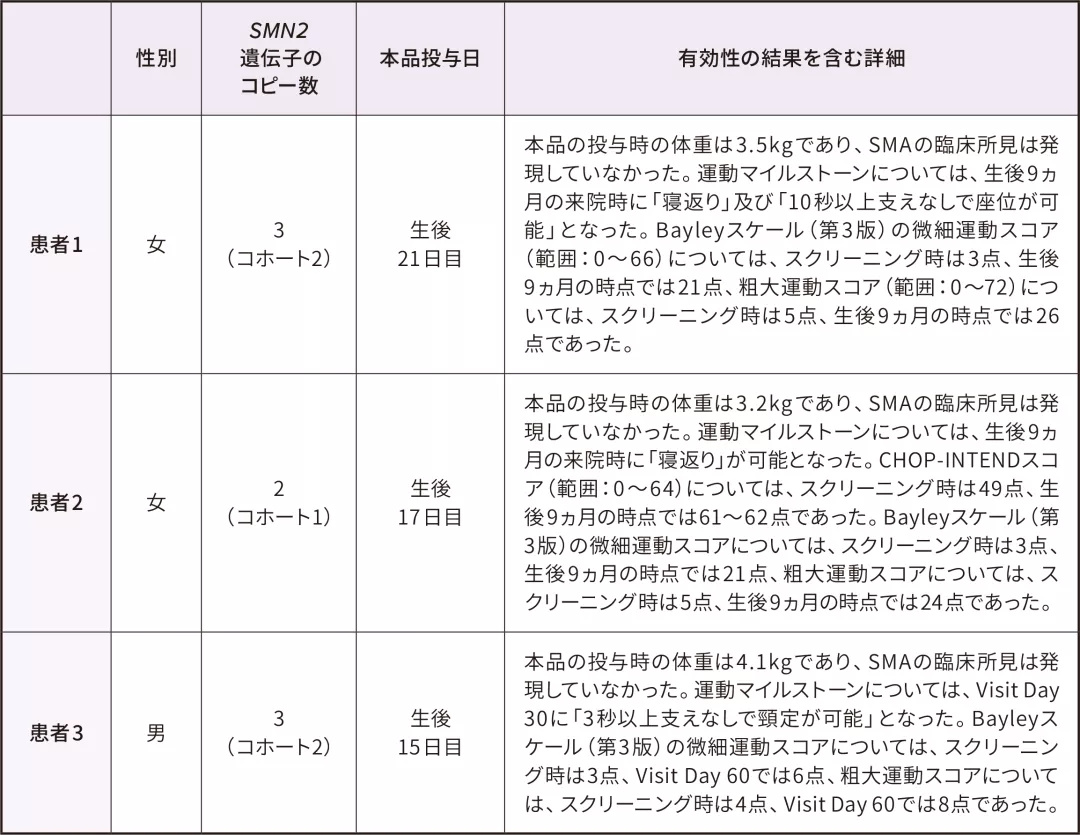
CL304試験に登録された3例の日本人患者に本品が投与された。
3例の有効性の結果を含む詳細(患者1及び2は生後9ヵ月まで、患者3は本品の Visit Day 60 までの結果)は下表のとおりであった
<参考>日本人における安全性(2019年9月2日カットオフ)
安全性解析対象集団
承認時参考資料(承認時に評価された資料)
3)社内資料:遺伝子検査によりⅠ、Ⅱ又はⅢ型と考えられる脊髄性筋萎縮症患者を対象とした国際共同第Ⅲ相試験(CL-304試験)
データカットオフ時点で、CL-304試験に登録された3例の日本人患者に本品が投与された。3例の安全性の詳細(患者1及び2は生後9ヵ月まで、患者3は本品の Visit Day 60 までの結果)は下表のとおりであった。