パンくず
B細胞性急性リンパ芽球性白血病(B-ALL)
ELIANA試験
再発又は難治性のCD19陽性のB-ALL患者を対象とした国際共同第Ⅱ相試験(B2202試験、ELIANA試験(検証試験))(日本人を含む)
Maude, SL. et al.: N. Engl. J. Med. 2018; 378(5): 439-448. COI:本試験はノバルティスの資金により行われた。著者にノバルティスより謝礼、研究助成金を受領した者及び社員が含まれる。
社内資料:再発性及び難治性のB細胞性急性リンパ芽球性白血病の小児患者を対象とするCTL019の有効性及び安全性を評価する第Ⅱ相単群多施設試験(B2202試験) (承認(2019年3月26日承認、CTD 2.7.6-4.2.1)時評価資料)
小児及び若年成人における再発又は難治性のB-ALL患者を対象にキムリアの有効性及び安全性を評価する、単群、多施設共同、第Ⅱ相試験(B2202試験、ELIANA試験)
試験概要
試験デザイン
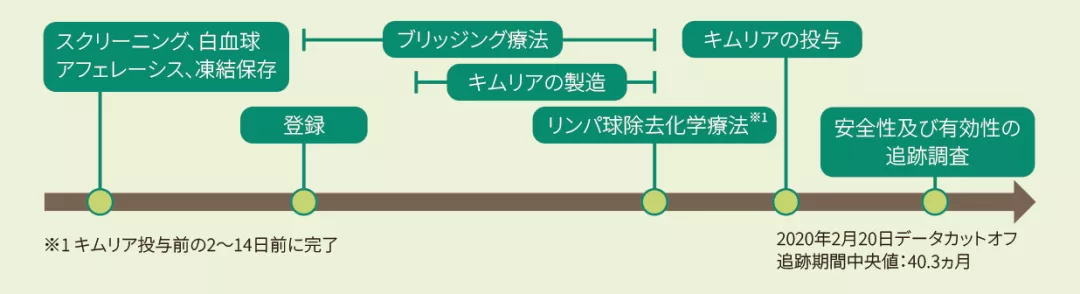
| 目的 | 再発又は難治性のB-ALL患者を対象に、米国又は欧州の製造施設(すべての製造施設)で製造されたキムリアの有効性及び安全性を検討する。 |
| 対象 | ①〜⑤のいずれかに該当する3歳(スクリーニング時)〜21歳以下(B-ALLの初回診断時)の再発又は難治性のB-ALL患者107例(スクリーニング時)のうち投与例75例(日本人2例を含む)。なお、悪性腫瘍(白血病)の活動性の中枢神経系浸潤のある患者及び髄外単独病変の再発のある患者は除外された。 ①2回以上の骨髄再発が認められた ②同種HSCT後に骨髄再発し、キムリアの投与時点で同種HSCTから6ヵ月以上経過している ③同種HSCTの適応がない ④標準の化学療法レジメンを2サイクル受けた後でも寛解を達成しないと定義される初発難治性、又は再発した白血病に対して標準の化学療法を1サイクル受けた後でも寛解を達成しないと定義される化学療法難治性 ⑤フィラデルフィア染色体陽性の患者の場合には、チロシンキナーゼ阻害剤(TKI)不耐又は禁忌、2種類以上のTKIを受けても奏効が得られない |
| 投与方法・投与量 | 体重50kg以下の場合には、CAR発現生T細胞として2.0×106~5.0×106個/kg、体重50kg超の場合には、CAR発現生T細胞として1.0×108~2.5×108個(体重に関係なく)単回静脈内投与した。 また、他の安全性に関する出荷基準をすべて満たしていれば、以下の範囲での投与も可能とした。
|
| 評価項目・ 解析計画 | 主要評価項目 主な副次評価項目 その他の副次評価項目 解析計画 |
治療状況・患者背景
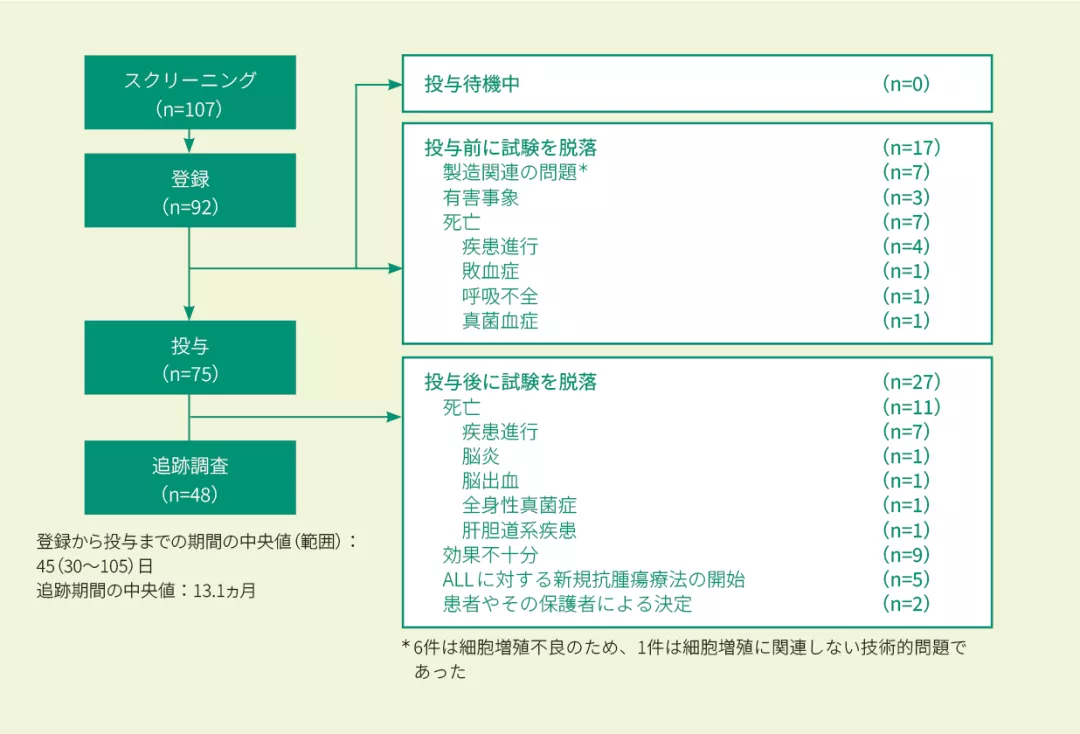
治療状況
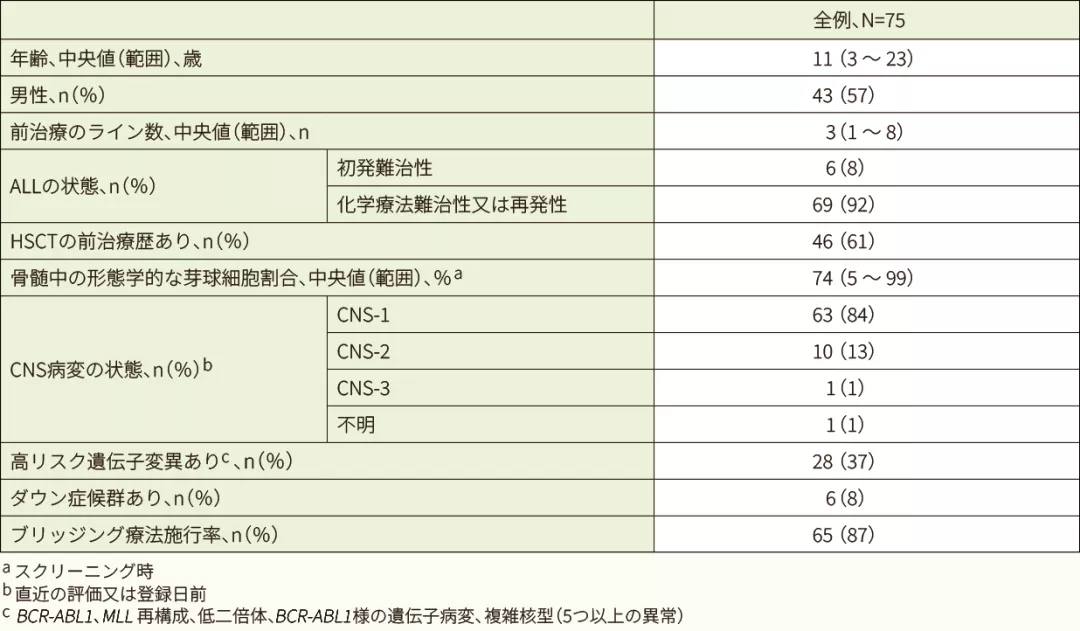
患者背景
有効性
すべての製造施設で製造されたキムリアの投与を受けた患者における投与後3ヵ月以内のORRについて中間解析が実施され、IRC判定に基づく投与後3ヵ月以内のORRは82.0%(41/50例)[98.9%CI: 64.5、93.3]であり、98.9%CIの下限値は予め設定された閾値寛解率20%を上回り、優越性が検証されました。主解析のデータカットオフ日時点では、IRC判定に基づく投与後3ヵ月以内のORRは81%(61/75例)[95%CI: 71、89]でした。CRは75例中45例(60%)、CRiは16例(21%)に認められました。<主要評価項目、検証的な解析結果>

すべての製造施設で製造されたキムリアの投与を受けた患者における骨髄MRD陰性寛解が得られた患者の割合について、中間解析のデータカットオフ日時点では、キムリアの投与を受けた50例中41例(82.0%)[95%CI:68.6、91.4]が、投与後3ヵ月以内に骨髄MRD陰性(MRD<0.01%)を伴うCR又はCRiを達成し、98.9%CIの下限値が予め設定された閾値寛解率15%を超え、優越性が検証されました。主解析のデータカットオフ日時点では、キムリアの投与を受けた75例中61例(81%)が、投与後3ヵ月以内に骨髄MRD陰性(MRD<0.01%)寛解を達成しました。投与後3ヵ月以内にCR又はCRiを達成した全例が、同時に骨髄MRD陰性も達成しました。MRDは中央検査機関で測定されました。<主な副次評価項目、検証的な解析結果>
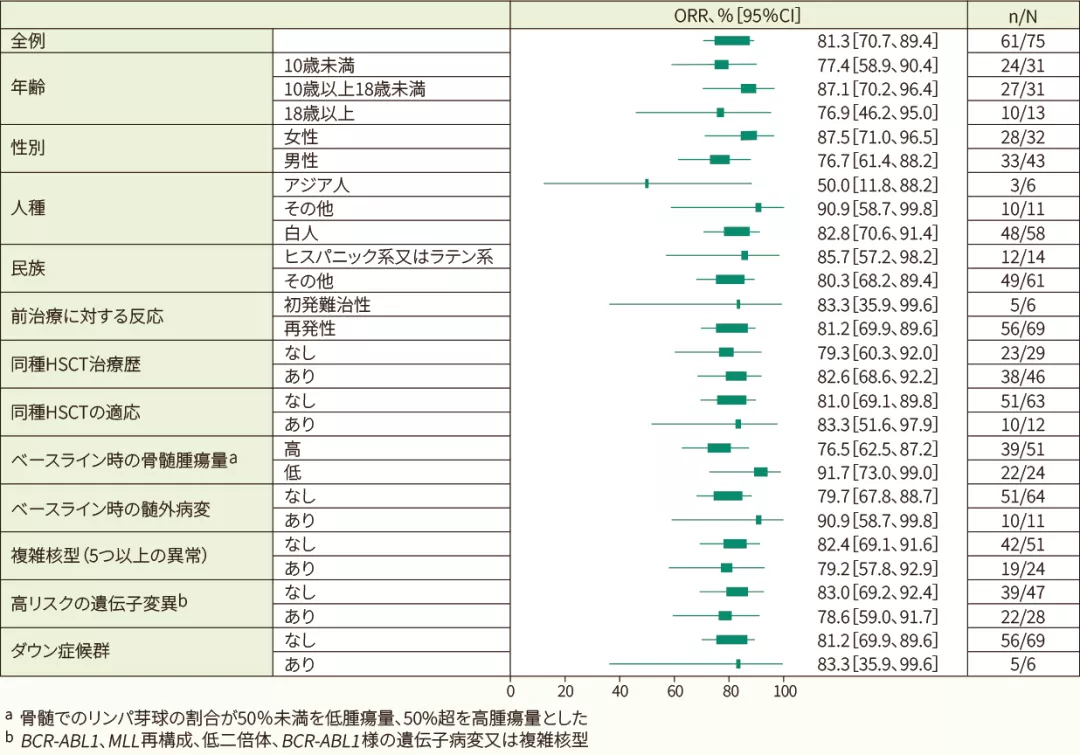
初発難治性又は化学療法難治性、同種HSCT治療歴等の要因によらず、いずれの部分集団でも全体の結果と同様に一貫したORRが確認されました<部分集団解析>
部分集団別のORR(IRC判定、FAS)
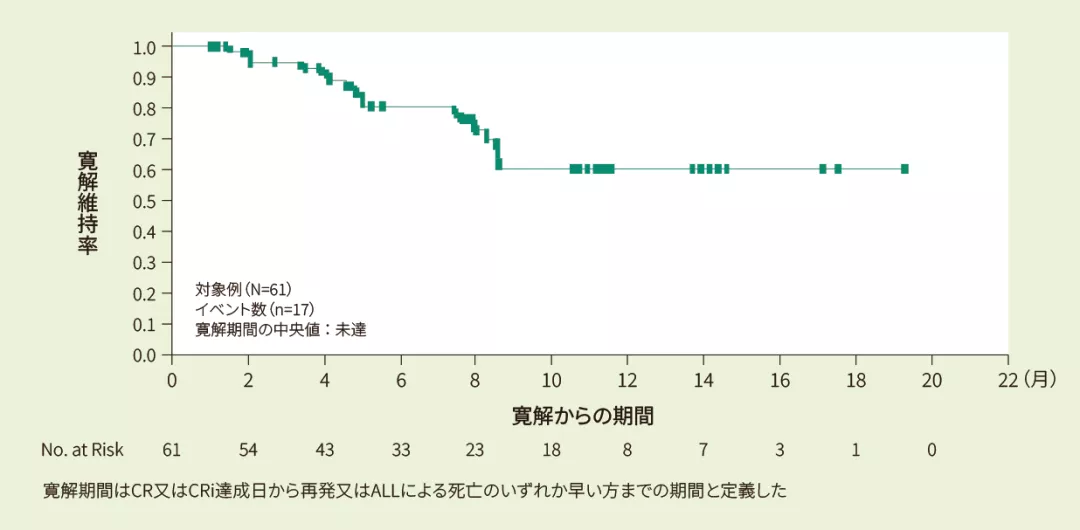
寛解例61例における6ヵ月時点の寛解維持率は80%[95%CI: 65、89]、12ヵ月時点の寛解維持率は59%[95%CI: 41、73]であり、寛解期間の中央値は推定できませんでした。<その他の副次評価項目>
Kaplan-Meier法で推定したIRC判定に基づく寛解期間の曲線(FAS)
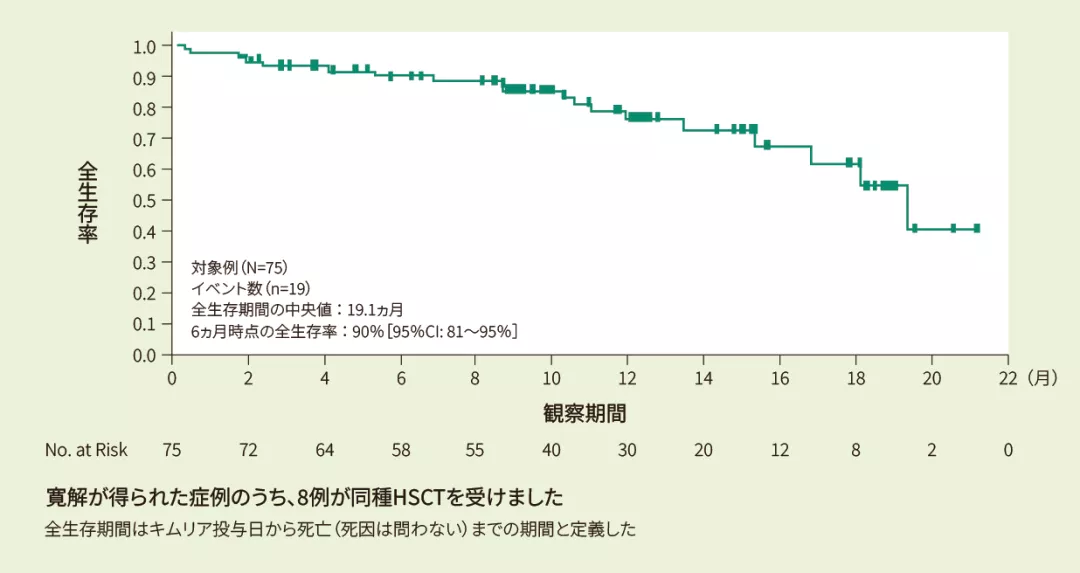
投与例75例における6ヵ月時点の全生存率は90%[95%CI: 81、95]、12ヵ月時点の全生存率は76%[95%CI: 63、86]であり、全生存期間の中央値は19.1ヵ月[95%CI: 15.2、推定不能]でした<その他の副次評価項目>
Kaplan-Meier法で推定した全生存期間の曲線(FAS)
安全性
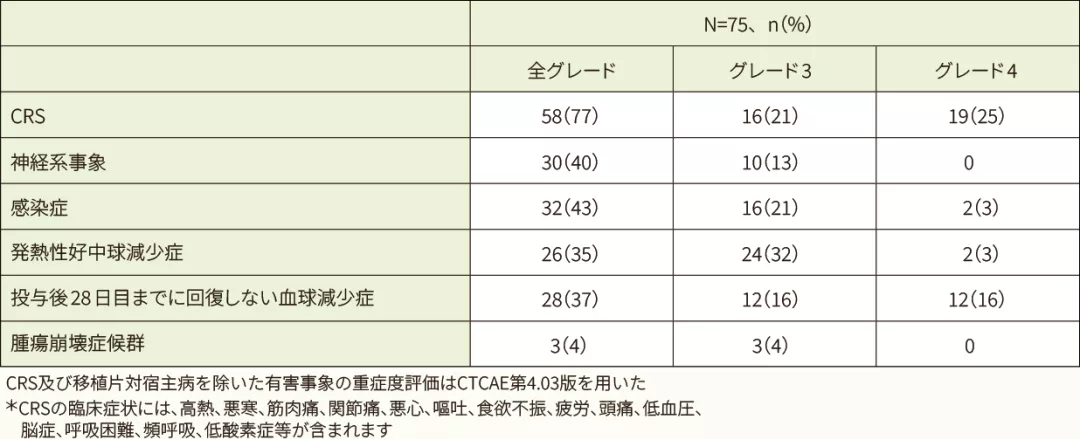
安全性解析対象75例中71例(94.7%)に副作用が認められました。高頻度(30%超)に認められた副作用は、サイトカイン放出症候群(CRS)*58例(77.3%)でした。高頻度(5%超)に認められたグレード4の副作用は、CRS 19例(25.3%)、白血球数減少7例(9.3%)、低血圧及び好中球数減少 各6例(8.0%)、血小板数減少、リンパ球数減少及び血小板減少症 各4例(5.3%)でした。
有害事象は75例全例で認められ、35%超に認められた全グレードの有害事象は、CRS 58例(77%)、発熱30例(40%)、食欲減退29例(39%)、発熱性好中球減少症及び頭痛 各27例(36%)でした。
重篤な有害事象は58例 (77.3%)に認められ、5例以上に認められた重篤な有害事象はCRS 47例(62.7%)、発熱性好中球減少症15例(20.0%)、低血圧8例(10.7%)、発熱7例(9.3%)、急性腎障害、低酸素症及び呼吸不全 各5例(6.7%)でした。 このうち、CRS 47例(62.7%)、発熱性好中球減少症13例 (17.3%)、低血圧8例(10.7%)、急性腎障害4例(5.3%)、 発熱3例(4.0%)、低酸素症2例(2.7%)及び呼吸不全2例 (2.7%)はキムリアとの関連ありと判断されました。
投与後8週以内で特に注意を要する有害事象は75例中67例(89.3%)に認められ、最も多く認められた有害事象はCRSが58例(77.3%)でした。CRSの発現までの期間の中央値は3日であり、CRSの持続期間の中央値は8日でした。CRSに対して実施した、主な抗サイトカイン療法はトシリズマブ(28例)や副腎皮質ステロイド剤(14例)の投与等であり、主な支持療法はICUへの入室(35例、47%)、酸素吸入(33例、44%)や高用量の昇圧剤(19例、25%)の投与等でした。神経系事象の多くは、CRSが発現している間又はCRSから回復した直後に認められました。主な神経系事象は、脳症(11%)、錯乱状態(9%)、せん妄(9%)等でした。
- キムリア投与後8週以内で特に注意を要する有害事象
時期別の有害事象
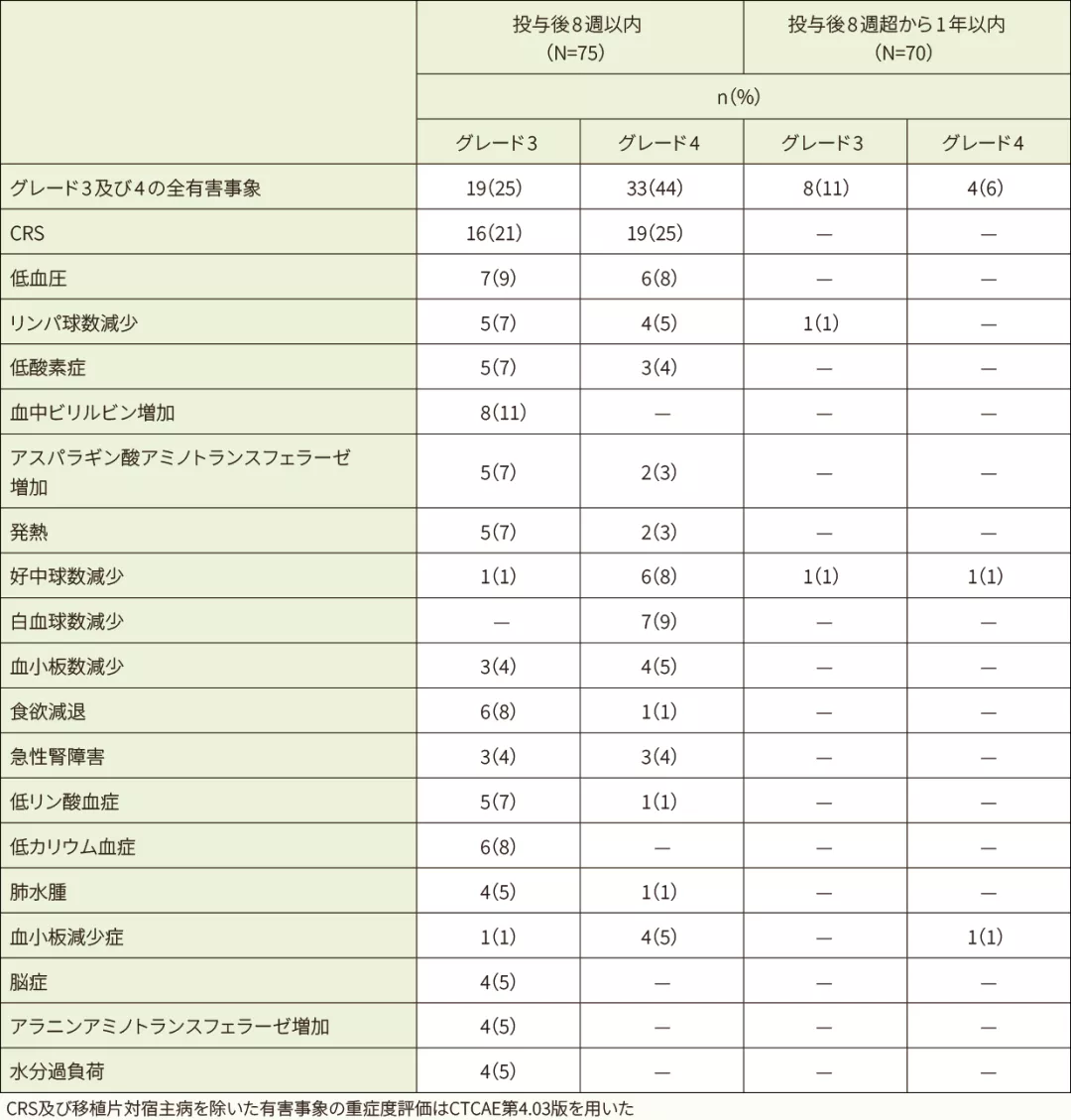
グレード3及び4の有害事象の多くは、キムリア投与後8週以内に認められ、特にCRSが35例(47%)で最も高頻度に認められました。
- 発現率5%以上のグレード3及び4の有害事象
投与後8週以内に試験中止に至った有害事象としてカンジダ感染1例(1.3%)が認められ、キムリアとの関連ありと判断されました。
投与後8週超から1年以内に試験中止に至った有害事象として心不全、心停止及び急性腎障害 各1例(1.3%)が認められ、いずれの事象もキムリアとの関連を否定されました。
キムリア投与後30日以内の死亡は2例(2.7%、死因:疾患進行及び脳出血が各1例)に認められました。投与後30日超の死亡は17例(22.7%)に認められ、死因は疾患進行が12例、感染症が3例(脳炎1例、全身性真菌症1例、細菌性下気道感染1例)、肝胆道系疾患が1例及び不明1例でした。このうち、脳炎はキムリア及びリンパ球除去化学療法のいずれか又は両方との関連ありと判断され、全身性真菌症はキムリアとの関連ありと判断されました。
| 4.効能、効果又は性能 1. 再発又は難治性のCD19陽性のB細胞性急性リンパ芽球性白血病。ただし、以下のいずれかの場合であって、CD19抗原を標的としたキメラ抗原受容体発現T細胞輸注療法の治療歴がない患者に限る。 ・初発の患者では標準的な化学療法を2回以上施行したが寛解が得られない場合 ・再発の患者では化学療法を1回以上施行したが寛解が得られない場合 ・同種造血幹細胞移植の適応とならない又は同種造血幹細胞移植後に再発した場合 2. 再発又は難治性のびまん性大細胞型B細胞リンパ腫。ただし、以下のいずれかの場合であって、CD19抗原を標的としたキメラ抗原受容体発現T細胞輸注療法の治療歴がない、かつ、自家造血幹細胞移植の適応とならない又は自家造血幹細胞移植後に再発した患者に限る。 ・ 初発の患者では化学療法を2回以上、再発の患者では再発後に化学療法を1回以上施行し、化学療法により完全奏効が得られなかった又は完全奏効が得られたが再発した場合 ・ 濾胞性リンパ腫が形質転換した患者では通算2回以上の化学療法を施行し、形質転換後には化学療法を1回以上施行したが、形質転換後の化学療法により完全奏効が得られなかった又は完全奏効が得られたが再発した場合 3. 再発又は難治性の濾胞性リンパ腫。ただし、以下の場合であって、CD19抗原を標的としたキメラ抗原受容体発現T細胞輸注療法の治療歴がない患者に限る。 ・ 初発の患者では全身療法を2回以上、再発の患者では再発後に全身療法を1回以上施行し、全身療法により奏効が得られなかった又は奏効が得られたが再発した場合 5.効能、効果又は性能に関連する注意 〈再発又は難治性のCD19陽性のB細胞性急性リンパ芽球性白血病〉 5.1 25歳以下(投与時)の患者に使用すること。 5.2 フローサイトメトリー法又は免疫組織染色法等により検査を行い、CD19抗原が陽性であることが確認された患者に使用すること。 5.3 臨床試験に組み入れられた患者の前治療歴等について、「17. 臨床成績」の項の内容を熟知し、本品の有効性及び安全性を十分に理解した上で、適応患者の選択を行うこと。[17.1.1参照] 〈再発又は難治性のびまん性大細胞型B細胞リンパ腫、再発又は難治性の濾胞性リンパ腫〉 5.4 臨床試験に組み入れられた患者の組織型、前治療歴等について、「17. 臨床成績」の項の内容を熟知し、本品の有効性及び安全性を十分に理解した上で、適応患者の選択を行うこと。[17.1.2、17.1.3参照] |




