▼ Este medicamento está sujeto a seguimiento adicional, es prioritaria la notificación de sospechas adversas asociadas a este medicamento.


▼ KESIMPTA® ofrece comodidad para tus paciente1,7 y tu consulta*7

Según los resultados de la encuesta a neurólogos europeos PERITIA^ sobre la experiencia de primera mano con el manejo y la satisfacción de la terapia con KESIMPTA®:7


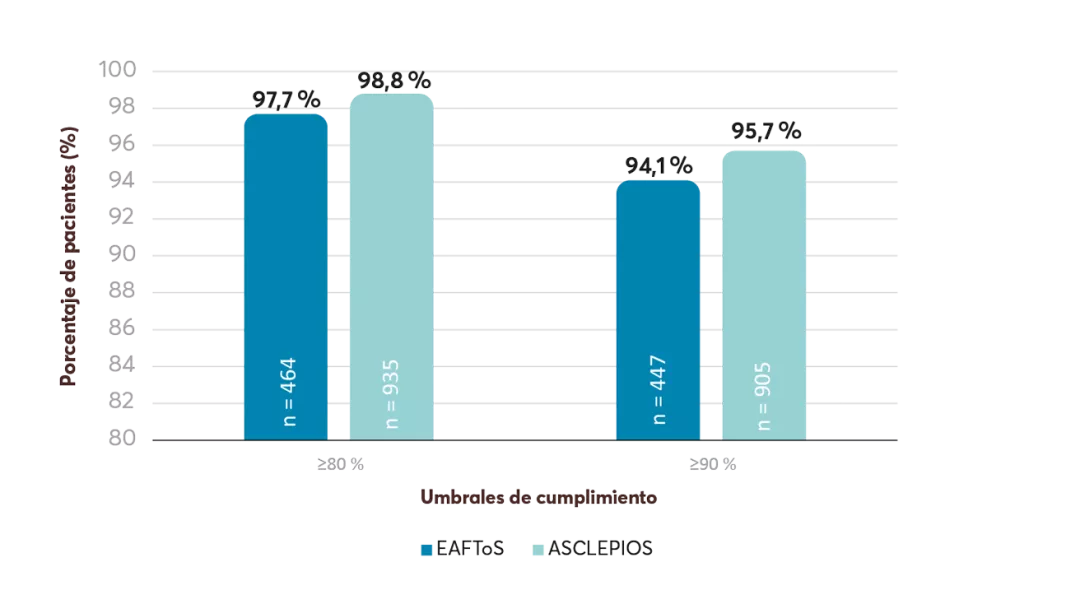
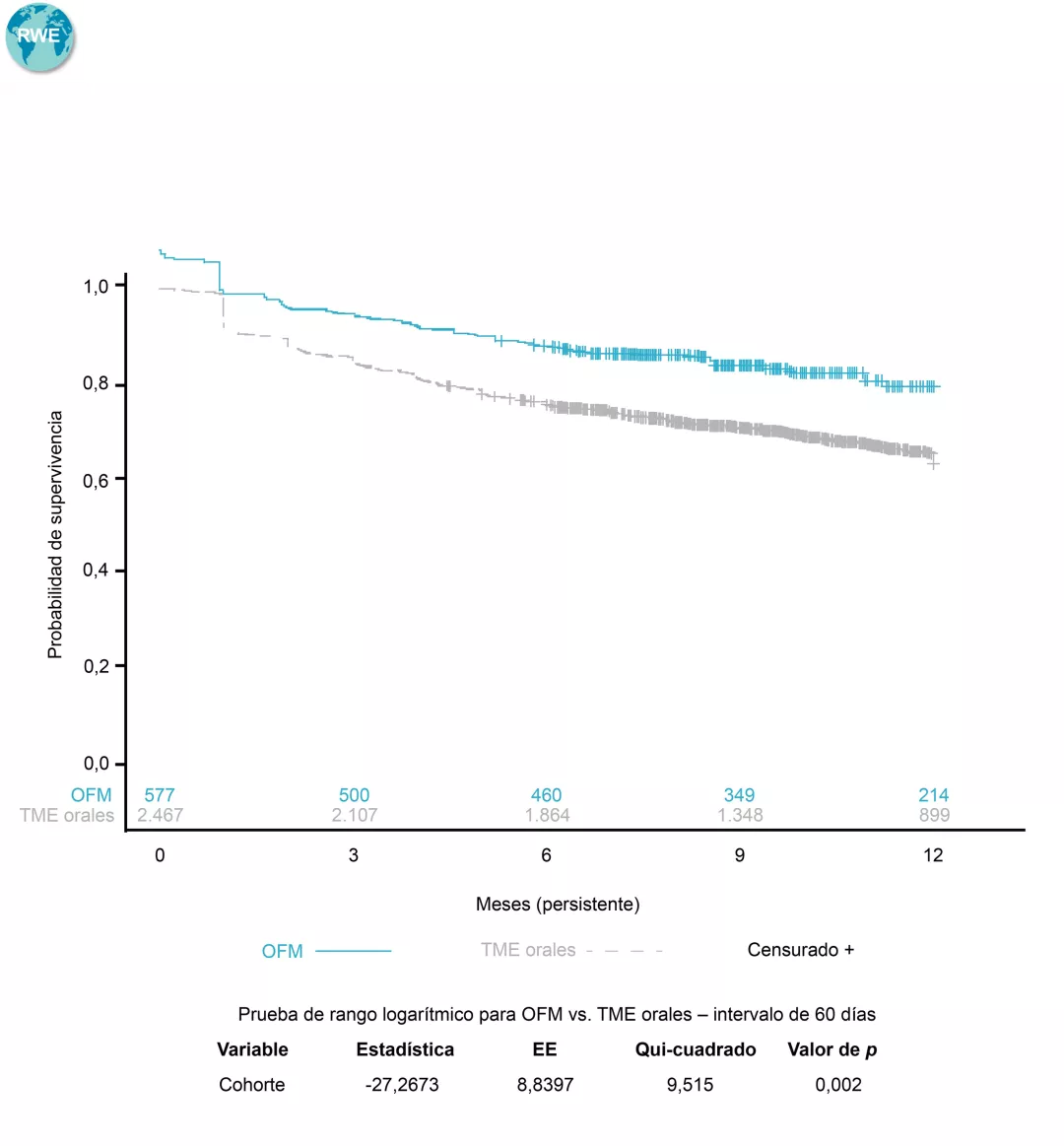
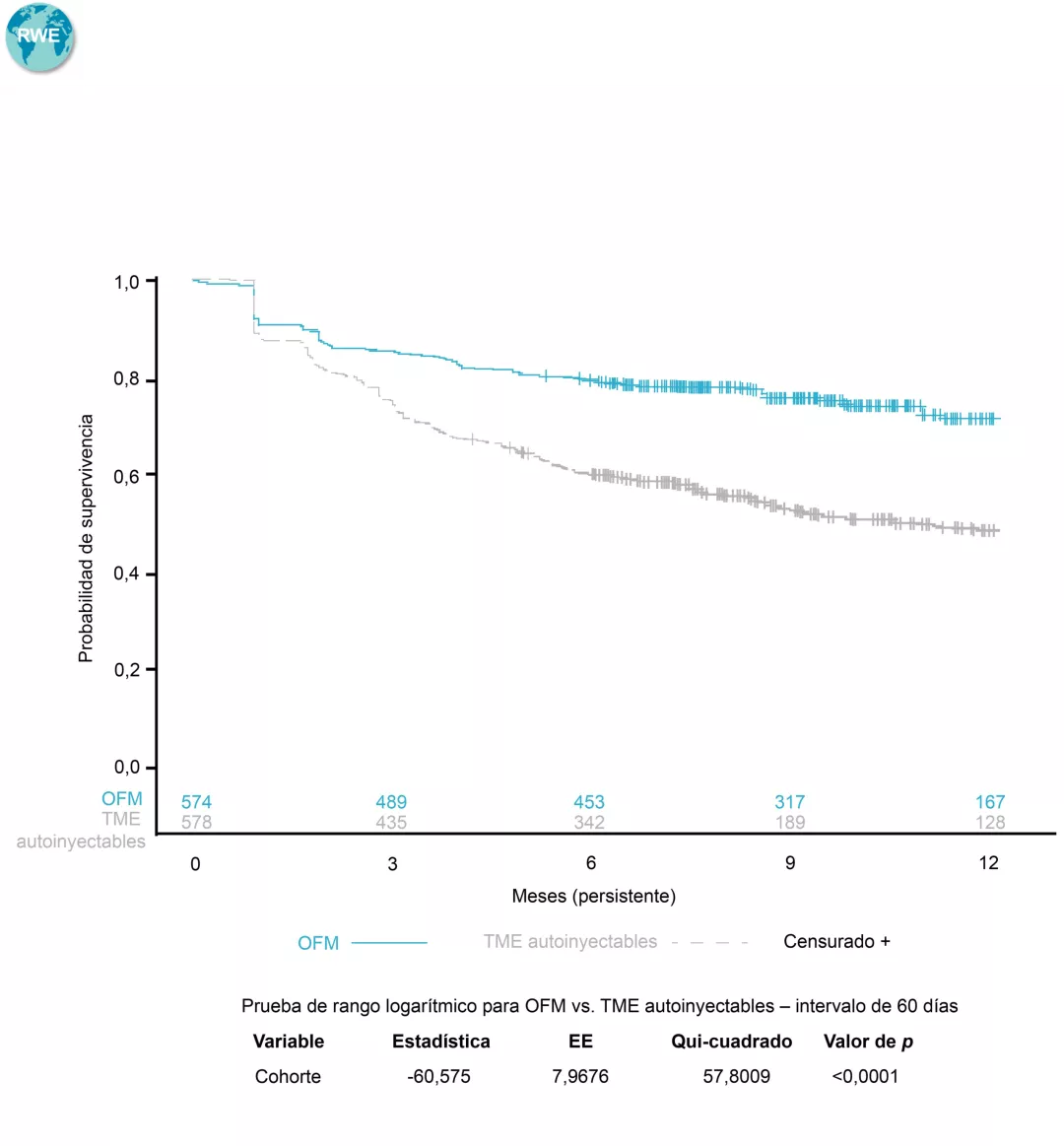
Datos en práctica clínica real
KESIMPTA® fue percibido como fácil de usar a nivel general†1


Conoce cómo valora la Dra. Irene Gómez Estévez (Hospital Clínico San Carlos de Madrid, CSUR de EM) la posibilidad que ofrece KESIMPTA® de autoadministración desde casa.
La inyección sc autoadministrada una vez al mes# de KESIMPTA® ofrece comodidad para los pacientes y facilita los procesos en la práctica clínica7
Referencias
Ross AP, et al. Real-world satisfaction and experience with injection and autoinjector device for ofatumumab indicated for multiple sclerosis. BMC Neurol. 2025;25(1):28.
Ross AP, et al. Patient and nurse preference for Sensoready autoinjector pen versus other autoinjectors in multiple sclerosis: results from a pilot multicenter survey. BMC Neurol. 2023;23(1):85
Hauser SL, et al. The Development of Ofatumumab, a Fully Human Anti-CD20 Monoclonal Antibody for Practical Use in Relapsing Multiple Sclerosis Treatment. Neurol Ther. 2023;12:1491-1515.
Informe de posicionamiento terapéutico de ofatumumab (KESIMPTA®) en el tratamiento de pacientes adultos con Esclerosis Múltiple Recurrente. Informe de posicionamiento terapéutico IPT 88-2023/V1/12012023. Disponible en: https://www.aemps.gob.es/medicamentosUsoHumano/informesPublicos/docs/2023/IPT-088-2023-Kesimpta.pdf
Ficha técnica de KESIMPTA®.
Hengstman G, et al. Assessment of Patients Experiences With Ofatumumab in Multiple Sclerosis: Findings From a Market Research Survey Conducted in the Netherlands. Abstract Number: 648/P1640. 9th Joint ECTRIMS ACTRIMS Meeting, 11-13 de octubre, 2023. Milán, Italia.
Rau D, et al. Assessment of the treating physicians first-hand experience with handling and satisfaction of ofatumumab therapy: findings from the PERITIA survey conducted in Europe. BMC Neurol. 2023;23(1):147.
Kramer J, et al. Tolerability of subcutaneous ofatumumab with long-term exposure in relapsing multiple sclerosis. Mult Scler J Exp Transl Clin. 2023;9(4):20552173231203816.
*La primera dosis ha de administrarse bajo la guía de un profesional sanitario5.
‡ Encuesta de investigación de mercado en los Países Bajos desde abril de 2022 hasta abril de 2023 a través de un cuestionario en línea, completado por 53 pacientes6.
**Con la administración de la dosis5.
^PERITIA fue una encuesta multicéntrica realizada para recoger las respuestas de los investigadores europeos del estudio ASCLEPIOS I/II a través de un cuestionario en línea. Completaron la encuesta 46 médicos (Alemania, n = 14; España, n = 12; Portugal, n = 10; Italia, n = 10) 7 .
† Encuesta transversal realizada en EE. UU. que incluyó a pacientes con EM (≥18 años) que se autoadministraron ofatumumab utilizando el dispositivo Sensoready® en los 12 meses anteriores a la encuesta.
Se incluyó a 105 pacientes con EM (65 pacientes con terapia previa con TME y 40 pacientes naïve) 1 .
#Dosis iniciales en las semanas 0, 1 y 2, seguidas de dosis mensuales posteriores, comenzando en la semana 45.
EM: esclerosis múltiple; EMR: esclerosis múltiple recurrente; EMRR: esclerosis múltiple recurrente remitente; EMSP: esclerosis múltiple secundaria progresiva; IPT: informe de posicionamiento terapéutico; sc: subcutánea; SNS: Sistema Nacional de Salud; TME: tratamiento modificador de la enfermedad.
▼ Este medicamento está sujeto a seguimiento adicional, es prioritaria la notificación de sospechas de reacciones adversas asociadas a este medicamento. KESIMPTA® está financiado en 1ª línea para EMR con enfermedad activa en los casos de pacientes con una enfermedad de curso rápido y agresivo, y/o en presencia de factores de mal pronóstico, y en 2ª línea como alternativa para pacientes con EMRR o EMSP con enfermedad activa que no respondan al menos a un tratamiento modificador de la enfermedad de moderada eficacia4.
Precio y condiciones de financiación, prescripción y dispensación:
Con receta médica. Diagnóstico hospitalario. Reembolsado por el SNS, se limita su dispensación, sin necesidad de visado, a los pacientes no hospitalizados, en los Servicios de Farmacia de los hospitales; por tanto, irá desprovisto de cupón precinto. PVLn KESIMPTA® 20 mg solución inyectable en pluma precargada, 1 pluma 1.735 €.