▼ Este medicamento está sujeto a seguimiento adicional, es prioritaria la notificación de sospechas adversas asociadas a este medicamento.


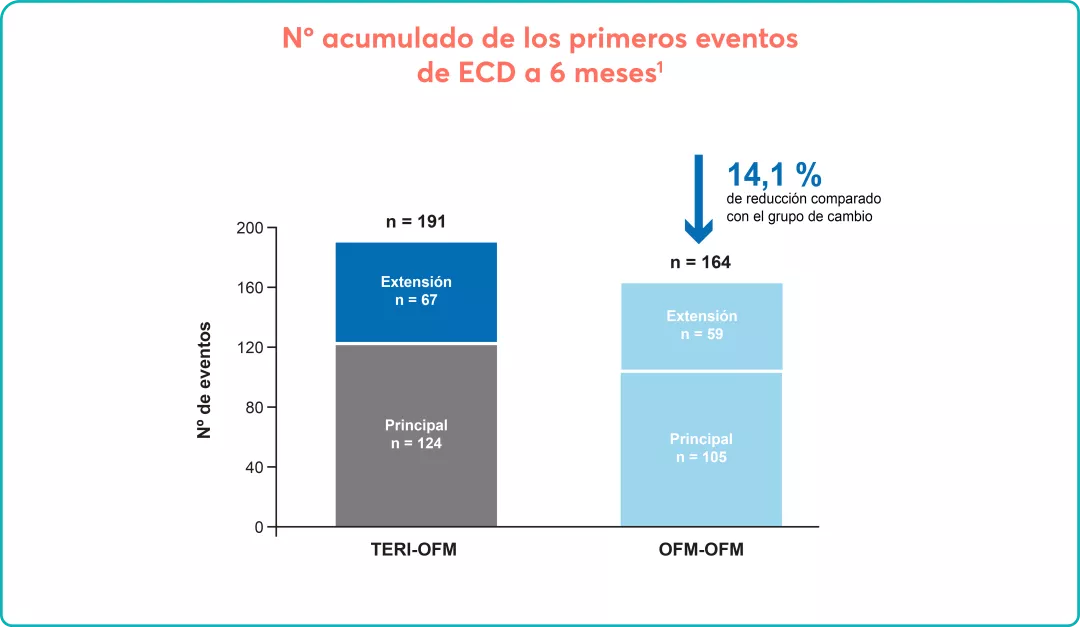
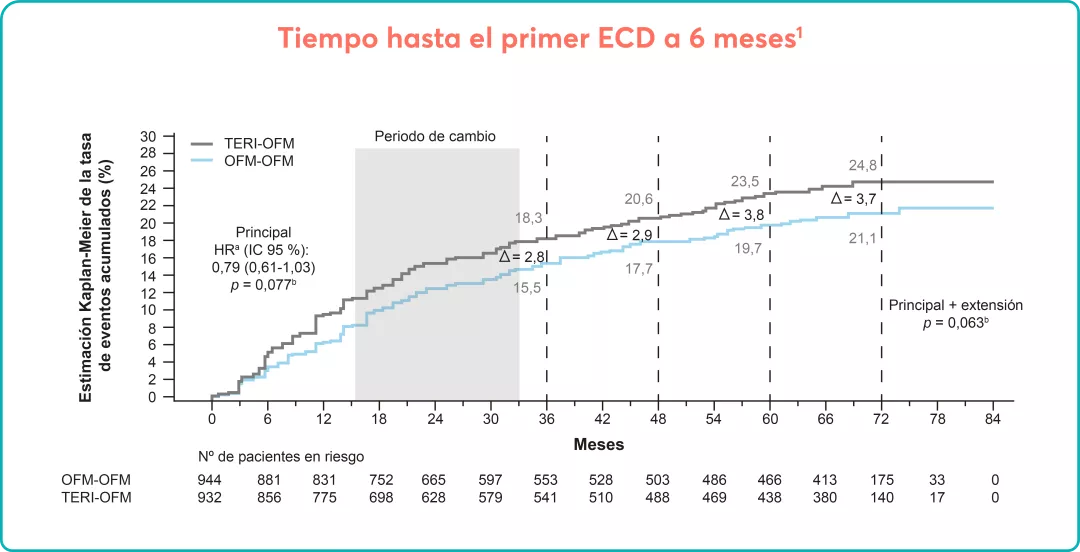
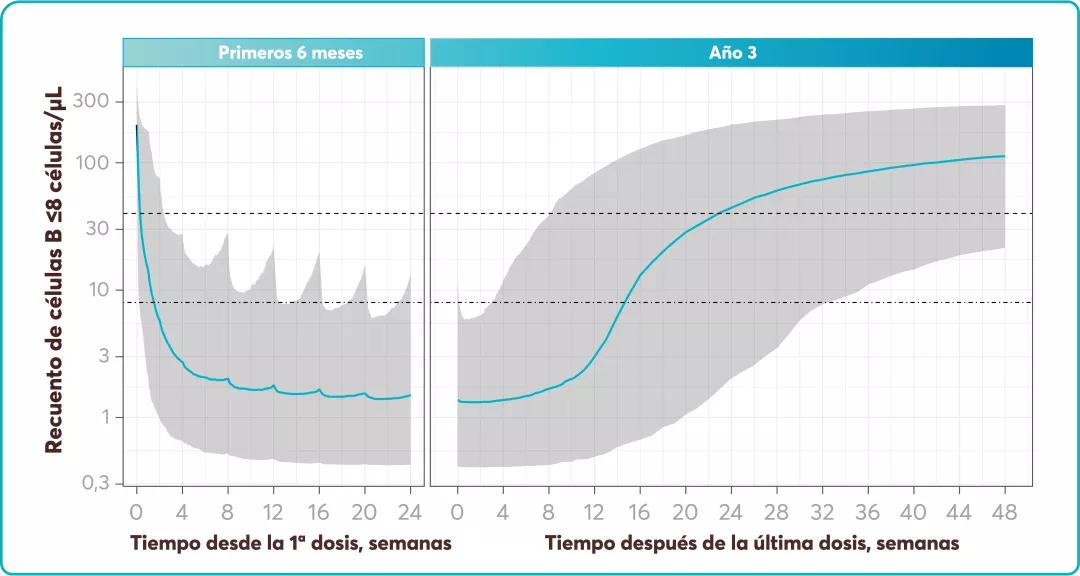
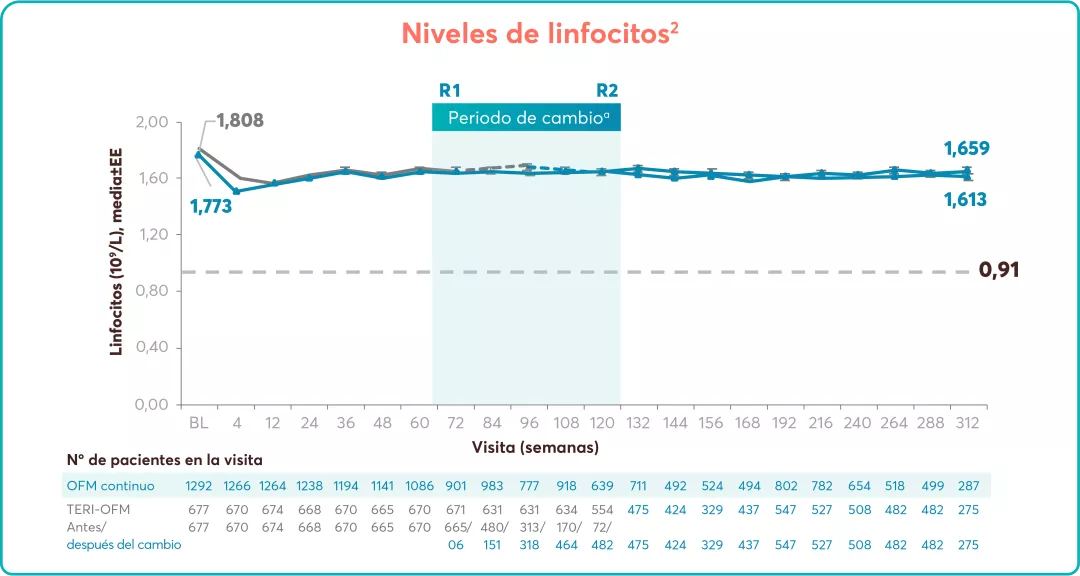
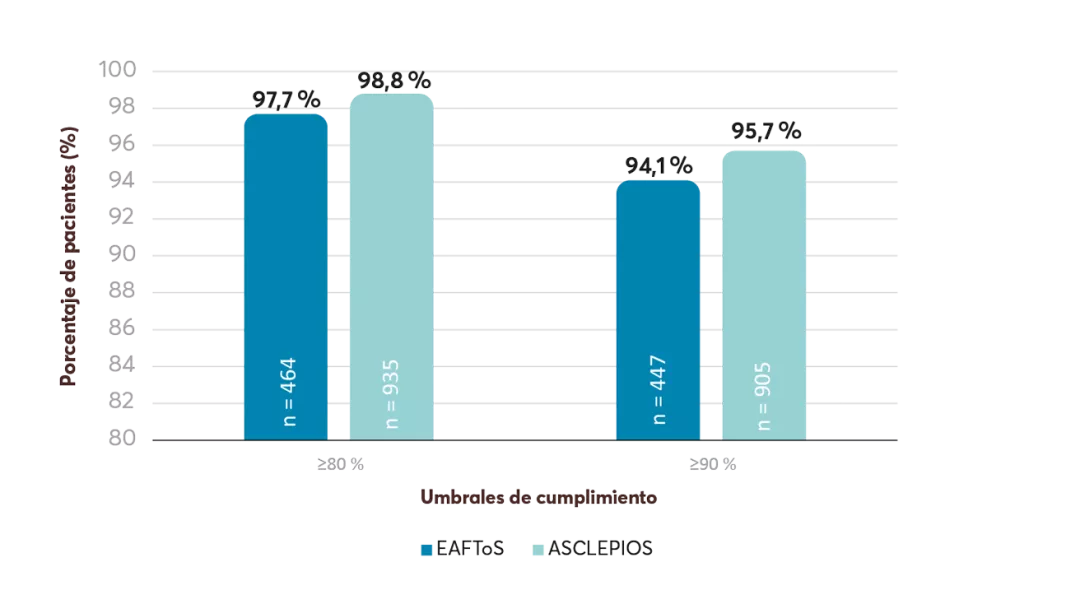
En los estudios ASCLEPIOS7:





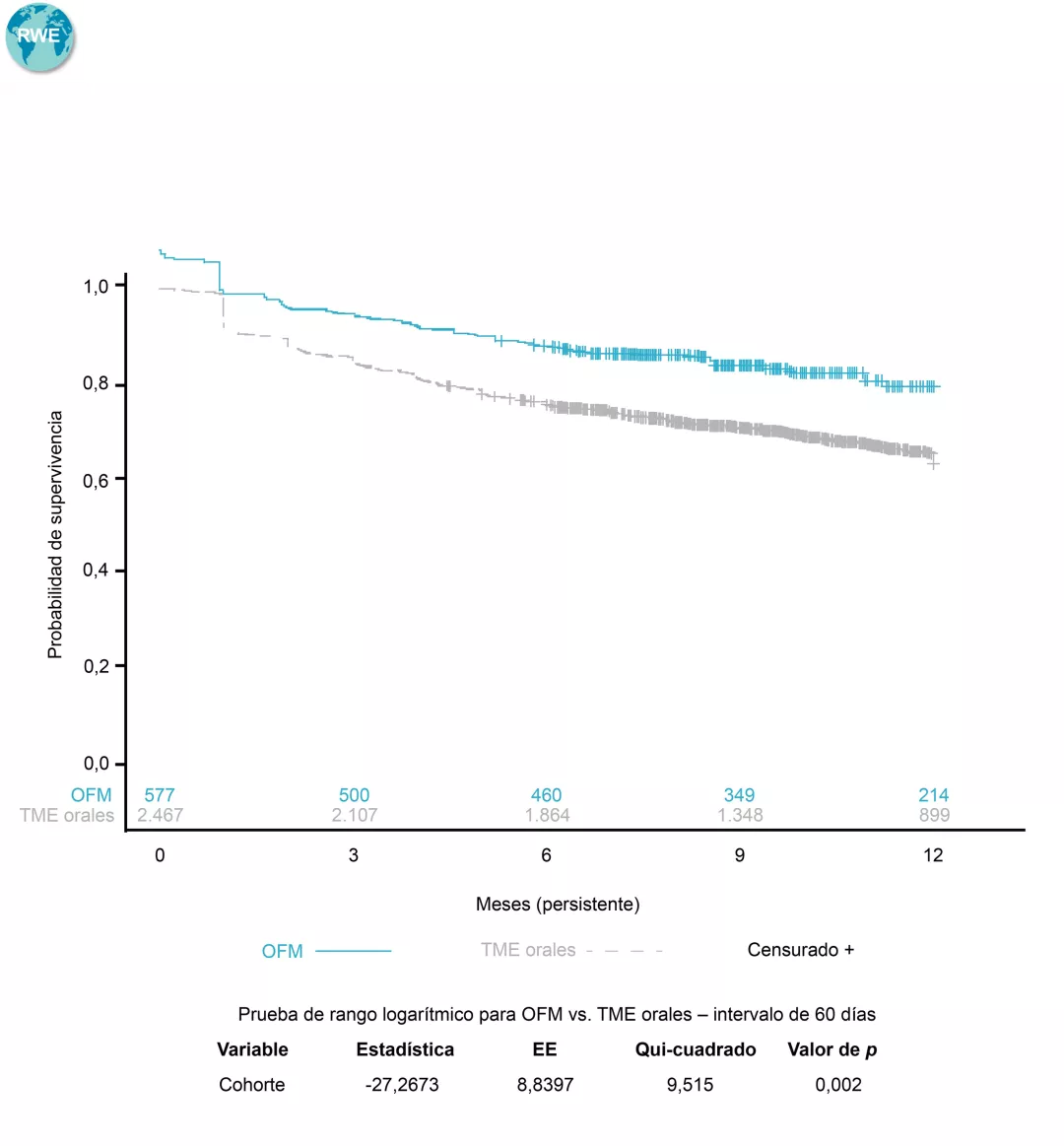
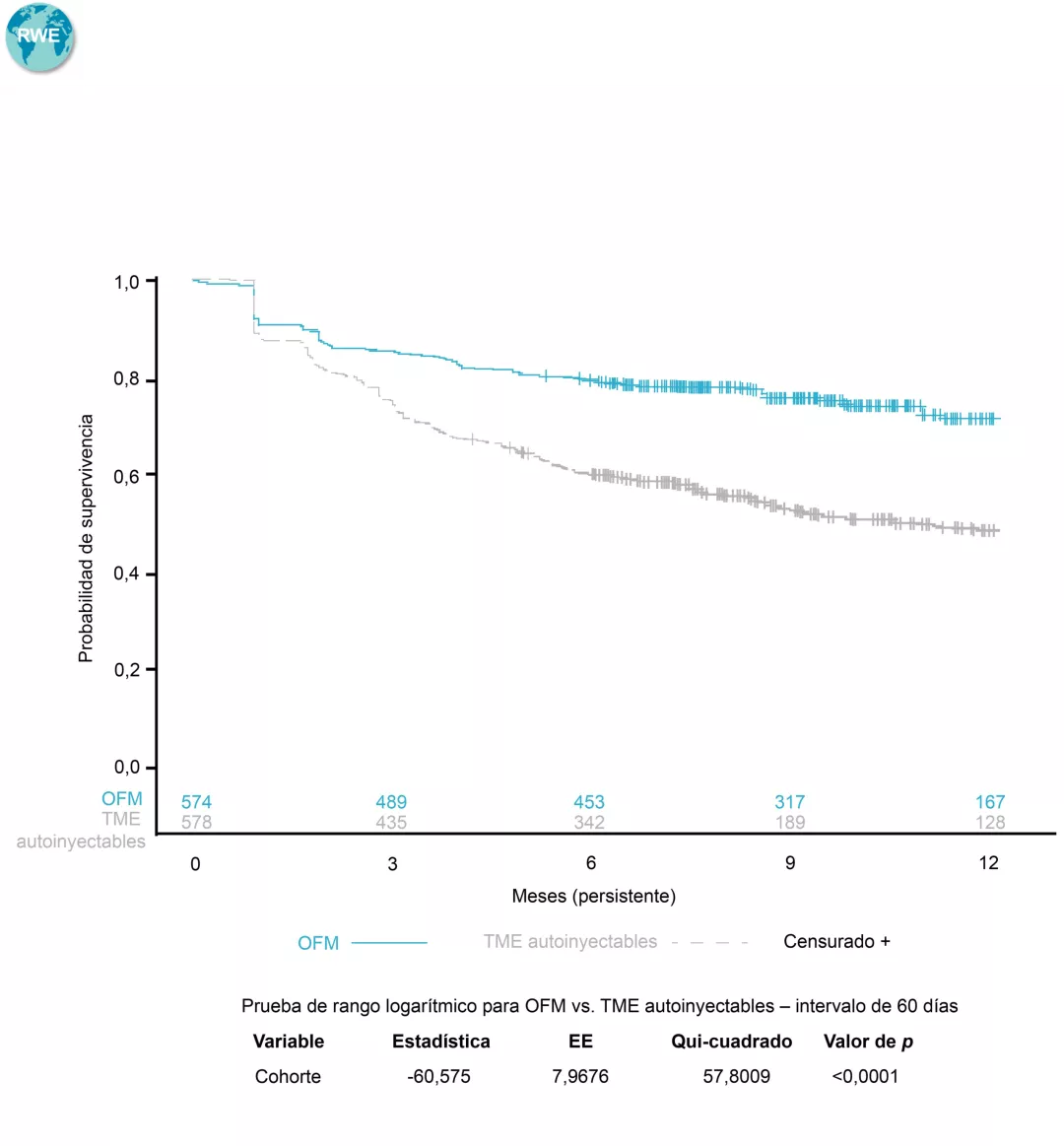
Con ▼ KESIMPTA®, mejor persistencia$ y adherencia# comparado con los TME autoinyectables, y mejor persistencia comparado con los TME orales en práctica clínica real8
Persistencia KESIMPTA® vs. TME autoinyectables$8
Persistencia KESIMPTA® vs. TME orales$8
Adherencia KESIMPTA® vs. TME autoinyectables#8
Adherencia KESIMPTA® vs. TME orales#8
Elevada persistencia con KESIMPTA®, otros datos en práctica clínica real:

Solo 2 pacientes (2,1 %) discontinuaron el tratamiento tras un seguimiento mínimo de 12 meses9.

A los 12 meses, el 90 % de los pacientes seguían con KESIMPTA®10

Persistencia del 97,1 % a 1 año y 94,3 % a los 2 años11.
KESIMPTA® ha demostrado una persistencia robusta en práctica clínica real9-11
Referencias
Ross AP, et al. Real-world satisfaction and experience with injection and autoinjector device for ofatumumab indicated for multiple sclerosis. BMC Neurol. 2025;25(1):28
Ross AP, et al. Patient and nurse preference for Sensoready autoinjector pen versus other autoinjectors in multiple sclerosis: results from a pilot multicenter survey. BMC Neurol. 2023;23(1):85
Hauser SL, et al. The Developmen tof Ofatumumab, a Fully Human Anti-CD20 Monoclonal Antibody for Practical Use in Relapsing Multiple SclerosisTreatment. Neurol Ther. 2023;12:1491-1515
nforme de posicionamiento terapéutico de ofatumumab (KESIMPTA®) en el tratamiento de pacientes adultos con Esclerosis Múltiple Recurrente. Informe de posicionamiento terapéutico IPT 88-2023/V1/12012023. Disponible en: https://www.aemps.gob.es/medicamentosUsoHumano/informesPublicos/docs/2023/IPT-088-2023-Kesimpta.pdf
Ficha técnica de KESIMPTA®
Hengstman G, et al. Assessment of Patients Experiences With Ofatumumab in Multiple Sclerosis: Findings From a Market Research Survey Conducted in the Netherlands. Abstract Number: 648/P1640. 9th Joint ECTRIMS ACTRIMS Meeting, 11-13 de octubre, 2023. Milán, Italia
Van Der Walt A, et al. Characterizing the use of ofatumumab in a real world setting (EAFToS): Secondary Use of Data Study characterizing ofatumumab onboarding and utilization in relapsing multiple sclerosis patients using MSGo: Part I 2nd Interim Analysis. Póster P746 presentado en: 9th Joint ECTRIMS ACTRIMS Meeting, 11-13 de octubre, 2023. Milán, Italia. Disponible en: https:/ www.medcommshydhosting.comMSKnowledgecenterectrims/2023PostersCharacterizingupto2yearsOfOfatumumabOnboardingAndUtilization_ Vander_Walt_Aetal_P746.pdf
Hersh CM, et al. Real-world persistence and adherence of ofatumumab versus oral and injectable disease modifying therapies in patients with multiple sclerosis. Mult Scler Relat Disord. 2024;91:105888
Morales EA, et al. A Cross Sectional Study to Assess the Effectiveness and Safety of Ofatumumab in Patients with Relapsing Multiple Sclerosis in Clinical Practice: Interim Analysis of the CRONOS MS Study. Póster P397 presentado en: ACTRIMS Forum 2025, 27 de febrero-1 de marzo, 2025. West Palm Beach, FL. EEUU. Disponible en: https://www.medcommshydhosting.com/MSKnowledgecenter/actrims/2025/Posters/P397_A_Cross-Sectional_Study_to_Assess_the_Effectiveness_Poster.pdf
Clinical Practice: Interim Analysis of the CRONOS MS Study. Póster P397 presentado en: ACTRIMS Forum 2025, 27 de febrero-1 de marzo, 2025. West Palm Beach, FL. EEUU. Disponible en: https://www.medcommshydhosting.com/MSKnowledgecenter/actrims/2025/Posters/P397_A_Cross-Sectional_Study_to_Assess_the_Effectiveness_Poster.pdf
Amin M, et al. Real-world effectiveness, tolerability and safety ofofatumumab at 12-month follow-up. Abstract Number: 964/P1559. 9th Joint ECTRIMS ACTRIMS Meeting, 11-13 de octubre, 2023. Milán, Italia
Barnett M, et al. Real-world Australian experience with Ofatumumab in the MSBase Registry. Abstract Number: 814/P1707. ECTRIMS Meeting, 18-20 de septiembre, 2024. Copenhague, Dinamarca.
*La primera dosis ha de administrarse bajo la guía de un profesional sanitario5.
‡ Encuesta de investigación de mercado en los Países Bajos desde abril de 2022 hasta abril de 2023 a través de un cuestionario en línea, completado por 53 pacientes6.
**Los motivos de interrupción fueron EA (n = 10), elección del paciente (n = 21), falta de eficacia (n = 1), desconocido (n = 1), otros (n = 8)7 .
$Determinada en base al tiempo hasta la discontinuación del tratamiento, definido como un intervalo >60 días en el tratamiento con el medicamento índice (intervalo entre la última fecha de suministro, en función de la duración esperada del tratamiento o los días de suministro, y la próxima fecha de reclamación para el tratamiento índice), o el cambio a un nuevo TME. La persistencia se estimó mediante los métodos de Kaplan-Meier. El valor de p se calculó a partir de la prueba de rango logarítmico8.
#La adherencia se definió como tener una proporción de días cubiertos ≥0,8 entre los pacientes con seguimiento disponible durante el periodo de tiempo medido. Los pacientes con una proporción de días cubiertos <0,8 se consideraron no adherentes8.
EA: eventos adversos; EM: esclerosis múltiple; EMR: esclerosis múltiple recurrente; EMRR: esclerosis múltiple recurrente remitente; EMSP: esclerosis múltiple secundaria progresiva; IPT: informe de posicionamiento terapéutico; SNS: Sistema Nacional de Salud; TME: tratamientos modificadores de la enfermedad.
▼ Este medicamento está sujeto a seguimiento adicional, es prioritaria la notificación de sospechas de reacciones adversas asociadas a este medicamento.
KESIMPTA® está financiado en 1ª línea para EMR con enfermedad activa en los casos de pacientes con una enfermedad de curso rápido y agresivo, y/o en presencia de factores de mal pronóstico, y en 2ª línea como alternativa para pacientes con EMRR o EMSP con enfermedad activa que no respondan al menos a un tratamiento modificador de la enfermedad de moderada eficacia4.
Precio y condiciones de financiación, prescripción y dispensación:
Con receta médica. Diagnóstico hospitalario. Reembolsado por el SNS, se limita su dispensación, sin necesidad de visado, a los pacientes no hospitalizados, en los Servicios de Farmacia de los hospitales; por tanto, irá desprovisto de cupón precinto. PVLn KESIMPTA® 20 mg solución inyectable en pluma precargada, 1 pluma 1.735 €.