Facilidad
En este apartado podrás encontrar datos sobre la facilidad de KESIMPTA® 1 , para el paciente, datos de satisfacción y usabilidad de la pluma Sensoready®, y beneficios para el día a día del paciente1,2. KESIMPTA® es el único tratamiento anti-CD20 específicamente diseñado, testado y aprobado para la autoadministración en pacientes con EMR activa3,4.

Alta eficacia4 autoadministrable*5: los pacientes pueden autoadministrarse KESIMPTA® de forma segura y cómoda3
La autoadministración de KESIMPTA® es preferida por los pacientes y profesionales de la salud2
En una encuesta en los Países Bajos‡6:
La mayoría de los pacientes que cambiaron a KESIMPTA® tenían una fuerte preferencia por el tratamiento en casa.
El >90 % de los pacientes valoraron positivamente la experiencia con KESIMPTA® en términos de facilidad de uso y administración.
Descubre más sobre la facilidad de usar KESIMPTA® en el vídeo a continuación, de la mano de la Dra. Celia Oreja-Guevara, jefa de la Sección de Neurología del Hospital Clínico San Carlos de Madrid, centro de referencia (CSUR) de EM.
Referencias
Ross AP, et al. Real-world satisfaction and experience with injection and autoinjector device for ofatumumab indicated for multiple sclerosis. BMC Neurol. 2025;25(1):28
Ross AP, et al. Patient and nurse preference for Sensoready autoinjector pen versus other autoinjectors in multiple sclerosis: results from a pilot multicenter survey. BMC Neurol. 2023;23(1):85
Hauser SL, et al. The Developmen tof Ofatumumab, a Fully Human Anti-CD20 Monoclonal Antibody for Practical Use in Relapsing Multiple SclerosisTreatment. Neurol Ther. 2023;12:1491-1515
nforme de posicionamiento terapéutico de ofatumumab (KESIMPTA®) en el tratamiento de pacientes adultos con Esclerosis Múltiple Recurrente. Informe de posicionamiento terapéutico IPT 88-2023/V1/12012023. Disponible en: https://www.aemps.gob.es/medicamentosUsoHumano/informesPublicos/docs/2023/IPT-088-2023-Kesimpta.pdf
Ficha técnica de KESIMPTA®
Hengstman G, et al. Assessment of Patients Experiences With Ofatumumab in Multiple Sclerosis: Findings From a Market Research Survey Conducted in the Netherlands. Abstract Number: 648/P1640. 9th Joint ECTRIMS ACTRIMS Meeting, 11-13 de octubre, 2023. Milán, Italia
*La primera dosis ha de administrarse bajo la guía de un profesional sanitario5.
‡ Encuesta de investigación de mercado en los Países Bajos desde abril de 2022 hasta abril de 2023 a través de un cuestionario en línea, completado por 53 pacientes6.
**Los motivos de interrupción fueron EA (n = 10), elección del paciente (n = 21), falta de eficacia (n = 1), desconocido (n = 1), otros (n = 8)7 .
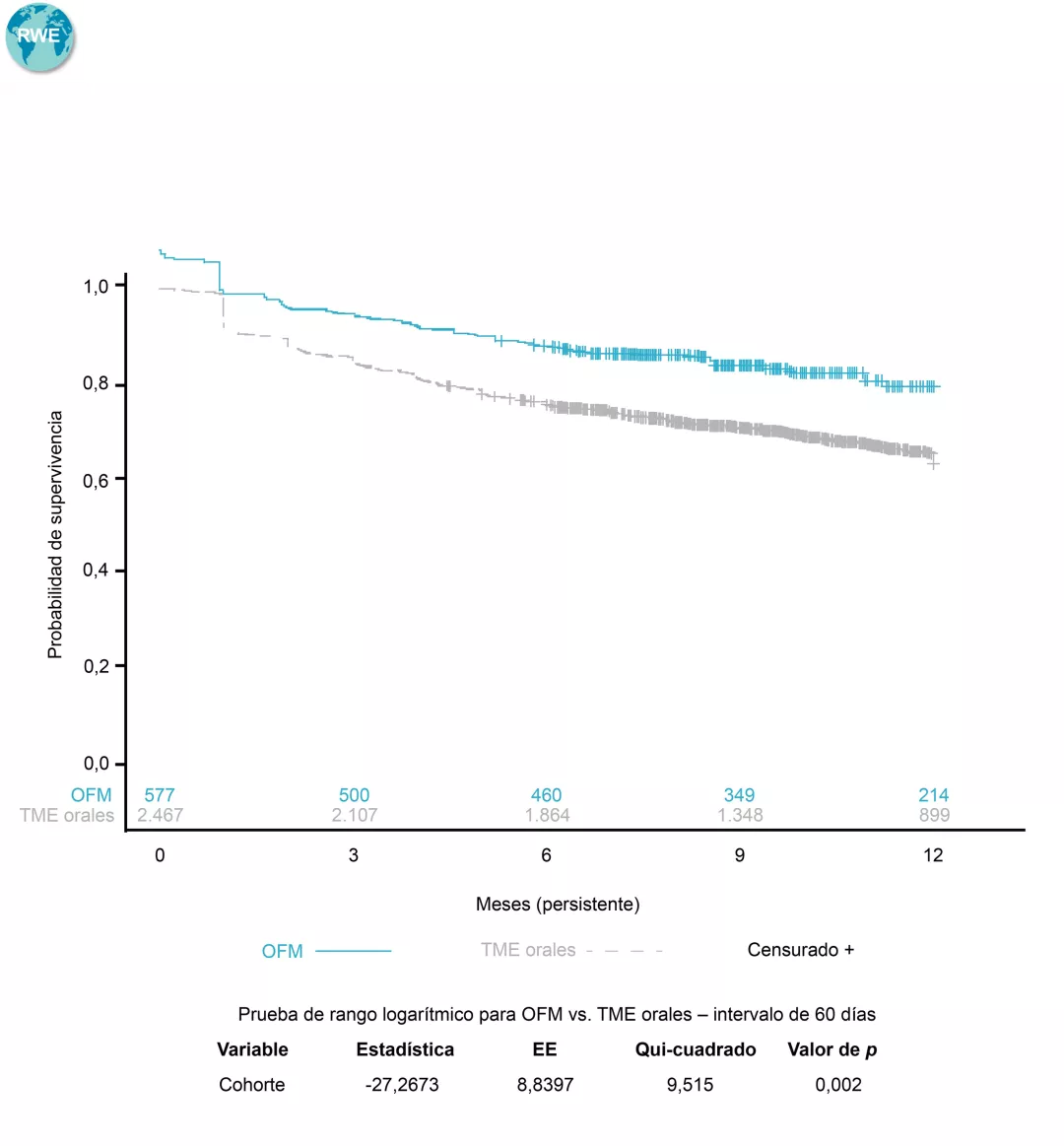
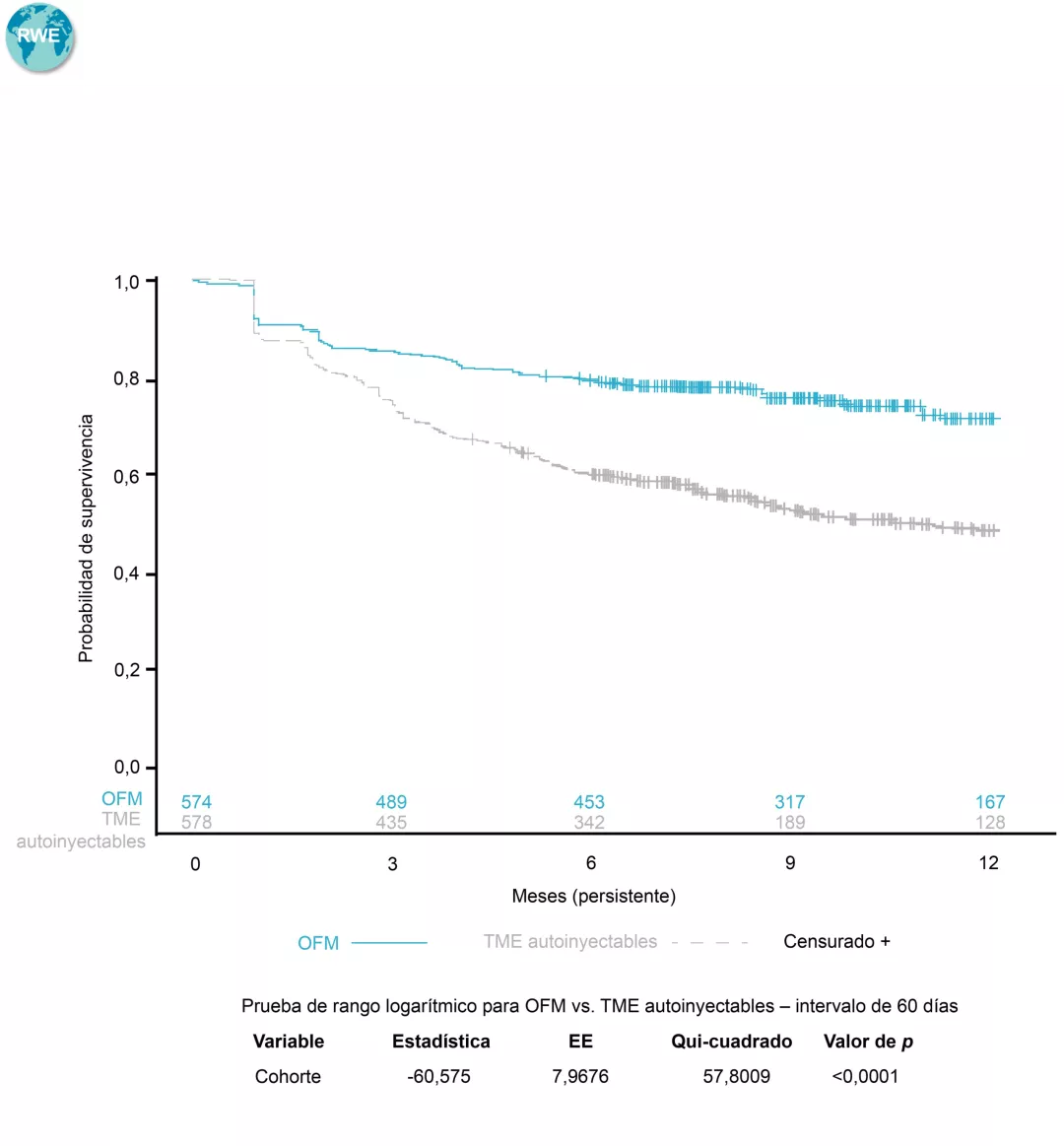
$Determinada en base al tiempo hasta la discontinuación del tratamiento, definido como un intervalo >60 días en el tratamiento con el medicamento índice (intervalo entre la última fecha de suministro, en función de la duración esperada del tratamiento o los días de suministro, y la próxima fecha de reclamación para el tratamiento índice), o el cambio a un nuevo TME. La persistencia se estimó mediante los métodos de Kaplan-Meier. El valor de p se calculó a partir de la prueba de rango logarítmico8.
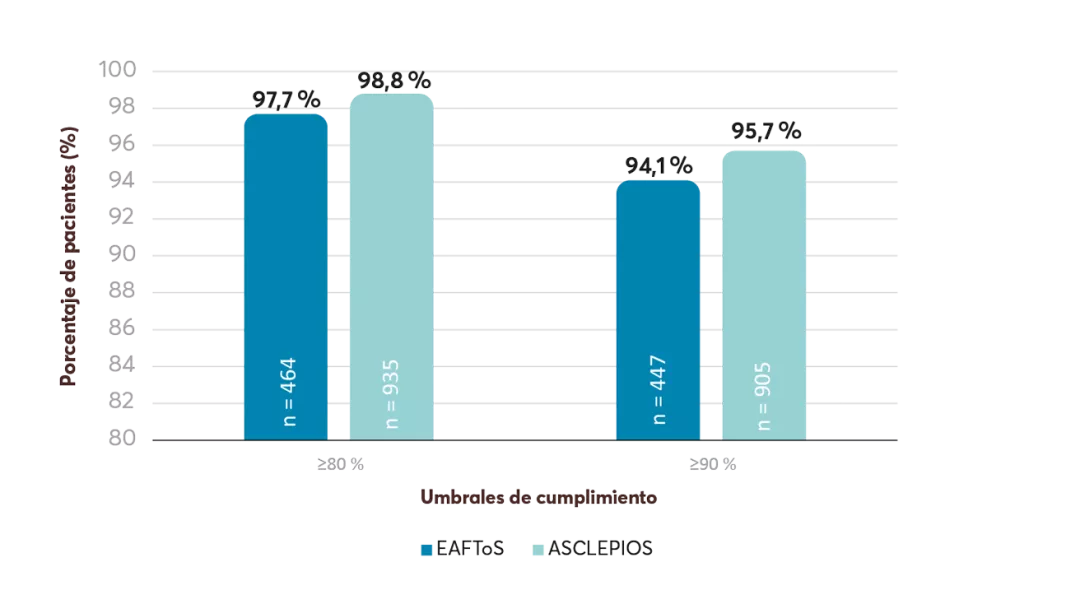
#La adherencia se definió como tener una proporción de días cubiertos ≥0,8 entre los pacientes con seguimiento disponible durante el periodo de tiempo medido. Los pacientes con una proporción de días cubiertos <0,8 se consideraron no adherentes8.
EA: eventos adversos; EM: esclerosis múltiple; EMR: esclerosis múltiple recurrente; EMRR: esclerosis múltiple recurrente remitente; EMSP: esclerosis múltiple secundaria progresiva; IPT: informe de posicionamiento terapéutico; SNS: Sistema Nacional de Salud; TME: tratamientos modificadores de la enfermedad.