Schwere Aplastische Anämie (sAA)
1. Pathophysiologie
2. Epidemiologie
3. Symptome
4. Diagnostik und Klassifikation
Probe | Eigenschaft |
Knochenmark-aspirat | Kann ohne Thrombozytenunterstützung durchgeführt werden, unter der Bedingung, dass ein geeigneter Oberflächendruck appliziert wird6, sogar bei schwerer Thrombozytopenie. Schwierigkeiten Fragmente zu erhalten kann auf eine Knochenmarksfibrose oder Infiltration hinweisen und sollte den Verdacht auf eine andere Diagnose als aplastische Anämie erwecken. Bei aplastischer Anämie sind die Fragmente und Spuren hypozellular mit prominenten Fett-Bereichen und einer variablen Anzahl residualer hämatopoetischer Zellen. Erythropoese is reduziert oder abwesend; Dyserythropoese ist sehr häufig, oft deutlich und unterscheidet nicht zwischen MDS und aplastischer Anämie. Megakaryozyten und granulozytäre Zellen sind deutlich reduziert oder abwesend. Dysplatische Megakaryozyten und granulozytäre Zellen sind in der aplastischen Anämie nicht sichtbar. Lymphozyten, Macrophagen, Plasmazellen und Mastzellen erscheinen oft prominent. In den frühen Phasen der Krankheit können verstärkt Macrophagen mit wenig Hämophagozytose und eine eosinophile Färbung des Hintergrundes auftreten, was interstitielle Ödeme repräsentiert. |
Zytogenetische und FISH Analyse | Eine Karyotypisierung kann bei sehr hypozellulärem Knochenmark mit unzureichenden Metaphasen scheitern. In dieser Situation sollte eine FISH Analyse der Chromosomen 5, 7, 8 und 13 durchgeführt werden. Es wurde zuvor angenommen, dass die Anwesenheit von abnormalen zytogenetischen Klonen eine Diagnose des MDS und nicht der aplastischen Anämie indiziert. Jedoch ist es nun bewiesen, dass abnormale zytogenetische Klone (wie del(13q), Trisomie 8 und andere), welche transient sein können, in bis zu 12% der Patienten mit ansonsten typischer aplastischer Anämie bei Diagnose auftreten können.7,8 Obwohl eine Monosomie 7 bei Kindern für die Möglichkeit des MDS spricht, kann eine Monosomie 7 bei Erwachsenen auch bei der aplastischen Anämie beobachtet werden. Abnormale zytogenetische Klone können im Verlauf der Krankheit auftreten und neue zytogenetische Abnormalitäten können eine klonale Evolution belegen.9 |
Trepan Knochenmark-biopsie | Eine Trepan Biopsie von mindestens 2 cm und guter Qualität ist essentiell, um die Gesamtzellularität und Morphologie der residualen hämatopoetischen Zellen zu bestimmen und abnormale Infiltrate auszuschliessen. Es sollte darauf geachtet werden eine tangentiale Biopsie zu vermeiden, da subkortikales Knochenmark normalerweise hypozellulär ist. In den meisten Fällen ist die Biopsie Probe durchweg hypozellular; manchmal ist die Hypozellularität ungleichmässig mit sowohl hypozellulären als auch verbleibenden zellulären Bereichen. Eine fokale Hyperplasie von erythroiden und granulozytären Zellen in ähnlichem Stadium der Reife könnte beobachtet werden. Kleine lymphoide Aggregate können auftreten, vor allem in der akuten Phase der Krankheit und wenn die aplastische Anämie mit systemischen autoimmun Erkrankungen assoziiert ist, wie rheumatoide Arthritis oder systemischer Lupus erythematosus. Erhöhte Retikulin Färbung, dysplastische Megakaryozyten (am besten bewertet durch Immunhistochemie) und Blasten sind bei der aplastischen Anämie nicht sichtbar und deren Anwesenheit deutet entweder auf ein hypoplastisches MDS oder die Entwicklung zur Leukämie hin.10 |
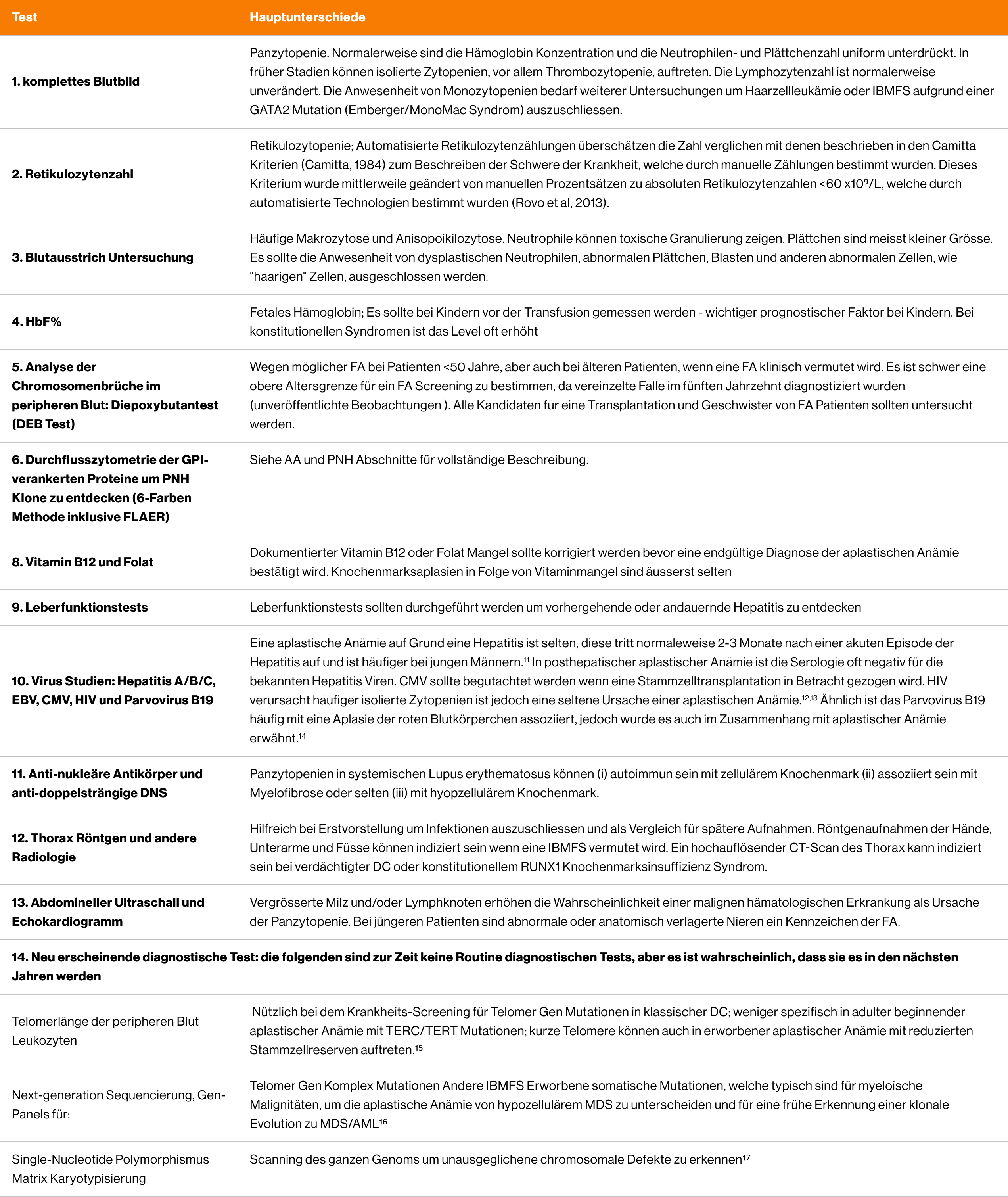
Parameter | Beschreibung | Anmerkungen |
Blutbild | Bi-/Panzytopenie | Anämie häufig normozytär / normochrom, manchmal mässig makrozytär und mit unauffälliger Erythrozytenmorphologie Leukozytopenie durch Granulozytopenie und Monozytopenie, häufig keine unreifen granulozytären Vorstufen im Blut Fehlen von Riesenthrombozyten im Blutausstrich |
Knochenmark | Aplasie oder Hypoplasie Zellularität <25 % in der Histologie ohne Infiltration mit neoplastischen Zellen ohne Fibrose | Knochenmarkaspirat und Knochenmarkbiopsie obligat Biopsielänge mindestens 15 mm nicht selten fleckförmige Verminderung der Markzelldichte, „fleckförmige Panmyelopathie“, erythropoetische „hot spots“ |
Kriterium | nSAA | SAA2 | vSAA1 |
neutrophile Granulozyten | <1,2 x109/L | <0,5 x109/L | <0.2 x109/L2 |
Thrombozyten | <70 x109/L | <20 x109/L | <20 x109/L |
Retikulozyten | <60 x109/L | <20 x109/L | <20 x109/L |
5. Behandlung
Referenzen
Schrezenmeier H et al. Onkopedia Leitlinien: Aplastische Anämie. (Stand November 2022); https://www.onkopedia.com/de/onkopedia/guidelines/aplastische-anaemie/@@guideline/html/index.html (Letzter Zugriff am 26.07.2023).
Townsley DM et al. Pathophysiology and management of thrombocytopenia in bone marrow failure: possible clinical applications of TPO receptor agonists in aplastic anemia and myelodysplastic syndromes. Int J Hematol. 2013; 98(1): 48–55.
Boddu PC et al. Molecular pathogenesis of acquired aplastic anemia. European Journal of Haematology. 2019; 102(2): 103–10.
Killick SB et al. Guidelines for the diagnosis and management of adult aplastic anaemia. British Journal of Haematology. 2016; 172(2): 187–207.
Dokal I et al. Inherited aplastic anaemias/bone marrow failure syndromes. Blood Rev. 2008; 22(3): 141–53.
British Committee for Standards in Haematology, Blood Transfusion Task Force. Guidelines for the use of platelet transfusions. Br J Haematol. 2003; 122(1): 10–23.
Gupta V et al. Clinical relevance of cytogenetic abnormalities at diagnosis of acquired aplastic anaemia in adults. Br J Haematol. 2006; 134(1): 95–9.
Afable MG et al. Clonal evolution in aplastic anemia. Hematology Am Soc Hematol Educ Program. 2011; 2011: 90–5.
Maciejewski JP et al. Distinct clinical outcomes for cytogenetic abnormalities evolving from aplastic anemia. Blood. 2002; 99(9): 3129–35.
Bennett JM et al. Diagnostic criteria to distinguish hypocellular acute myeloid leukemia from hypocellular myelodysplastic syndromes and aplastic anemia: recommendations for a standardized approach. Haematologica. 2009; 94(2): 264–8.
Brown KE et al. Hepatitis-associated aplastic anemia. N Engl J Med. 1997; 336(15): 1059–64.
Wolf T et al. First case of successful allogeneic stem cell transplantation in an HIV-patient who acquired severe aplastic anemia. Haematologica. 2007; 92(4): e56-58.
Hapgood G et al. Immune-mediated cytopenias in human immunodeficiency virus: the first reported case of idiopathic aplastic anaemia successfully treated with immunosuppression. Intern Med J. 2013; 43(4): 452–5.
Mishra B et al. Human parvovirus B19 in patients with aplastic anemia. Am J Hematol. 2005; 79(2): 166–7.
Townsley DM et al. Bone marrow failure and the telomeropathies. Blood. 2014; 124(18): 2775–83.
Kulasekararaj AG et al. Somatic mutations identify a subgroup of aplastic anemia patients who progress to myelodysplastic syndrome. Blood. 2014; 124(17): 2698–704.
Afable MG et al. SNP array-based karyotyping: differences and similarities between aplastic anemia and hypocellular myelodysplastic syndromes. Blood. 2011; 117(25): 6876–84.
Young NS. Aplastic Anemia. New England Journal of Medicine. Massachusetts Medical Society; 2018;
https://www.onmeda.de/krankheiten/aplastische-anaemie-id202725/ (last accessed 08. Aug 2023)



