Αιτιοπαθογένεια
Η διαπυητική ιδρωταδενίτιδα (ΔΙ) φαίνεται πως είναι μία αυτοφλεγμονώδης πάθηση με βασικό χαρακτηριστικό την κερατινοποίηση, κατά την οποία, η αντιγονο-ανεξάρτητη φλεγμονή θεωρείται ότι είναι ο κύριος «οδηγός» κατά την εξελικτική διαδικασία της νόσου1. Είναι πλέον σαφές ότι η ΔΙ δε συνιστά μία μολυσματική ασθένεια, αν και τα βακτήρια διαδραματίζουν σημαντικό ρόλο στην παθοφυσιολογία της 2.
Η υποκείμενη αιτιολογία της ΔΙ παραμένει ασαφής, αλλά είναι γνωστό ότι είναι πολυπαραγοντική, και περιλαμβάνει1,3-6:
- Γενετικές μεταλλάξεις που προδιαθέτουν το άτομο σε διαταραγμένη έμφυτη ανοσία και αυτο-φλεγμονή.
- Ρύθμιση «προς τα πάνω» (upregulation) των επιπέδων διάφορων προ-φλεγμονωδών κυτταροκινών.
- Διαταραχή του μικροβιώματος τοπικά.
- Περιβαλλοντικοί παράγοντες, όπως το κάπνισμα.
- Συννοσηρότητες, συμπεριλαμβανομένης της παχυσαρκίας και των μεταβολικών διαταραχών.
Μία σχηματική απεικόνιση των υποκείμενων παθολογικών συμβάντων που σταδιακά οδηγούν στην ανάπτυξη της ΔΙ παρουσιάζεται στην Εικόνα 1.
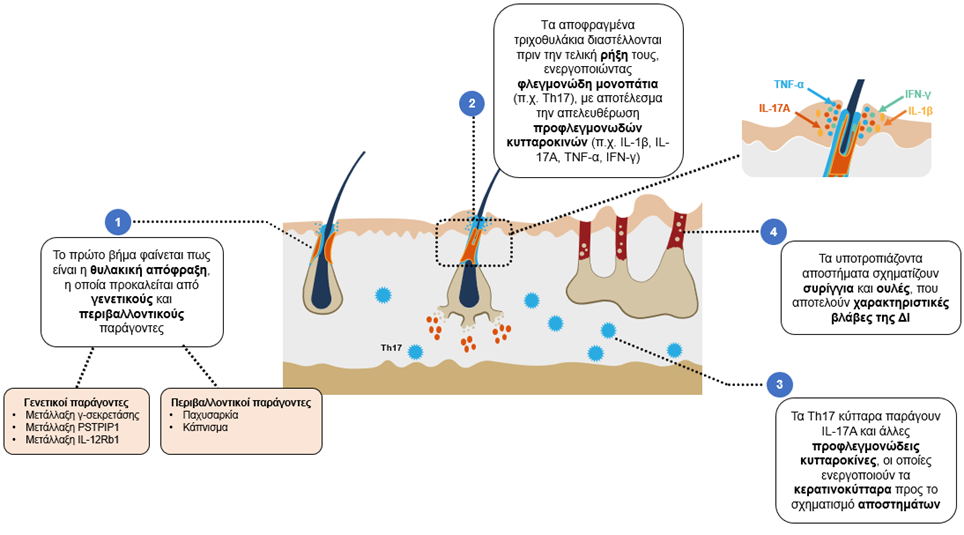
Εικόνα 1: Η σταδιακή απορρύθμιση του ανοσοποιητικού συστήματος συντελει στην απόφραξη, φλεγμονή και προοδευτική καταστροφή των τριχοθυλακίων στη ΔI2,3,7
IFN-γ, interferon-γ; IL, interleukin; PSTPIP1, Proline-serine-threonine phosphatase interacting protein 1; Th, T-helper; TNF-α, tumor necrosis factor α.
Προσαρμογή από: Vossen A, et al. Front Immunol. 2018;14:2965
Αρχικά στάδια ανάπτυξης της νόσου
- Το αρχικό γεγονός στην ανάπτυξη της ΔΙ θεωρείται ότι είναι η θυλακική υπερκεράτωση, που προκύπτει από ένα συνδυασμό γενετικής προδιάθεσης, διαταραχής του μικροβιώματος και περιβαλλοντικών/φυσιολογικών παραγόντων κινδύνου3,12.
- Στη συνέχεια, ο βακτηριακός αποικισμός τοπικά οδηγεί σε απόφραξη και διάταση του θύλακα της τρίχας, ο οποίος τελικά διαρρηγνύεται και απελευθερώνει το περιεχόμενό του στο περιβάλλον χόριο4,6,12.
- Αυτό επάγει μία φλεγμονώδη απόκριση, που περιλαμβάνει τοπικά κύτταρα του ανοσοποιητικού, ιδιαίτερα μακροφάγα και δενδριτικά κύτταρα, τα οποία εκκρίνουν προφλεγμονώδεις κυτταροκίνες, συμπεριλαμβανομένων των ιντερλευκινών (IL)-1β, IL-12, IL-23 και του παράγοντα νέκρωσης όγκων α (tumour necrosis factor alpha, TNF-α)6,12.
Εξέλιξη της νόσου
Η IL-1β διεγείρει τους ινοβλάστες ώστε να παράξουν χημειοκίνες, οι οποίες επάγουν περαιτέρω τη φλεγμονώδη διαδικασία, ενώ ο παράγοντας TNF-α διεγείρει τα κερατινοκύτταρα προς την παραγωγή ενός εύρους χημειοκινών που προσελκύουν ουδετερόφιλα, T κύτταρα και μονοκύτταρα5. Οι IL-23 και IL-12 προάγουν τη διαφοροποίηση των T κυττάρων σε T βοηθητικά (Th)17 και Th1, αντίστοιχα5. Επί απουσίας θεραπείας, η νόσος επιδεινώνεται, με αποτέλεσμα τη μη αναστρέψιμη καταστροφή των ιστών, η οποία περιλαμβάνει το σχηματισμό ουλών και παραγωγικών ή μη συριγγίων4,6,8,9.
Τα Th1 και Th17 κύτταρα παράγουν υψηλά επίπεδα ιντερφερόνης-γ (IFNγ) και IL-17, στο δέρμα ασθενών με ΔΙ, παρόμοια με αυτά που παρατηρούνται στην ψωρίαση8. Τα μόρια αυτά δρουν συνεργιστικά με άλλες κυτταροκίνες προς τη διέγερση της περαιτέρω παραγωγής προφλεγμονωδών κυτταροκινών και χημειοκινών, με αποτέλεσμα το σχηματισμό οζιδίων και αποστημάτων. Τα ουδετερόφιλα στην περιοχή της βλάβης επίσης συμβάλλουν στην παραγωγή προφλεγμονωδών κυτταροκινών8,10. Επιπροσθέτως, τα ουδετερόφιλα παράγουν λιποκαλίνη 2, μία κυτταροκίνη που προκαλεί φλεγμονώδη πόνο και περαιτέρω διήθηση ουδετερόφιλων στον πάσχοντα ιστό, σχηματίζοντας ένα θετικό βρόχο ανατροφοδότησης, που οδηγεί στη χρόνια φλεγμονή10,12.
Καθώς ο ιστός καταστρέφεται, παρουσία αυτού του προφλεγμονώδους περιβάλλοντος, δύναται να προαχθεί η ανάπτυξη μη αναστρέψιμων επιθηλιακών συριγγίων, αλλά και η πάχυνση της μεσοθυλακικής επιδερμίδας, επιπρόσθετα του σχηματισμού φλεγμονωδών οζιδίων ή/και αποστημάτων10. Αποκορύφωμα της ενεργοποίησης αυτών των ανοσολογικών οδών, είναι η διαταραγμένη άμυνα έναντι παθογόνων μικροοργανισμών, η αποδόμηση της εξωκυττάριας μήτρας του δέρματος, ο σχηματισμός πύου και η προοδευτική καταστροφή των ιστών10,12.
Αν και η παθοφυσιολογία της ΔΙ δεν έχει διασαφηνιστεί πλήρως, ο παράγοντας νέκρωσης όγκων α (TNF-α) και η ιντερλευκίνη (IL) -17 διαδραματίζουν κυρίαρχο ρόλο. H στόχευση της πρώιμης φλεγμονώδους φάσης της ΔΙ θεωρείται ως βασικό στοιχείο της διαχείρισης της νόσου για να αποτρέψει τη μη αναστρέψιμη καταστροφή των ιστών11-12
Μία συνοπτική περιγραφή της παθοφυσιολογίας της ΔΙ παρουσιάζεται στο Βίντεο 1.
Βίντεο 1: Οι φλεγμονώδεις βλάβες της ΔΙ, οι πιθανές αιτίες και η τρέχουσα γνώση αναφορικά με την παθογένειά της.
Βιβλιογραφία
1. Frew JW. Hidradenitis suppurativa is an autoinflammatory keratinization disease: A review of the clinical, histologic, and molecular evidence. JAAD Int. 2020;1(1):62-72.
2. Napolitano M, Megna M, Timoshchuk EA, Patruno C, Balato N, Fabbrocini G, et al. Hidradenitis suppurativa: From pathogenesis to diagnosis and treatment. Clinical, Cosmetic and Investigational Dermatology. 2017;10:105-115.
3. Vossen ARJV, van der Zee HH, Prens EP. Hidradenitis Suppurativa: A Systematic Review Integrating Inflammatory Pathways Into a Cohesive Pathogenic Model. Frontiers in Immunology. 2018;9.
4. Garg A, Naik HB, Kirby JS. A Practical Guide for Primary Care Providers on Timely Diagnosis and Comprehensive Care Strategies for Hidradenitis Suppurativa. Am J Med. 2018.
5. Amat-Samaranch V, Agut-Busquet E, Vilarrasa E, Puig L. New perspectives on the treatment of hidradenitis suppurativa. Ther Adv Chronic Dis. 2021;12:20406223211055920.
6. Goldburg SR, Strober BE, Payette MJ. Hidradenitis suppurativa: Epidemiology, clinical presentation, and pathogenesis. J Am Acad Dermatol. 2020;82(5):1045-1058.
7. Fletcher JM, Moran B, Petrasca A, Smith CM. IL-17 in inflammatory skin diseases psoriasis and hidradenitis suppurativa. Clin Exp Immunol. 2020 Aug;201(2):121-134.
8. Wolk K, Join-Lambert O, Sabat R. Aetiology and pathogenesis of hidradenitis suppurativa. British Journal of Dermatology. 2020;183(6):999-1010.
9. Zouboulis CC, Benhadou F, Byrd AS, Chandran NS, Giamarellos-Bourboulis EJ, Fabbrocini G, et al. What causes hidradenitis suppurativa ?—15 years after. Experimental Dermatology. 2020;29(12):1154-1170.
10.Krueger JG, Frew J, Jemec GBE, Kimball AB, Kirby B, Bechara FG, Navrazhina K, Prens E, Reich K, Cullen E, Wolk K. Hidradenitis suppurativa: new insights into disease mechanisms and an evolving treatment landscape. Br J Dermatol. 2024 Jan 23;190(2):149-162.
11. Sabat R, Jemec GBE, Matusiak Ł, Kimball AB, Prens E, Wolk K. Hidradenitis suppurativa. Nature Rev Dis Primers. 2020;6(1).
12. van Straalen KR, Prens EP, Gudjonsson JE. Insights into hidradenitis suppurativa. J Allergy Clin Immunol. 2022 Apr;149(4):1150-1161.

