Nefropatía IgA
La nefropatía por IgA (NIgA) es una enfermedad renal autoinmune rara, progresiva y heterogénea, causada por la formación y deposición de complejos inmunes que contienen Gd-IgA1 en el mesangio glomerular, lo que lleva a la inflamación glomerular y daño renal. 1-3
Los pacientes con NIgA presentan una variedad de manifestaciones clínicas, fenotipos y velocidades de progresión. 3
La presentación clínica varía desde hematuria microscópica asintomática hasta un curso más severo caracterizado por proteinuria sostenida, hipertensión y deterioro rápido de la función renal. 4-6
Características clínicas de la Nefropatía IgA 6-10
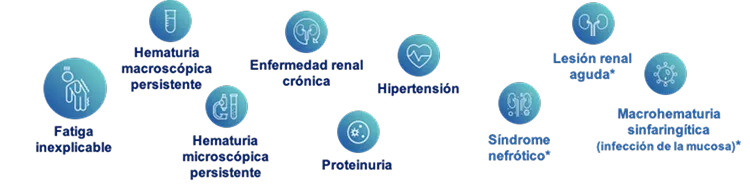
Figura adaptada de: National Organization for Rare Disorders (NORD). Disponible en: https://rarediseases.org/rare-diseases/iga-nephropathy/ (6); Feehally J, Floege J. 2007 (7); Floege J, Eitner F. 2011 (8); Selvaskandan H, et al. 2019 (9); Zhang C, et al. 2015 (10).
Diagnóstico
Las guías KDIGO establecen que la NIgA solo puede ser diagnosticada mediante una biopsia renal. 11
Los depósitos de IgA son el sello distintivo de la nefropatía por IgA y son detectables en la biopsia renal mediante microscopía óptica, inmunofluorescencia y microscopía electrónica. 12-15
Biopsia de riñón en Nefropatía IgA
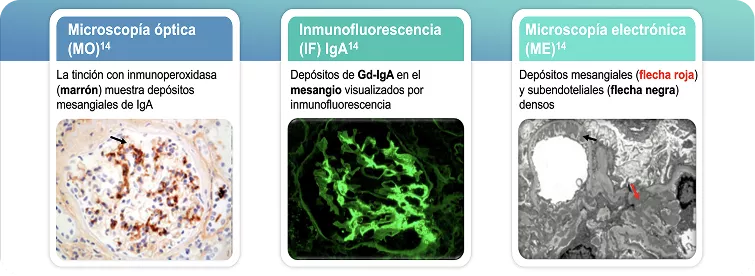
Figura adaptada de: Roberts IS, et al. 2014 (14).
Patogénesis y Fisiopatología: teoría de los 4 Hits
La fisiopatología de la NIgA se explica principalmente mediante la teoría de los 4 Hits, la cual implica la producción excesiva de Gd-IgA1, la consecuente generación de autoanticuerpos IgG anti-Gd-IgA1, la formación de inmunocomplejos circulantes y su posterior depósito en las células mesangiales. Estos inmunocomplejos activan una repuesta inflamatoria, la proliferación de células mesangiales y lesión de podocitos que resulta en glomeruloesclerosis y fibrosis intersticial. Todo esto conduce al daño glomerular. 2
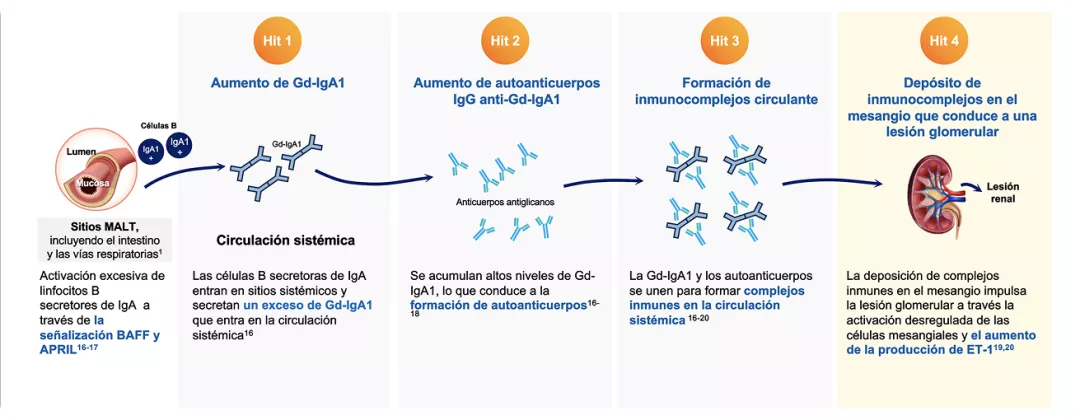
Figura adaptada de: Rizk DV, et al. 2019 (1); Gesualdo L, et al. 2021 (16); Boyd KJ, et al. 2012 (17); Yeo SC, Barrat J. 2023 (18); Suzuki H, et al. 2011 (19); Kohan DE, et al. 2023 (20).
Presentación y factores pronósticos
La nefropatía por IgA es la glomerulonefritis primaria más común a nivel mundial. La incidencia de la NigA en Europa es variable, pudiendo afectar entre 5 y 26 personas por cada millón de habitantes por año. 21-23
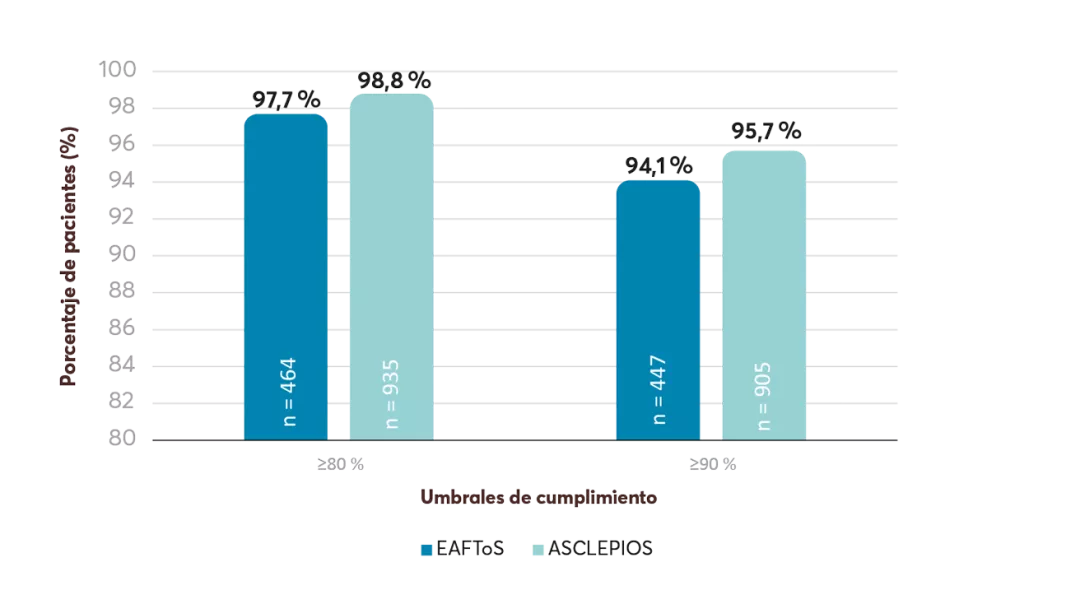
Acorde al Registro Español de Glomerulonefritis, la NIgA se diagnostica con mayor frecuencia en pacientes entre 17-44 años (51% de los casos), seguidos de pacientes de 45-64 años (31%), mayores de ≥65 años (9,5%) y pacientes con ≤16 años ( 8,3%). 24
Acorde a la evolución de la enfermedad, entre un 20-50% de los pacientes desarrollaran enfermedad renal terminal dentro de los 20-25 años posteriores al diagnóstico. 12,25
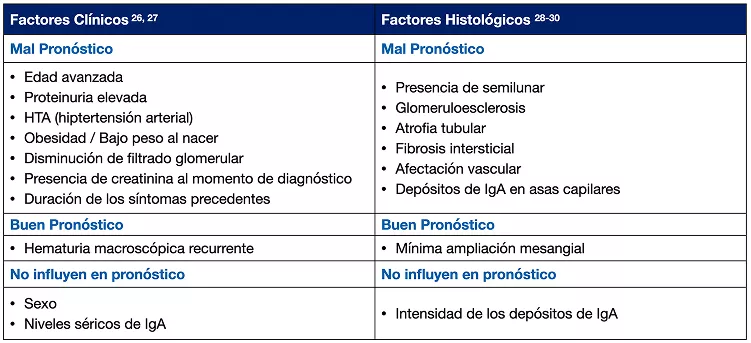
Los factores de riesgo para la progresión a insuficiencia renal incluyen factores clínicos e histológicos, según se muestra a continuación 26-30:
Herramienta Internacional de Predicción de Riesgos para predecir el riesgo de progresión de la IgAN
Las guías KDIGO recomienda utilizar la Herramienta Internacional de Predicción de Riesgos para predecir el riesgo de progresión de la IgAN en cada paciente. 11
Factores clínicos indicadores de mayor riesgo a progresión:
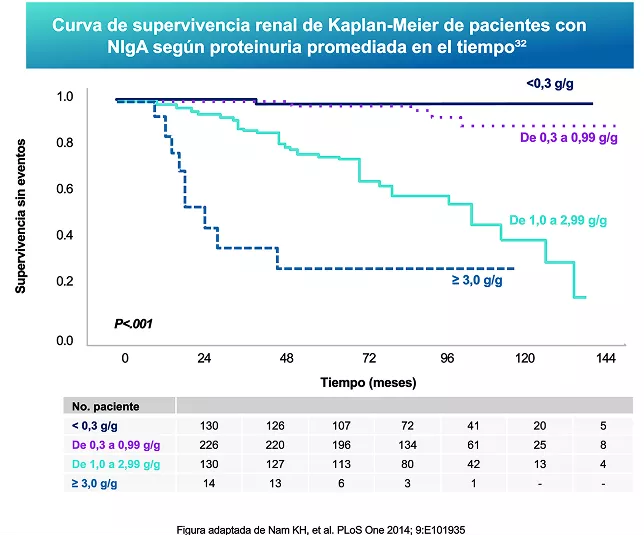
Proteinuria
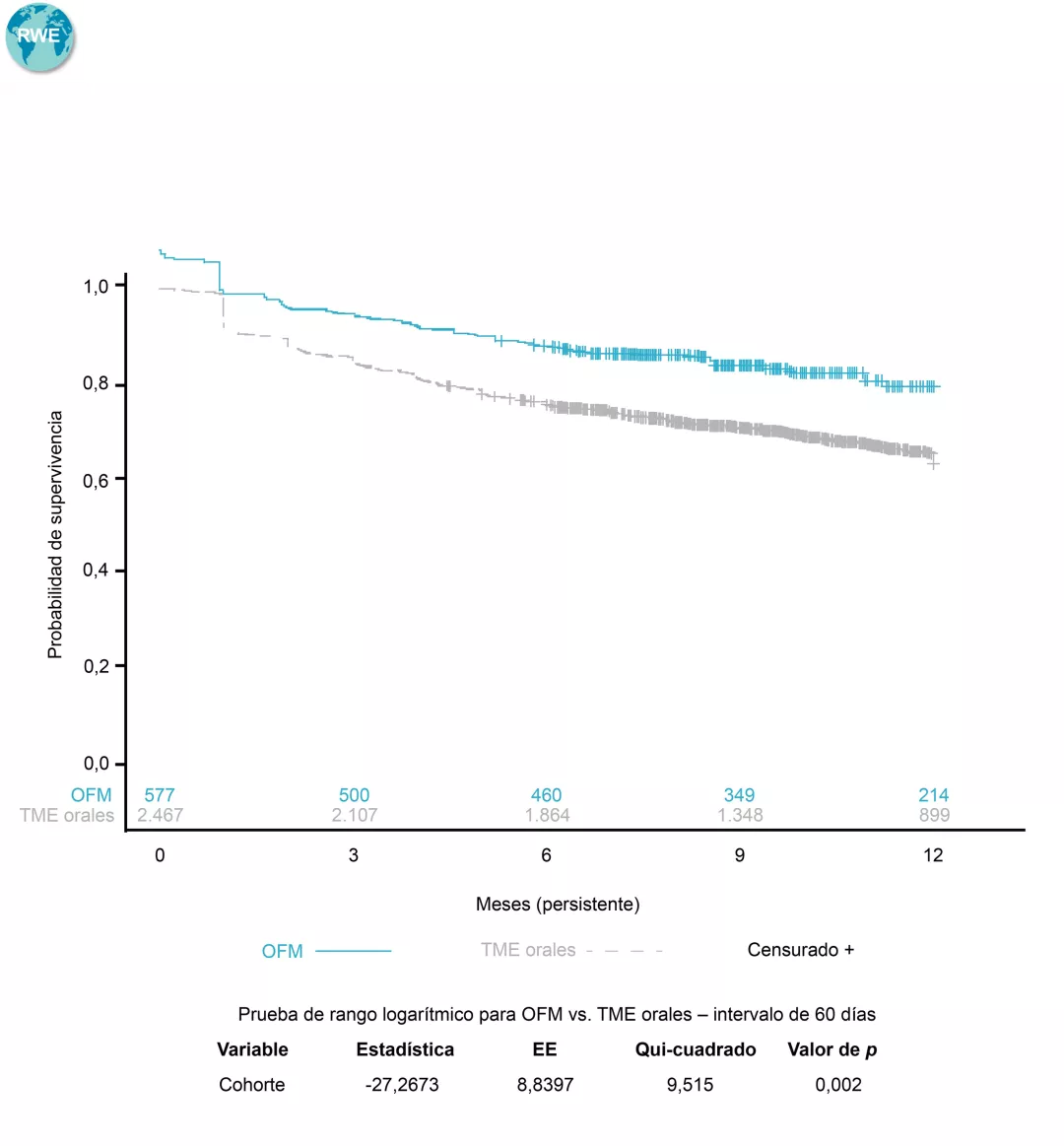
La proteinuria promediada en el tiempo es el predictor clínico más fuerte de la disminución de la función renal en NIgA 11,31-33. Una proteinuria >1 g/día se asocia con un riesgo 9,4 veces mayor de insuficiencia renal en comparación con los pacientes con proteinuria <1 g/día 33.
Función Renal
La tasa de filtrado glomerular (TFGe) es un importante biomarcador pronóstico de la IgAN. (11). Una disminución rápida de la TFGe se define como una disminución sostenida de la TFGe de >5 mL/min/1,73 m2/a2 y es considerado como una progresión rápida de la Enfermedad Renal Crónica 34,35.
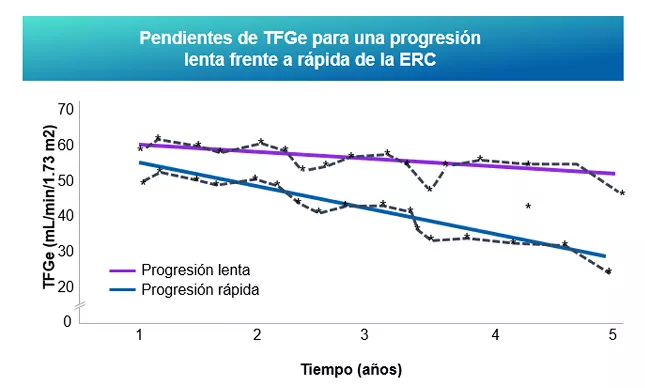
*Los datos mostrados son valores hipotéticos basados en presentaciones comunes de pacientes.
ERC: enfermedad renal crónica; TFGe: tasa de filtración glomerular estimada
Figura adaptada de Johnson RJ y Rodríguez-Iturbe B. Nat Rev Nephrol 2018; 14:411–412.
Histología Renal
La clasificación de Oxford/puntuación MEST-C es un sistema de puntuación histopatológica establecido para pacientes con nefropatía IgA. La puntuación de la muestra de biopsia renal involucra parámetros histológicos, cada uno de los cuales se asocia de forma independiente con el resultado clínico: hipercelularidad mesangial (M), hipercelularidad endocapilar (E), glomeruloesclerosis segmentaria (S), atrofia tubular y fibrosis intersticial (T) y medias lunas celulares o fibrocelulares (C) 8,28,36.
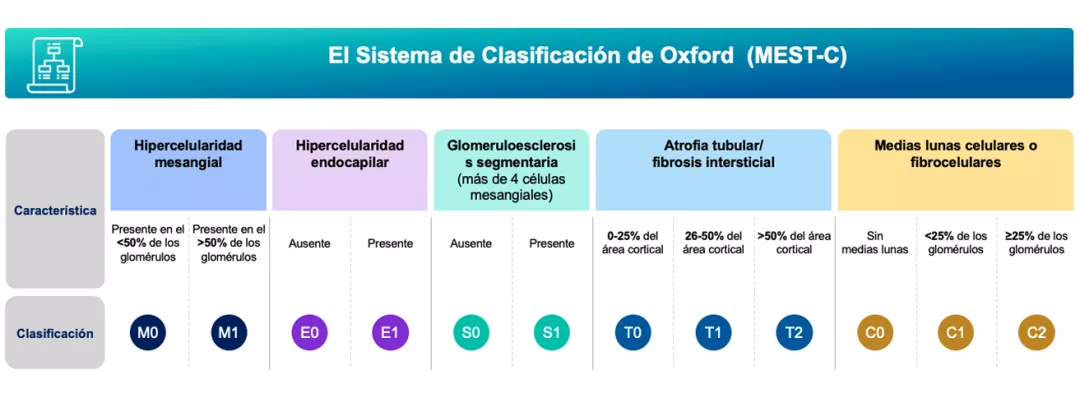
Figura adaptada de: Markowitz G. 2017 (28).
Hematuria
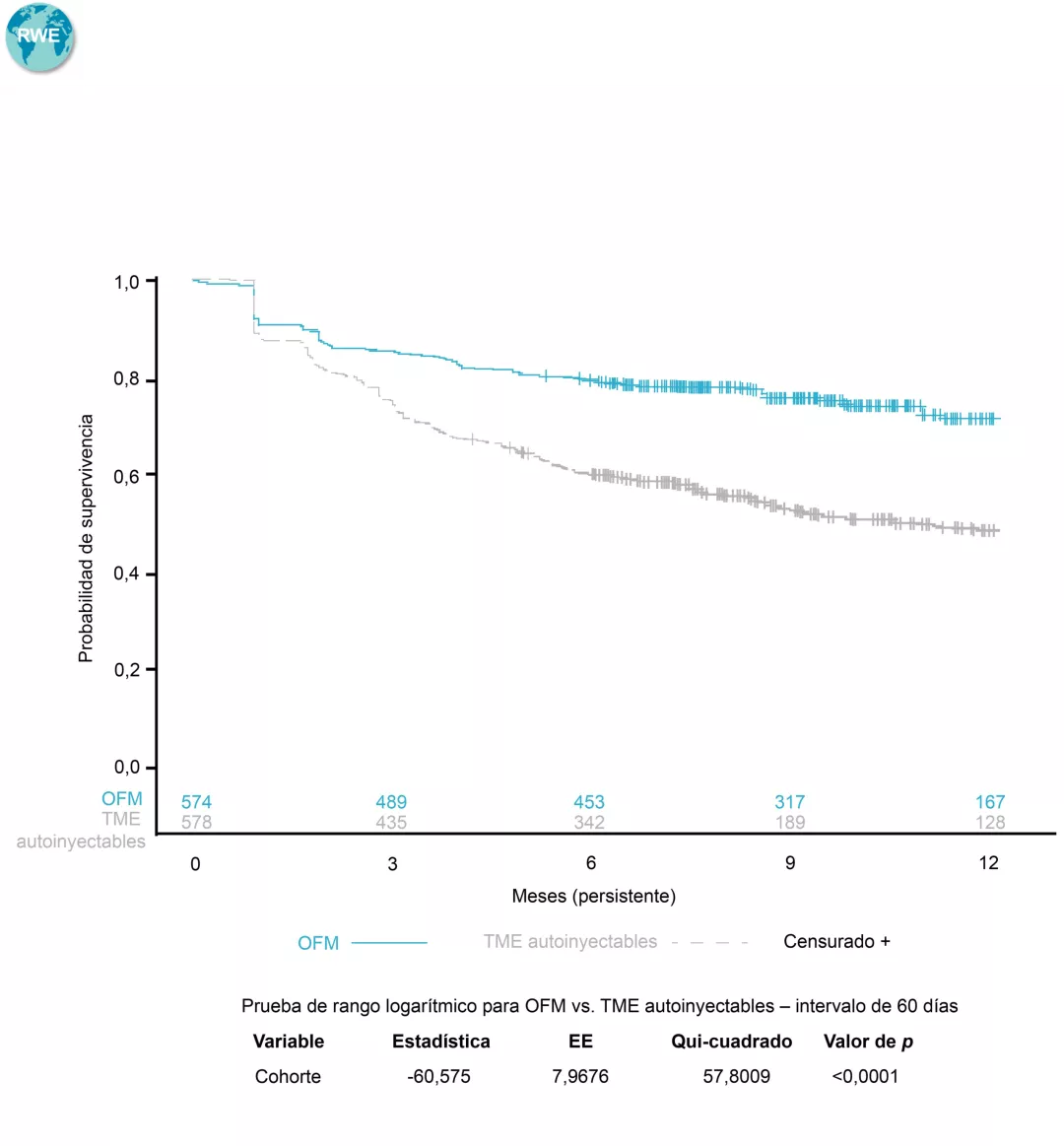
La hematuria ha surgido como un biomarcador de actividad en pacientes con NIgA, independiente de la proteinuria, pero aún más en presencia de proteinuria. Además, la hematuria sostenida en el tiempo se ha considerado como un indicador pronóstico de la evolución renal en pacientes con nefropatía IgA 37-40.
La remisión de la hematuria tiene un efecto significativamente favorable sobre la progresión de la NIgA, mientras que su persistencia en cantidades significativas es un factor de riesgo independiente para la pérdida de la función renal 38.
Un estudio español evaluó como la microhematuria en una cohorte de 112 pacientes con nefropatía por IgA seguida durante un periodo medio de 14 años. Este estudio demostró que el porcentaje de pacientes que llegan a una insuficiencia renal terminal o a una reducción del 50% de la función renal fue significativamente mayor entre los pacientes con hematuria persistente que entre los pacientes con hematuria mínima o negativa (30,4% y 37,0% frente a 10,6% y 15,2%, respectivamente; P=0,01). El estudio concluyó que la remisión de la hematuria puede tener un efecto favorable significativo en los resultados de la nefropatía por IgA en población española 40.
Carga de la Enfermedad
La nefropatía IgA es una enfermedad crónica que impone una carga significativa tanto a los pacientes como a sus familias. Los síntomas más reportados son el dolor, la fatiga extrema, ansiedad, depresión, hipertensión y/o problemas gastrointestinales. Estos síntomas afectan negativamente la calidad de vida de los pacientes, limitando su capacidad para participar en actividades diarias, deportivas y sociales. 41
La progresión de la enfermedad puede llevar a la insuficiencia renal terminal, lo que requiere diálisis o trasplante renal, aumentando aún más la carga emocional del paciente y genera un impacto económico en el sistema de salud. 41, 42
En tanto la proteinuria se asoció significativamente con una peor calidad de vida y depresión. La incertidumbre sobre el curso de la enfermedad y la necesidad de seguimiento constante también contribuyen al estrés y la ansiedad de los pacientes. 41, 42
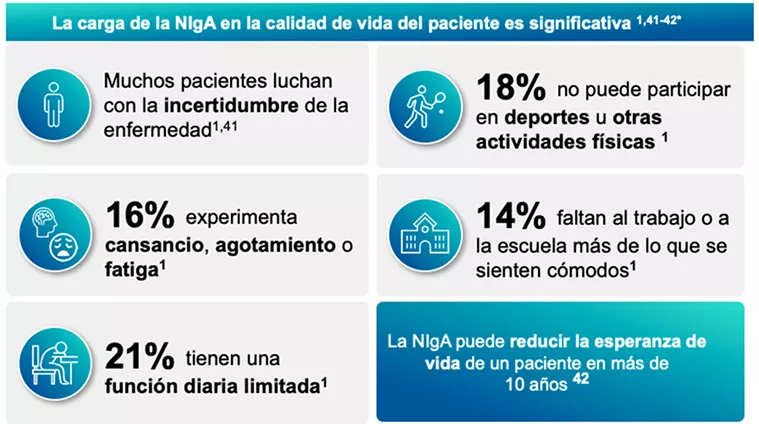
*Aproximadamente 330 pacientes con NIgA y cuidadores de pacientes con NIgA asistieron a la reunión de EL-PFDD y se les hizo una serie de preguntas sobre cómo vivir con NIgA. No todos los asistentes respondieron a todas las preguntas. Los datos y la información se publicaron en Voice of the Patient de la Fundación Nacional del Riñón.
Figura adaptada de: Rizk DV, et al. 2019 (1); National Kidney Foundation. Voice of the Patient Report. 2020 (41); Kwon CS, et al. 2021 (42).
Tratamiento
La NIgA suele tener un mal pronóstico, ya que muchos pacientes alcanzan la insuficiencia renal a lo largo de su vida. Por lo tanto, el objetivo principal para el tratamiento de la NIgA es reducir la pérdida de nefronas desde el momento del diagnóstico.11
Acorde a las guías de manejo clínico para el manejo de la Nefropatía IgA, el objetivo del tratamiento en pacientes con NIgA con riesgo de pérdida progresiva de la función renal es reducir la tasa de pérdida de la función renal a <1 ml/min/año durante el resto de la vida del paciente, manteniendo UPCR<0,5 g/d o preferiblemente <0,3 g/d. Las guías proponen un abordaje terapéutico simultáneo, a fin de (1) prevenir o reducir la formación de inmunocomplejos de IgA y daño glomerular; y (2) en paralelo, manejar las consecuencias de la pérdida de nefronas. 11
Otros abordajes incluyen la reducción de la producción patogénica de la IgA e inmuno complejos, reducción de inflamación glomerulas y/o consecuencia de la perdida de nefronas.
El arsenal terapéutico actual incluye medidas de protección renal como cambios de estilo de vida y bloqueo del sistema renina-angiotensina-aldosterona. El uso de corticoides sistémicos, aunque ampliamente utilizado, se sigue cuestionando debido a los efectos adversos asociados.
En cuanto al abordaje tratamiento actual y futuro, se empiezan a considerar otros enfoques más específicos de acuerdo su acción en la fisiopatogenia de la enfermedad. 43
Propuesta para guiar la elección del tratamiento según el objetivo de tratamiento para la NIgA44:
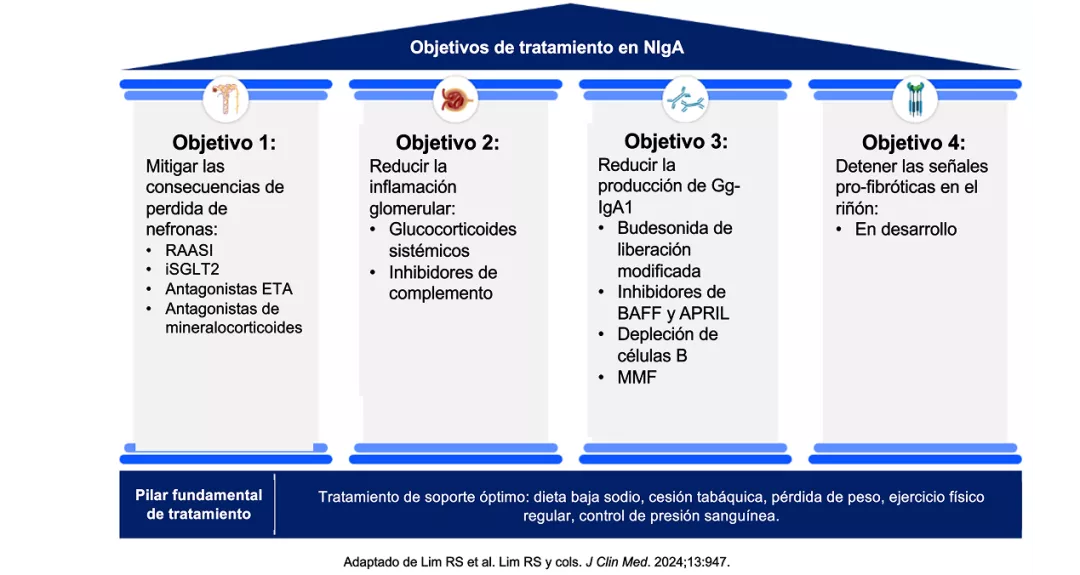
ABRIL: ligando inductor de proliferación. BAFF: Factor activador de células B. ETA: Endotelina. Gd-IgA: deficiencia de galactosa Inmunoglobulina A1. NIgAN: Nefropatía por inmunoglobulina A. iSGLT2: Inhibidores del cotransportador de sodio-glucosa tipo 2 MMF: Micofenolato mofetil. RAASI: Inhibidores del sistema renina-angiotensina-aldosterona.
Figura adaptada de: Lim RS, et al. 2024 (44).
Abreviaturas
APRIL: Ligando Inductor de Proliferación de Células B; BAFF: Factor Activador de Células B; ETA: Receptor tipo A de endotelina; Gd-IgA1: Galactosa-deficiente IgA1; g/d: gramos por día; HTA: Hipertensión Arterial; IgG: Inmunoglobulina G; iSGLT2: Inhibidores del cotransportador sodio-glucosa tipo 2; KDIGO: Kidney Disease: Improving Global Outcomes; MMF: Micofenolato Mofetilo; NIgA: Nefropatía por IgA; RAASI: Sistema Renina-Angiotensina-Aldosterona; TFGe: Tasa de Filtrado Glomerular estimada; UPCR: Relación proteína/creatinina urinaria.
Referencias
Rizk DV, et al. Front Immunol. 2019;10:504.
Knoppova B, et al. J Clin Med. 2021;10(19):4501.
Lafayette RA, Kelebouris E. Am J Nephrol. 2018;47:43–52.
Zhang H, Barratt J. Semin Immunopathol. 2021;43(5):707–715.
National Institute of Diabetes and Digestive and Kidney Diseases. Disponible en: https://www.niddk.nih.gov/health-information/kidney-disease/iga-nephropathy. Acceso 16 de mayo de 2025.
National Organization for Rare Disorders (NORD). Disponible en: https://rarediseases.org/rare-diseases/iga-nephropathy/. Acceso 16 de mayo de 2025.
Feehally J, Floege J. Comprehensive Clinical Nephrology. 2007:253-264.
Floege J, Eitner F. J Am Soc Nephrol. 2011;22(10):1785-1794.
Selvaskandan H, et al. Clin Exp Nephrol. 2019;23(5):577-588.
Zhang C, et al. Transl Res. 2015;166(2):134-144.
KDIGO. Kidney Int. 2021;100(4S):S1-S276.
Floege J, et al. Kidney Int. 2019;95(2):268-280.
Roberts IS, et al. Kidney Int. 2009;76(5):546-556.
Roberts IS. Nat Rev Nephrol. 2014;10(8):445-454.
Rajasekaran A, et al. Am J Med Sci. 2021;361(2):176-194.
Gesualdo L, et al. Semin Immunopathol. 2021;43(5):657-668.
Boyd JK, et al. Kidney Int. 2012;81(9):833-843.
Yeo SC, Barratt J. Clin Kidney J. 2023;16(Suppl 2):ii9-ii18.
Suzuki H, et al. J Am Soc Nephrol. 2011;22(10):1795-1803.
Kohan DE, et al. Kidney Int Rep. 2023;8(11):2198-2210.
McGrogan A, et al. Nephrol Dial Transplant. 2011;26(2):414-430.
Simon P, et al. Kidney Int. 2004;66(3):905-908.
Schena FP, Nistor I. Semin Nephrol. 2018;38(5):435-442.
Gutiérrez E, et al. Nephrol Dial Transplant. 2018;33(3):472-477.
Zink CM, et al. Clin Kidney J. 2019;12(6):795–800.
Barratt J, Feehally J. J Am Soc Nephrol. 2005;16(7):2088-2097.
Rodrigues JC, et al. Clin J Am Soc Nephrol. 2017;12(4):677-686.
Markowitz G. Nat Rev Nephrol. 2017;13(7):385-386.
Haas M, et al. J Am Soc Nephrol. 2017;28(2):691-701.
H, et al. Kidney Int. 2017;91(5):1014-1021.
Lai KN, et al. Nat Rev Dis Primers. 2016;2:16001.
Nam KH, et al. PLoS One. 2014;9(7):e101935.
Cattran DC, et al. Kidney Int Rep. 2023;8(12):2515-2528.
Hirst JA, et al. Br J Gen Pract. 2022;72(717):e261-e268.
Johnson RJ, Rodriguez-Iturbe B. Nat Rev Nephrol. 2018;14(7):411-412.
Cattran DC, et al. Kidney Int. 2009;76(5):534-545.
Zand L, et al. Clin Kidney J. 2023;16(Suppl 2):ii19-ii27.
Bobart SA, et al. Nephrol Dial Transplant. 2021;36(5):840-847.
Weng M, et al. J Clin Med. 2022; 11(22):6785.
Sevillano AM, et al. J Am Soc Nephrol. 2017;28(10):3089-3099.
National Kidney Foundation. Voice of the Patient Report. 2020. Disponible en: https://nkf.egnyte.com/dl/aHGCS6tPNM. Acceso 16 de mayo de 2025.
Kwon CS, et al. J Health Econ Outcomes Res. 2021;8(2):36-45.
Cheung CK, Barratt J. Semin Nephrol. 2024;44(5):151573.
Lim RS, et al. J Clin Med. 2024;13(4):947.