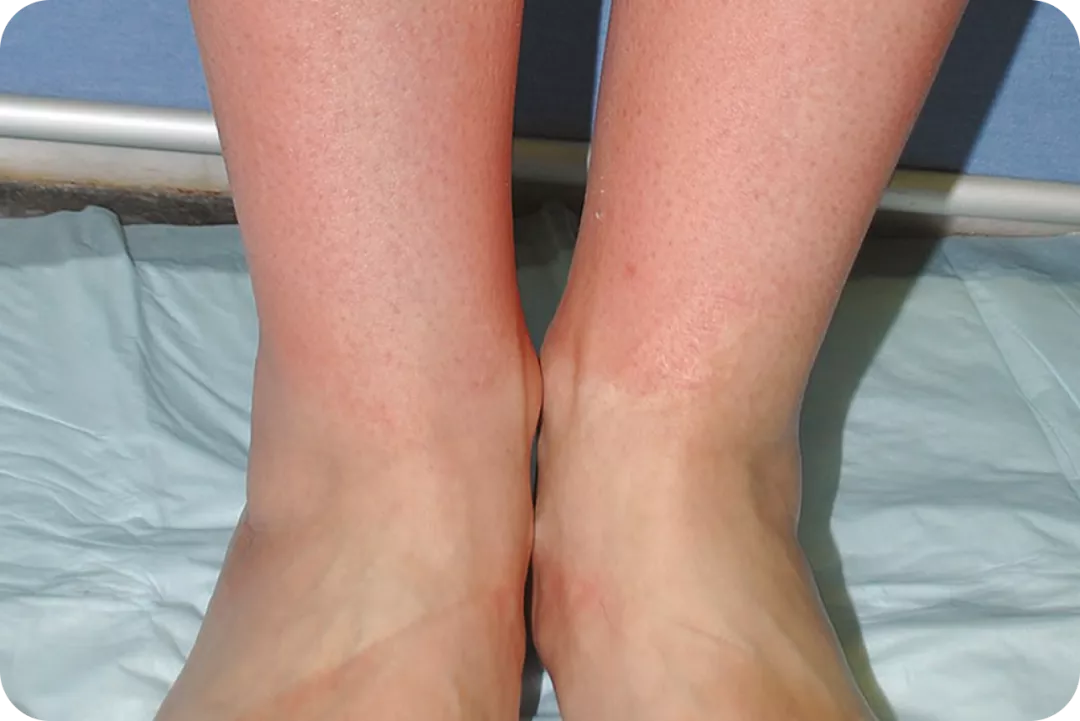
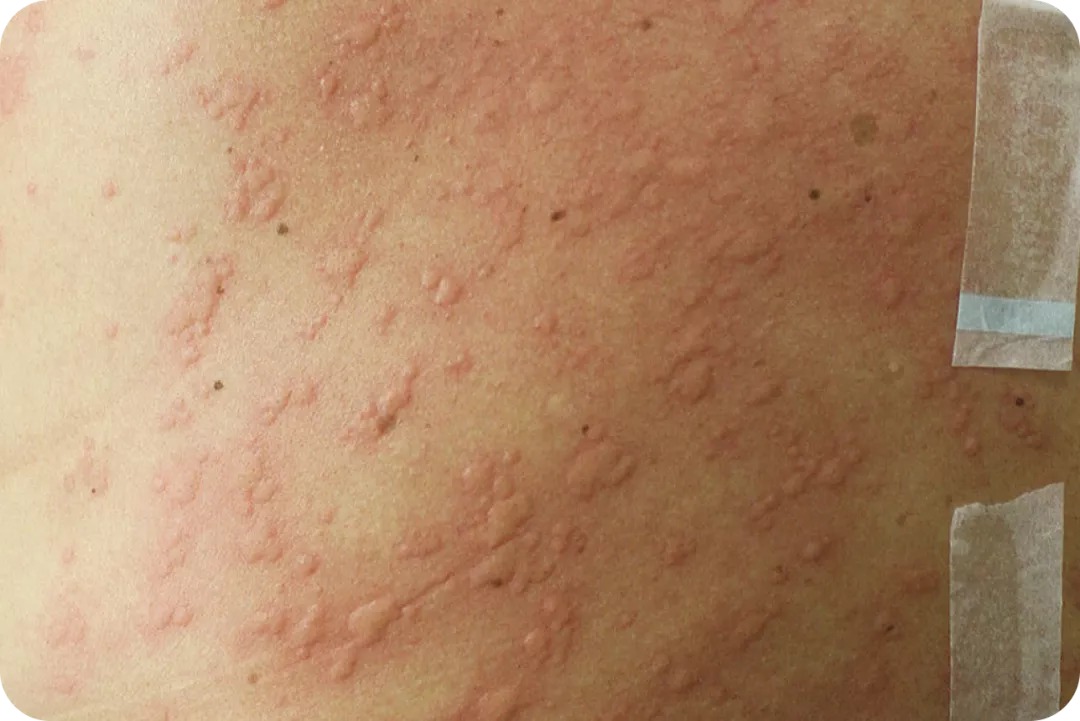
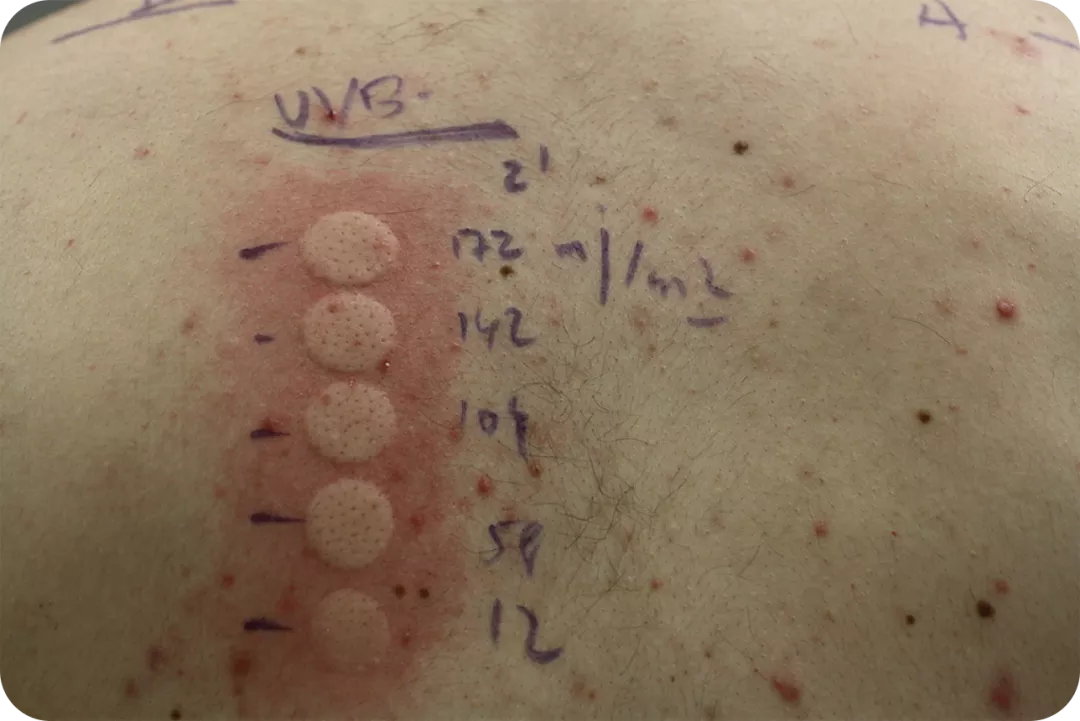
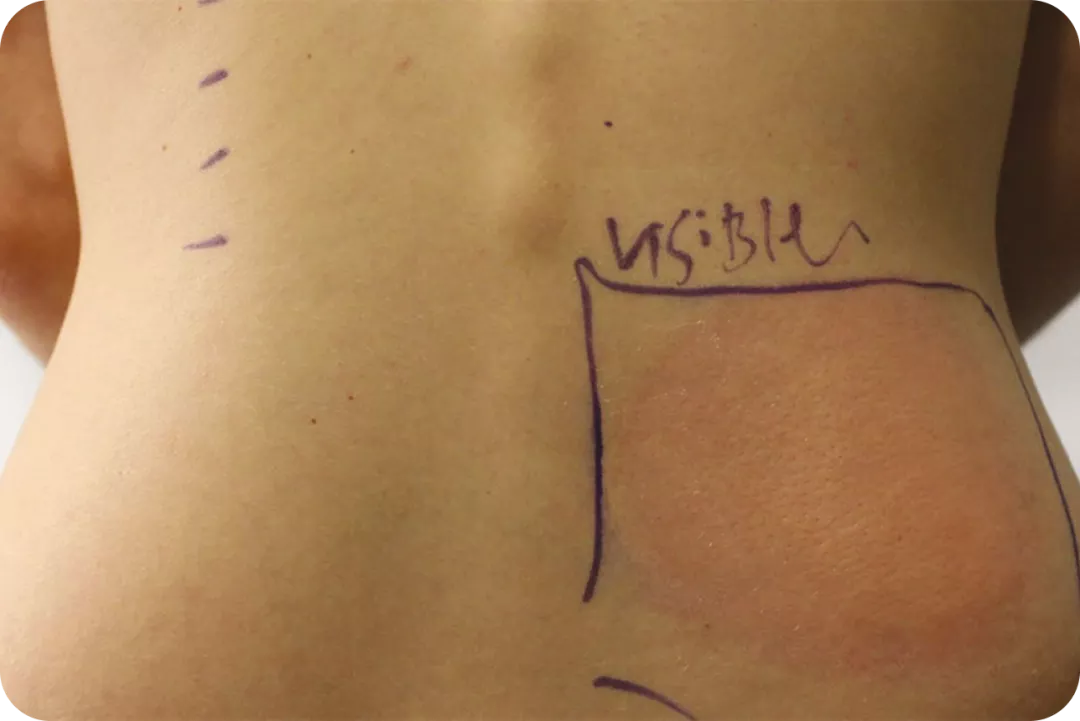
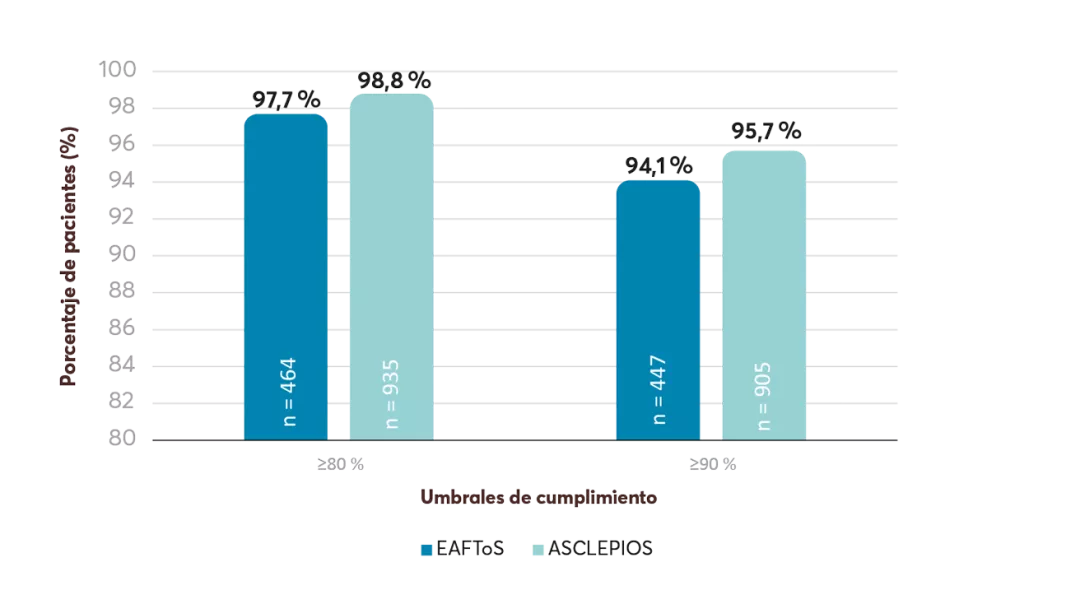
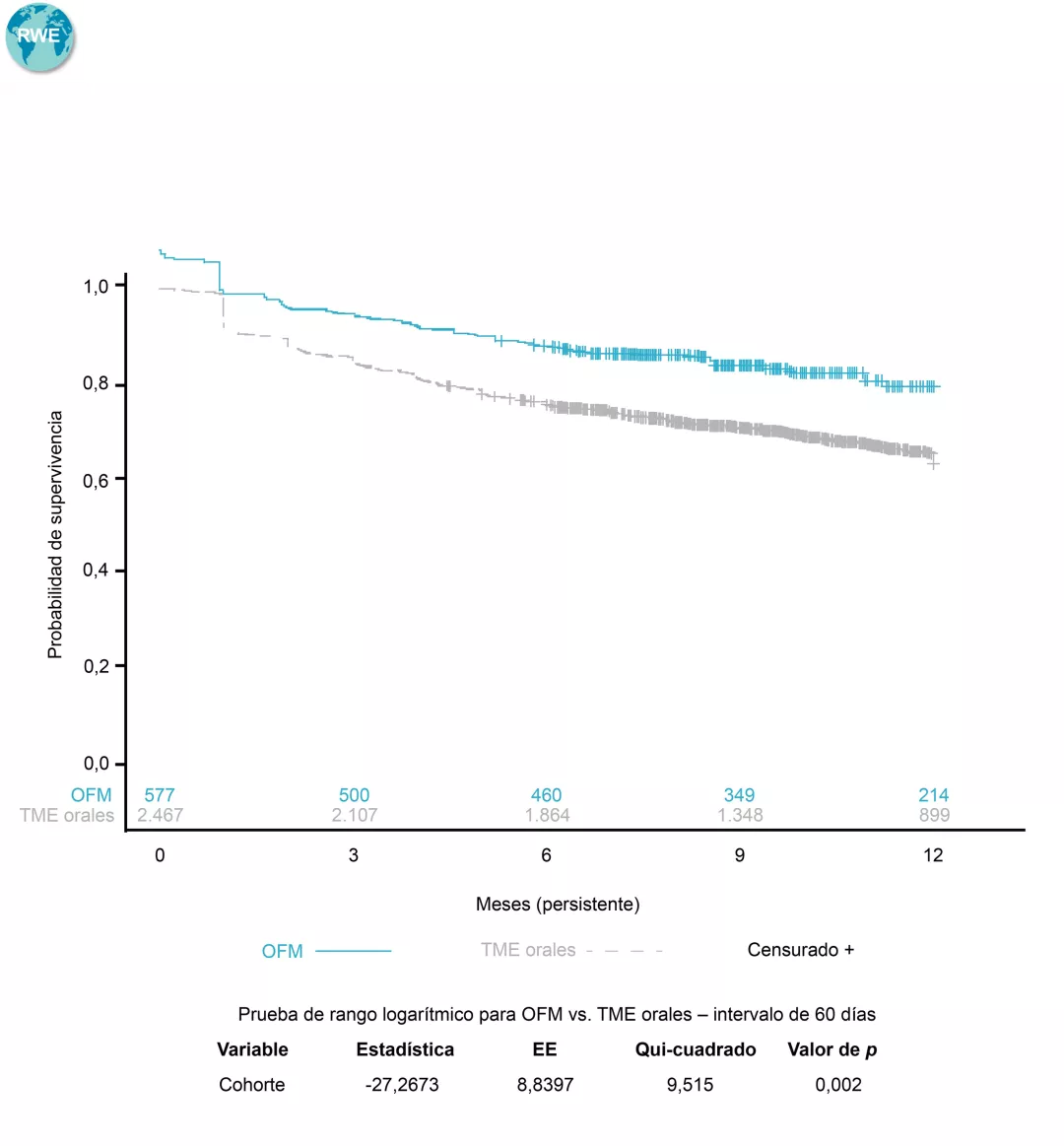
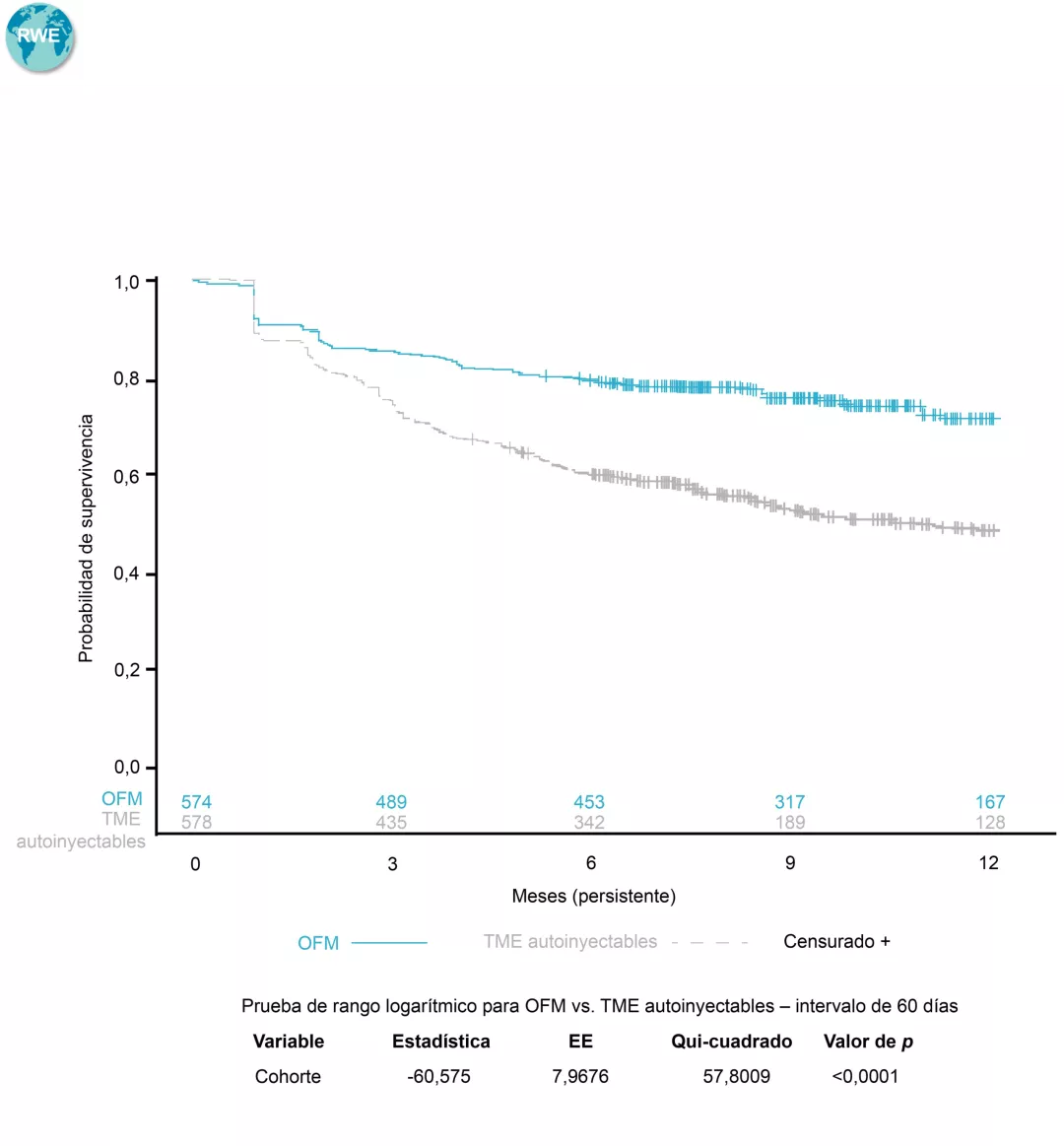
Volver al :
.
Referencias
Pérez-Ferriols A, Barnadas M, Gardeazábal J, De Argila D, Carrascosa JM, Aguilera P, et al. Urticaria solar. Epidemiología y fenotipos clínicos en una serie española de 224 pacientes. Actas Dermosifiliogr. 2017; 108(2): 132-139.
Webb LM, Mikita CP. Solar urticaria. Allergy Asthma Proc. 2009; 30(5): 563-565.
Magerl M, Altrichter S, Borzova E, Giménez-Arnau A, Grattan CE, Lawlor F, et al. The definition, diagnostic testing, and management of chronic inducible urticarias –the EAACI/GA2LEN/EDF/UNEV consensus recommendations 2016 update and revision. Allergy. 2016; 71(6): 780-802.
Ferrer M, Veleiro B, Jáuregui I. Urticaria. En: Dávila IJ, Jáuregui I, Olaguibel JM, Zubeldia JM, eds. Tratado de alergología, 2.ª ed. Madrid: Ergon, 2015.