LUCENTIS
10 mg/ml Enjeksiyonluk Çözelti İçeren Kullanıma Hazır Enjektör
Bir kullanıma hazır enjektör, 1.65 mg ranibizumaba eşdeğer 0.165 ml içerir.
Ranibizumab VEGF-A’yı hedef alan bir insan rekombinan monoklonal antikor parçasıdır. LUCENTIS® VEGF-A'ya yüksek afinite ile bağlanır.1
LUCENTIS®;
Neovasküler (yaş tip) yaşa bağlı makula dejenerasyonu (YBMD)
Diyabetik maküler ödemden (DMÖ) kaynaklanan görme bozukluğu
Retinal ven tıkanıklığına (RVT) bağlı maküler ödemden kaynaklanan görme bozukluğu
Patolojik miyopiye (PM) bağlı koroidal neovaskülarizasyondan (KNV) kaynaklanan görme bozukluğu tedavisinde endikedir.1


LUCENTİS’in erişkinlerdeki endikasyonları aşağıdaki gibidir:6
- Neovasküler (yaş tip) yaşa bağlı makula dejenerasyonu (YBMD) tedavisinde,
- Diyabetik maküler ödem (DMÖ)’den kaynaklanan görme bozukluğunun tedavisinde,
- Proliferatif diyabetik retinopatinin (PDR) tedavisi
- Retinal ven tıkanıklığına (RVT) bağlı maküler ödemden kaynaklanan görme bozukluğunun tedavisinde,
- Koroidal neovaskülarizasyona (KNV) bağlı görme bozukluğunun tedavisinde,
LUCENTİS’in erken doğmuş bebeklerdeki endikasyonları aşağıdaki gibidir:
- Prematüre retinopatisinin (ROP) zon I (evre 1+, 2+, 3 veya 3+), zon II (evre 3+) veya AP-ROP (agresif posterior ROP) hastalığının tedavisi.
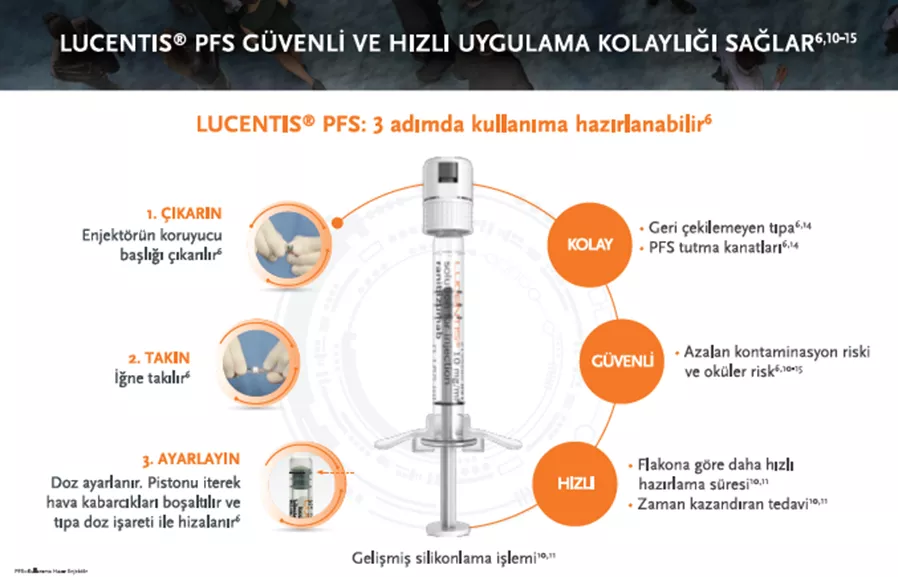
Pozoloji:6
Erişkinler
LUCENTİS’in erişkinlerde önerilen dozu, tek bir intravitreal enjeksiyon halinde uygulanacak olan 0,5 mg’dır. Bu doz, 0,05 mL’lik bir enjeksiyon hacmine denk gelmektedir. Aynı göze yapılan iki uygulama arasında geçen süre, 4 haftadan kısa olmamalıdır.
Preterm Bebekler
Preterm bebeklerde LUCENTİS için önerilen doz, intravitreal enjeksiyon olarak 0,2 mg’dır. Bu, 0,02 mL’lik bir enjeksiyon hacmine karşılık gelir. Erken doğmuş bebeklerde ROP tedavisi, göz başına tek bir enjeksiyonla başlatılır ve aynı gün içinde iki taraflı olarak verilebilir. Hastalık aktivitesi belirtileri varsa, tedavinin başlamasından sonraki altı ay içinde göz başına toplamda üç adede kadar enjeksiyon uygulanabilir. 24 haftalık RAINBOW klinik çalışmasında çoğu hastaya (%78) göz başına bir enjeksiyon uygulanmıştır.
Bu klinik çalışmada 0,2 mg ile tedavi edilen hastaların, beş yaşına kadar takip edilen sonraki uzun dönem uzatma çalışmasında ek tedaviye ihtiyacı olmamıştır. Göz başına üçten fazla enjeksiyonun uygulanması araştırılmamıştır. Aynı göze enjekte edilen iki doz arasındaki aralık, en az dört hafta olmalıdır.
Uygulama Sıklığı ve Süresi:6
Erişkinlerde tedaviye ayda bir uygulama ile başlanır ve maksimum görme keskinliğine ulaşılana ve/veya hastalık aktivitesi belirtileri görülmeyene yani, devam eden tedavi altında görme keskinliğinde ve diğer hastalık belirti ve semptomlarında bir değişiklik olmayana kadar devam edilir. Yaş tip YBMD, DMÖ, PDR ve RVT’li hastalarda başlangıçta üç veya daha fazla ardışık aylık enjeksiyon gerekebilir.
Sonrasında, izlem ve tedavi aralıkları doktor tarafından, görme keskinliği ve/veya anatomik parametrelere göre değerlendirilen hastalık aktivitesine göre belirlenmelidir.
Hastalar, tedavi et ve uzat rejimine göre tedavi ediliyorsa, maksimum görme keskinliği elde edildiğinde ve/veya hastalık aktivitesi belirtileri yoksa, tedavi aralıkları hastalık aktivitesi veya görme bozukluğu belirtileri nüksedene kadar kademeli olarak uzatılabilir. Tedavi aralığı, yaş tip YBMD için bir seferde en fazla iki hafta uzatılmalıdır ve DMÖ için bir seferde bir aya kadar uzatılabilir. PDR ve RVT için tedavi aralıkları da kademeli olarak uzatılabilir, bununla birlikte bu aralıkların uzunluğuna dair bir sonuca varmak için yeterli veri yoktur. Hastalık aktivitesi nüksederse, tedavi aralığı uygun şekilde kısaltılmalıdır.
KNV’ye bağlı görme bozukluğunun tedavisi, hastalık aktivitesi temelinde hastaya göre bireysel olarak belirlenmelidir. Bazı hastalar, ilk 12 ay sırasında sadece bir enjeksiyona ihtiyaç duyabilir; diğerleri aylık enjeksiyon dahil daha sık tedaviye ihtiyaç duyabilir. Patolojik miyopiye (PM) bağlı KNV için, birçok hasta ilk yıl sırasında sadece bir ya da iki enjeksiyona ihtiyaç duyabilir.

ROP endikasyonu flakonda mevcuttur. Detaylı bilgi için Kısa Ürün Bilgisine ulaşabilirsiniz.
Referanslar:
- Campochiaro PA, et al. Ophthalmology. 2010;117(6):1102-1112.e1.
- Brown DM, et al. Ophthalmology. 2010;117(6):1124-1133.e1.
- Rosenfeld PJ, et al. The New England journal of medicine. 2006;355(14):1419-31.
- Nguyen QD, et al.Ophthalmology 2012;119(4):789-801.
- Wolf S, et al.Ophthalmology. 2014;121(3):682-92.e2.
- LUCENTIS® Kısa Ürün Bilgisi.
- Gross JG, et al. JAMA. 2015;314(20):2137-2146.
- Lai TYY, et al. Retina. 2018;38(8):1464-1477.
- Stahl A, et al. Lancet. 2019;394(10208):1551-1559.
- Souied E, et al. Eur J Ophthalmol. 2015;25(6):529-534.
- Sassalos TM and Paulus YM. Clinical Ophthalmology. 2019;13:701–706.
- Subhi Y, et al. Dan Med J. 2016;63(4):A5214.
- Buerke B, et al. AJR Am J Roentgenol. 2010 Feb;194(2):299-303.
- Antoszyk AN, et al. PDA J Pharm Sci Technol. 2018;72(4):411-419.
- Storey PP, et al. Am J Ophthalmol. 2019 Mar;199:200-208. FA-11498432