RWE Facilidad
- En un estudio de vida real se examinó la persistencia y adherencia al tratamiento con ofatumumab en comparación con Terapias modificadoras de la enfermedad (TME) orales y autoinyectables agosto de 2020 y noviembre de 2023. Ofatumumab mostró mejor persistencia y adherencia en comparación con TMEs autoinyectables y mejor persistencia en comparación con TMEs orales3.
- Tratamiento específicamente diseñado, testado y aprobado para la autoadministración en pacientes con EM1.
- Pequeño volumen de administración sc de ofatumumab1.
- Autoadministrado desde casa1.
- Sin requerimiento de premedicación1.
- La pluma autoinyectora ha ofrecido a los pacientes un método conveniente para administrar fácilmente el tratamiento en casa2.
- En los estudios ASCLEPIOS I/II, la administración sc se asoció a niveles de cumplimiento del 98,8 %2.
El pequeño volumen de administración sc (0,4 ml) permite a los pacientes autoadministrarse la dosis de forma segura y cómoda, y esto, combinado con la buena tolerabilidad y la falta de necesidad de premedicación, puede fomentar una mayor adherencia al tratamiento frente a las terapias tradicionales. Siguiendo la proporción de pacientes que cumplieron con la dosis de 20 mg sc en la fase principal (98,8%), el cumplimiento en el estudio de extensión de ALITHIOS se ha mantenido alto. En este estudio, los pacientes se clasificaron en dos grupos: aquellos que continuaron con ofatumumab (en adelante denominado "grupo continuo de ofatumumab") y aquellos que cambiaron de teriflunomida a ofatumumab (grupo de cambio). A fecha de 25 de septiembre de 2021, el 94,9% (1868/1969), el 95,1% (1229/1292) y el 94,4% (639/677) de los pacientes de los subgrupos total, continuo y cambio a ofatumumab seguían en tratamiento4, respectivamente.
También se han evaluado las preferencias de los pacientes y las enfermeras en cuanto al modo de administración, y los pacientes con EM han determinado que la pluma autoinyectora es fácil de usar, a la vez que permite administrar el tratamiento de forma independiente en casa.3
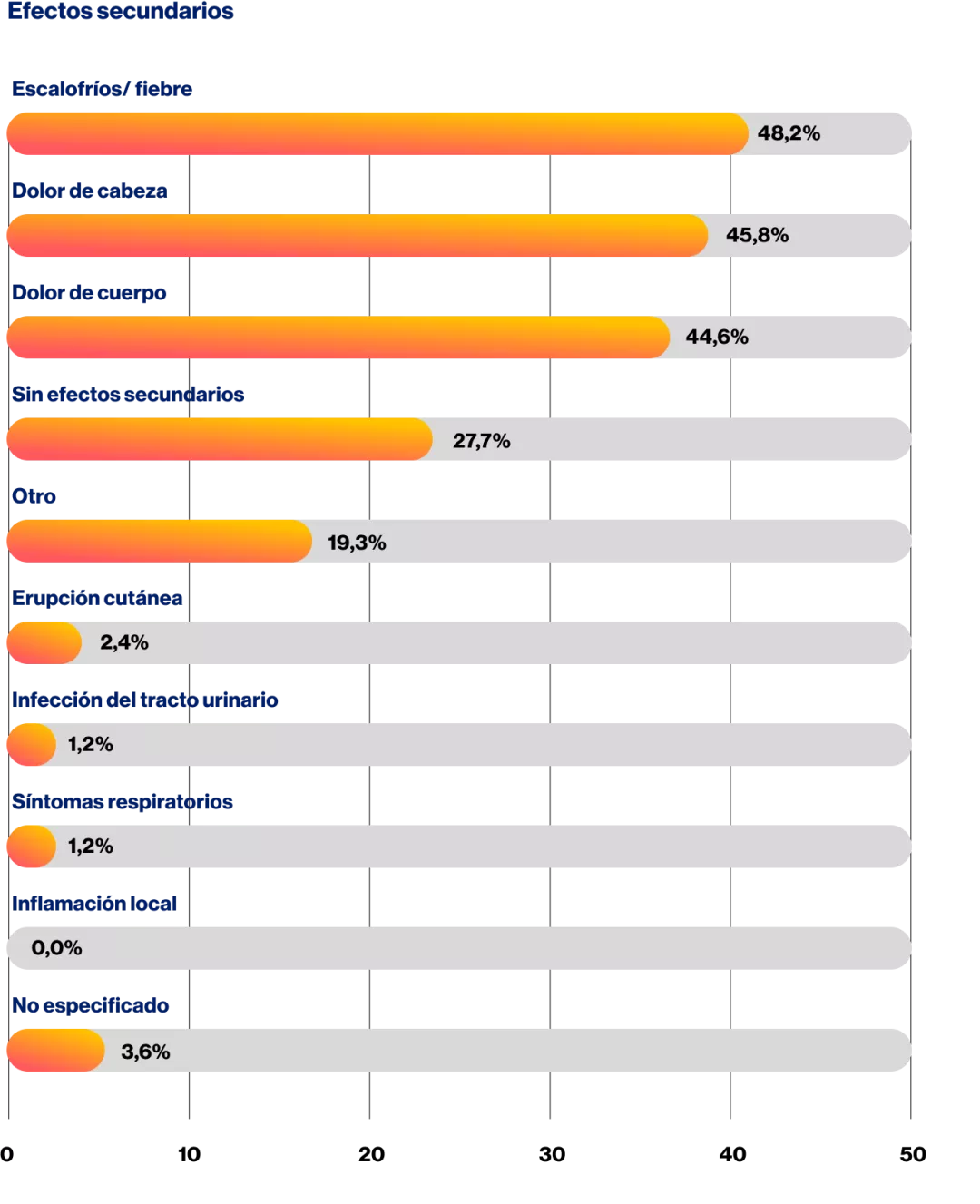
El objetivo de este estudio observacional fue investigar la tolerabilidad y aceptabilidad de ofatumumab desde la perspectiva del paciente.
Con respecto a la medicación con ofatumumab, se evaluaron los efectos secundarios tempranos (dentro de las 48 h posteriores a la inyección) y los efectos secundarios tardíos (durante una semana posinyección) después del uso inicial y en aplicaciones posteriores. Además, se registró el manejo subjetivo, así como la influencia en la calidad de vida, la distancia recorrida, la concentración, el estado de ánimo, la fatiga y el curso subjetivo de la EM. También se examinó la adherencia al tratamiento.
Se inició ofatumumab en un total de 127 pacientes. De estos, el 78 % (n = 99) se registró sistemáticamente mediante cuestionario, entrevista telefónica y documentación médica del hospital.
El 80 % (n = 79) eran mujeres. La edad promedio de los pacientes fue de 42,2 años (± desviación estándar [DE] 11,2 años). La duración promedio de la enfermedad
fue de 9,1 años (± DE 7,7). En promedio, los pacientes habían recibido 2,8 (± DE 1,7) terapias previas. Ocrelizumab fue la terapia previa más común con el 18,6 % (n = 18). El 11,3 % (n = 11) de los pacientes no había tenido terapia previa. El valor promedio de EDSS fue de 2,3 (± DE 1,1; mín. 1,0; máx. 6,5).
La duración promedio del tratamiento con ofatumumab fue de 9,8 meses (± DE 3,5; mín. 3; máx. 15).
Para ACC: "Para uso exclusivo de los profesionales de la salud”
Para ACC: Para visualizar la información del importador escanee el siguiente código QR o ingrese al link:
Para más información favor dirigirse al área de Información Médica de Novartis:
[email protected]
Si desea reportar un evento adverso ingrese al siguiente enlace: http://www.novartis.com/report
Para Costa Rica y Panamá: “Toda sospecha de reacción adversa y falla terapéutica se debe notificar
al Centro Nacional de Farmacovigilancia (CNFV) en los formularios y plazos establecidos en la
normativa vigente.”
La información en esta página web es propiedad de Novartis, o Novartis tiene el derecho de utilizar la misma, por lo cual los profesionales médicos deberán únicamente utilizarla para el ejercicio de su práctica profesional con pacientes, y no deberán replicar o divulgar la misma para fines comerciales o personales. Novartis no se hace responsable por el uso incorrecto de la información por parte de los profesionales médicos o terceros; no obstante, Novartis podrá iniciar las acciones legales que correspondan en estos casos.