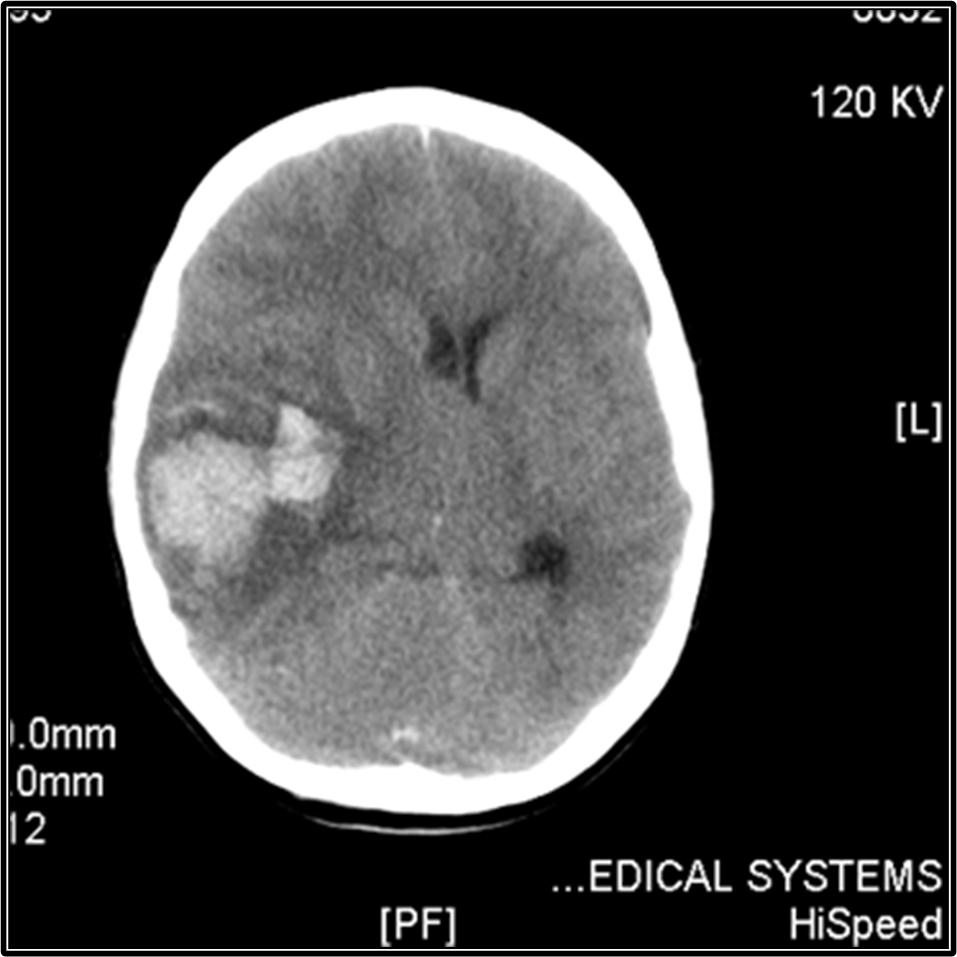
Иммунная тромбоцитопения у детей; проблемные вопросы
Оглавление
Иммунная тромбоцитопения (ИТП) у детей: проблемные вопросы
Доказательная медицина1
Стандартизация2
Классификация в зависимости от длительности
- Впервые диагностированное заболевание (<3 месяцев)
- Персистирующее течение (3 – 12 месяцев)
- Хроническое течение (>12 месяцев)
Тяжесть
- Тяжелое течение – клинически значимые кровотечения вне зависимости от уровней тромбоцитов
- Валидация количественных методов оценки кровотечений
Задачи терапии
- Избежать необоснованного лечения в наименее тяжелых случаях, в особенности у детей
- Минимизировать объем применения стероидов
- Добиться безопасных уровней тромбоцитов (>30 x 109/л)
- Улучшить медицинские компоненты качества жизни
Параметры, по которым оцениваются результаты лечения3-5
Уровни тромбоцитов
- <20 x 109/л: повышен риск тяжелых кровотечений
- 20-50 x 109/л: подкожные кровоподтеки, меноррагии, низкий риск
- >50 x 109/л: как правило, симптоматика отсутствует
Геморрагические эпизоды
- Опубликовано множество различных методов количественной оценки
- Тяжесть или частота
Медицинские компоненты качества жизни
- Как последствия заболевания, так и последствия лечения
Затраты
Тяжесть кровотечений6
| Доля детей в зависимости от тяжести кровотечений | Средние уровни тромбоцитов (x 109/л) | Среднее количество локализаций кровотечений | Доля получающих лечение | |
|---|---|---|---|---|
| Слабые | n = 112 (54%) | 14 | 1,9 | n = 8 (7%) |
| Умеренные | n = 92 (42%) | 8 | 2,5 | n = 22 (24%) |
| Тяжелые | n = 8 (4%) | 6 | 3,6 | n = 5 (62%) |
Что нас беспокоит в первую очередь?3,7
Основные результаты обзоров частоты внутричерепных кровоизлияний у детей с ИТП
| Источник, страна | Пациенты (n) | Внутричерепные кровоизлияния | Смертность | Уровни тромбоцитов на момент развития (x109/л) | Дополнительные факторы |
|---|---|---|---|---|---|
| So at al (2013) Гонконг | 276 | 8 (3%) | 1 (12%) | <10 у 50% 5 – 82 | Острые случаи (n = 3)
|
| Choudhary et al (2009) Индия | 750 | 17 (2%) | 4 (24%) | 2 – 50 | Травма (n = 1) (? НПВС)
|
| Psaila et al (2009) США | 40 (примерно 0,19 – 0,78%) | 25% | <20 у 90% <10 у 75% 1 – 61 | Травма головы (n = 13)
| |
| Iyori et al (2000) Япония | 772 | 4 (0,52%) | 0 | Медиана 5,2 ± 3,7 | Менструация (n = 2)
|
| :Lilleyman (1994) Великобритания | 14 (примерно 0,1%) | 8 (57%) | <10 у 15% | АВН (n = 2)
| |
| Elalfy et al (2010) Египет | 1840 | 10 (0,5%) | 2 (20%) | <10 у 70% | Травма головы (n = 1)
|
ИТП = иммунная тромбоцитопения; ВК = внутричерепное кровоизлияние; АВМ = артериовенозная мальформация; НПВС = нестероидные противовоспалительные средства; СКВ = системная красная волчанка; АВН = аваскулярный некроз; ЧМТ = черепно-мозговая травма
Эпизоды лечения8
- Анализ данных по 421 ребенку в марте 2012 года
- У 119 детей (28%) потребовалось 208 эпизодов лечения
| Длительность ИТП | Количество детей, получающих терапию | Процент от группы | Количество пациентов на месяц соответствующей фазы |
|---|---|---|---|
| 0 ≤ 3 месяцев | 72 | 17,5% | 24 |
| 3 - 12 месяцев | 28 | 10,1% | 3,1 |
| >12 месяцев (в среднем – 27 месяцев) | 19 | 20,7% | 1,3 |
Данные Британского регистра в 2012 году: ответы на лечение8
| Среднее количество тромбоцитов после терапии | День 0 | День 2 | День 7 | 6 недель | 3 месяца |
|---|---|---|---|---|---|
| Без лечения | 13* | 18 | 61 | 140 | 98 |
| Стероиды | 13 | 26 | 103 | 109 | 88 |
| в/в Ig | 8 | 62 | 169 | 115 | 145 |
Качество жизни9
Медицинские компоненты качества жизни
- Независимый параметр, определяющий результаты лечения
KIT
- Инструмент оценки качества жизни, специфичный для ИТП
- Разработан Канадской группой (Blanchette, Klassen, Bernard)
- Валидация в США и в международном масштабе (Великобритания, Франция, Уругвай, Германия)
- Применительно к ребенку и к лицу, осуществляющему уход за ним (родителям)
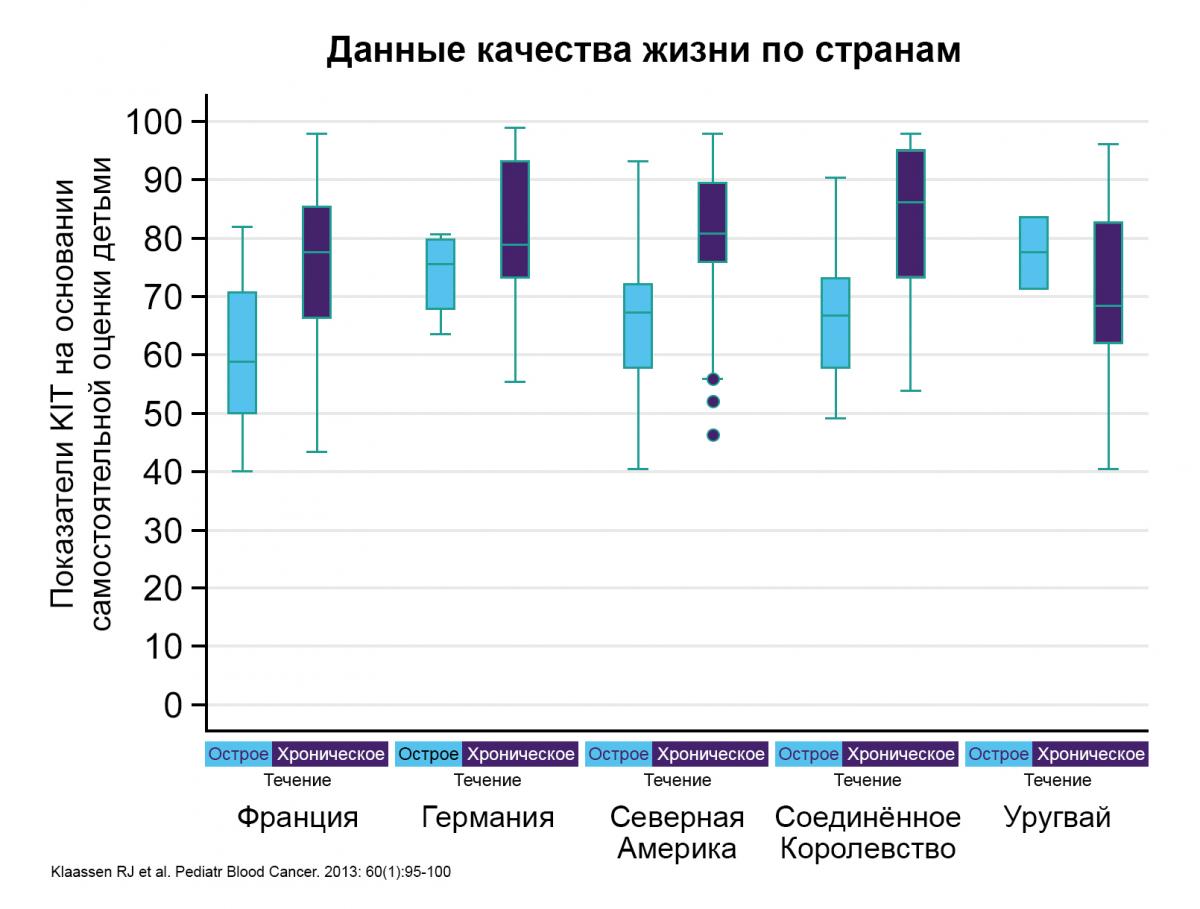
Данные качества жизни по странам10,11
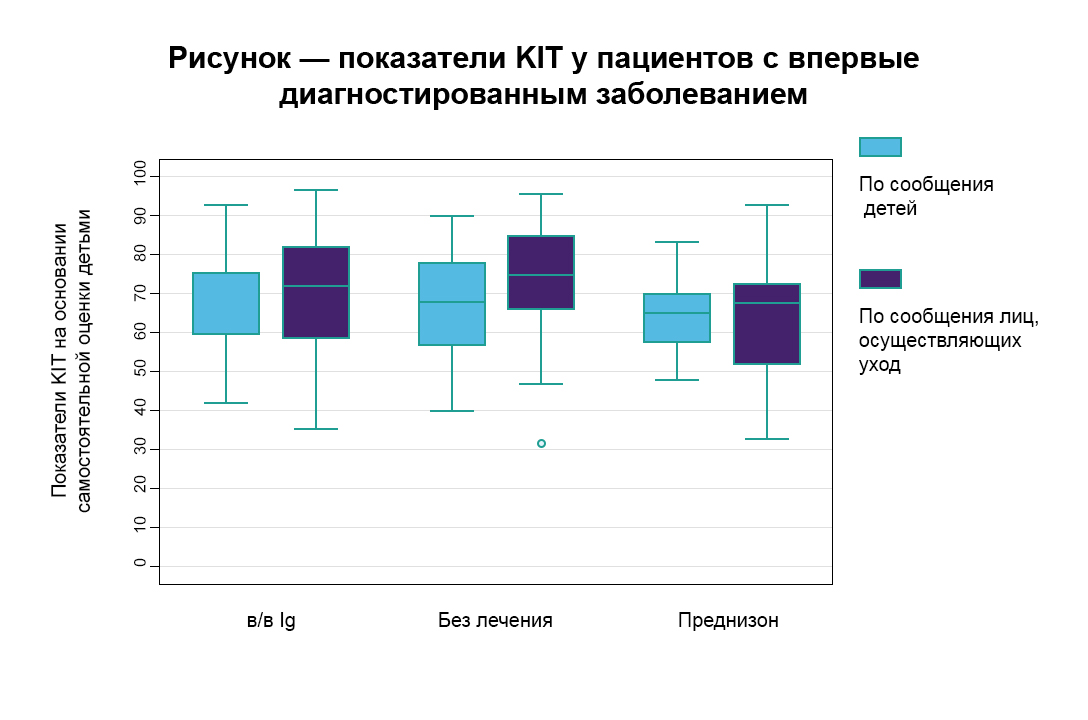
Возможные проблемы: впервые диагностированное заболевание12
Риск кровотечений наиболее высок при уровнях тромбоцитов <20
- У >80% при первом обращении уровни тромбоцитов <20, при этом кровотечений нет
- В большинстве случаев происходит быстрое улучшение без каких-либо вмешательств
- Нет объективных данных в пользу того, что лечение предотвращает кровотечения
Тяжелые кровотечения у 3-4%
- Предиктивного теста нет
Решения по выбору терапии4,11,12
Терапия, позволяющая повысить уровни тромбоцитов
- Активное кровотечение в единственной локализации
- Кровотечения во множестве локализаций
- Подтвержденный диагноз
Факторы со стороны пациента
- Возраст, сопутствующие заболевания, образ жизни
Социальные факторы
- Ответственность родителей, расстояние до клиники, стоимость лечения
Факторы со стороны заболевания
- Предшествующее течение заболевания, тяжесть кровотечений в анамнезе, ранее достигнутые ответы
Впервые диагностированная ИТП4-6,12
Поддерживающая терапия
Стероиды
- Тип стероида, доза, длительность лечения
- Длительность ответа
- Значимые побочные эффекты
Иммуноглобулин (в/в Ig) и WinRho
- Продукты крови, полученные из пула
- Значимые побочные эффекты
Возможности ведения пациентов: тактика активного наблюдения3,13,14
| ЗА | ПРОТИВ |
|---|---|
| Спонтанные ремиссии или «излечение» - до 10% детей за год | Могут ограничивать медицинские компоненты качества жизни |
| У большинства детей и взрослых тяжелые кровотечения отсутствуют | Сохраняется риск тяжелых или угрожающих жизни кровотечений |
| Низкая стоимость | Нежелательные эффекты препаратов, используемых по поводу возникающих кровотечений |
Тактика активного наблюдения: противоречивые вопросы3,13,14
Когда следует вмешаться?
- Частые кровотечения? Более трех эпизодов лечения за 6 месяцев?
- Тяжелые кровотечения? Однократный эпизод?
- Отсутствие ответа на пробное применение стероидов?
- Сопутствующие заболевания?
Коррекция образа жизни и модификация течения заболевания
- Степень нарушения медицинских компонентов качества жизни
- Степень ограничений со стороны образа жизни
- Летаргия
Спленэктомия3,4,14
| «Излечение» у 2/3 – 3/4 пациентов | Эффективна «только» у 2/3 – 3/4 пациентов |
| Побочные эффекты процедуры малораспространены | Риск возникновения необходимости в дополнительной спленэктомии |
| По-видимому, низкая частота поздних кровотечений после спленэктомии, в особенности при лапароскопическом доступе | Вопрос об оптимальной профилактике сепсиса остается открытым |
| Низкая частота сепсиса после спленэктомии | Высокая стоимость |
| Риск периоперационных кровотечений | |
| Риск утраты моноцитов, которые могут играть роль в снижении активности заболевания и оставаться в селезенке | |
| Неэффективность анти-D после спленэктомии | |
| Необратимость процедуры | |
| Потенциальные долгосрочные побочные эффекты: легочная гипертензия, тромботические эпизоды, сепсис и злокачественные новообразования |
Спленэктомия – риск инфекционных осложнений15
Роль селезенки
- Фильтр, способствующий устранению микроорганизмов, старых или поврежденных эритроцитов
- Хранение железа, эритроцитов и тромбоцитов
- Фагоцитоз клеток или микроорганизмов, покрытых антителами
- Синтез IgM B-лимфоцитами памяти
- Удаление опсонизированных бактерий макрофагами
- Хранение и мобилизация моноцитов, вовлеченных в регуляцию воспалительного процесса
Bisharat 2001
- Мета-анализ с 1966 по 1996 годы
- ИТП: 2% инвазивных инфекций, 1,2% смертность
- Частота ниже при ИТП, чем при других состояниях (большой талассемии)
- Максимальный риск у детей
- Максимальный риск в первые 90 дней (относительный риск 33,6), однако сохраняется >1 года (относительный риск 2,3)
Спленэктомия – прочие риски16
Сосудистые осложнения
ТГВ или ТЭЛА 0,6, 0,7% в первые 90 дней
- — Относительный риск 32,6, относительный риск 3,4 >1 года
Тромбоз воротной вены
- — Возможное распространение тромбоза культи селезеночной вены
- — КТ-признаки в 55% случаев после лапароскопической процедуры, по сравнению с 19% после открытого доступа
- — 1,6% с симптоматикой
- — Низкая частота при ИТП по сравнению со спленэктомиями по другим показаниям
Злокачественные новообразования
- Увеличение риска на 50%
Спленэктомия – противоречивые вопросы16
Длительность ожидания
- Целесообразность отсрочить до >12 месяцев длительности заболевания?
- Целесообразность отсрочить до возраста в >5 лет?
Роль сканирования аутологичных тромбоцитов с индием-111?
Следует ли сначала убедиться в неэффективности дальнейших методов консервативного лечения?
Ритуксимаб4,5,12,17
| Эффективность в по крайней мере 33% случаев, с нормализацией уровней тромбоцитов продолжительностью 6-12 месяцев | Долгосрочная токсичность недостаточно хорошо описана в какой-либо популяции, тем более у детей |
| Удовлетворительная переносимость без явных признаков выраженной токсичности инфузий, при низкой начальной скорости введения и при условии премедикации | Риск длительной иммуносупрессии, развития ПМЛ и активации вирусного гепатита B |
| Еженедельное введение на протяжении 4 недель, с последующим «завершением» терапии | Высокая стоимость |
| Эффективность как до, так и после спленэктомии | Частота стойких ответов на ритуксимаб не превышает 40% |
| Возможность повторного применения при рецидиве у пациентов, первоначально достигших ответа | Предикторные факторы, позволяющие прогнозировать ответы на ритуксимаб, не описаны |
| Отсутствие блокирующих эффектов в отношении прочих видов терапии ИТП | Сывороточная болезнь у неясного процента пациентов |
| Отсутствие рандомизированных исследований; препарат не зарегистрирован для лечения ИТП |
Сравнение ритуксимаба и плацебо18
Рандомизированное, двойное слепое, плацебо-контролируемое исследование
60 пациентов (>18 лет)
После 6 месяцев разницы в результатах не выявлено
- По уровням тромбоцитов
- По тяжести кровотечений
- По применению дополнительных методов терапии
Ритуксимаб – противоречивые вопросы14,18
Введение?
- Доза: 375 мг/м2 при общей дозе в 100 мг
- Количество доз
Эффективна ли терапия?
Можно ли увеличить число ответов?
- Комбинация с дексаметазоном
- Поддерживающая терапия
Риск осложнений
- Реактивация вирусов: ВИЧ, гепатиты
- Прогрессирующая мультифокальная лейкоэнцефалопатия (JC-вирус)
- Идиопатический пневмонит
Агонист рецепторов TPO4,5,12,17,19
| Множество плацебо-контролируемых исследований | Лечение не носит радикальный характер |
| Проценты ответов выше, чем при использовании других видов терапии второй линии | Рикошетная тромбоцитопения после отмены |
| Эффективны как до, так и после спленэктомии | Неизвестна долгосрочная безопасность, включая потенциальную возможность фиброза костного мозга |
| Ответы почти всегда сохраняются даже на фоне продолжения терапии другими препаратами | Высокая стоимость |
| Объективные признаки улучшения качества жизни | Потенциальная возможность развития тромбозов |
| Хорошая переносимость | В редких случаях – потенциальная возможность развития злокачественных новообразований |
| Зарегистрированы по всему миру для лечения хронической ИТП у взрослых пациентов | Опасения, связанные с гепатотоксичностью одного из препаратов |
Обзор: лечение хронической ИТП4-6,12,21
Тактика активного наблюдения
- Подходит большинству детей
Спленэктомия
- Только при длительности ИТП >12 месяцев
- Утрата эффективности по крайней мере одного из видов консервативного лечения?
Ритуксимаб
- Возможно, не превосходит плацебо
- Отсутствие клинических исследований, тем более у детей
- Рассмотреть такую возможность при ограниченных перспективах назначения агонистов TPO-R или плохой комплаентности
Агонист TPO-R
- Зарегистрирован для применения у взрослых; имеются данные педиатрических клинических исследований
- В Великобритании требуется финансирование NHS England или участие в клинических исследованиях
- Необходимость регулярного мониторинга
Иммунная тромбоцитопения (ИТП) у детей: руководства, существующие на данный момент
Стандартизация2
Задачи терапии
- Избежать необоснованного лечения в наименее тяжелых случаях, в особенности у детей
- Минимизировать объем применения стероидов
- Добиться безопасных уровней тромбоцитов (>30 x 109/л)
- Улучшить медицинские компоненты качества жизни (HRQoL)s
Руководства по изучению и лечению ИТП у взрослых, у детей и во время беременности3,6,12,22
- У детей с острой ИТП и легким клиническим течением может быть достаточно поддерживающих рекомендаций и возможности круглосуточного контакта с врачом, независимо от числа тромбоцитов (рекомендация степени В).
- В случае кровотечения из слизистых оболочек и более обширных кожных симптомов у ребенка эффективны большие дозы преднизолона (4 мг/кг/сут) (рекомендация степени А, доказательства уровня Ib).
- Внутривенный иммуноглобулин (в/в Ig) может позволить быстро повысить число тромбоцитов, но его следует использовать для экстренной терапии серьезных кровотечений или у детей, проходящих процедуры, вероятно, приводящие к потере крови. Он эффективен в однократной дозе 0,8 г/кг (доказательства уровня Ib, рекомендация степени A).
- Детям с хронической ИТП обычно не требуется активная терапия, но требуется регулярное наблюдение.
- Спленэктомия редко показана при ИТП у детей. Иногда она обоснована при угрожающих жизни кровотечениях, а также у детей с хронической, стойкой и тяжелой ИТП, присутствующей более 12-24 месяцев, с заметным ухудшением качества жизни.
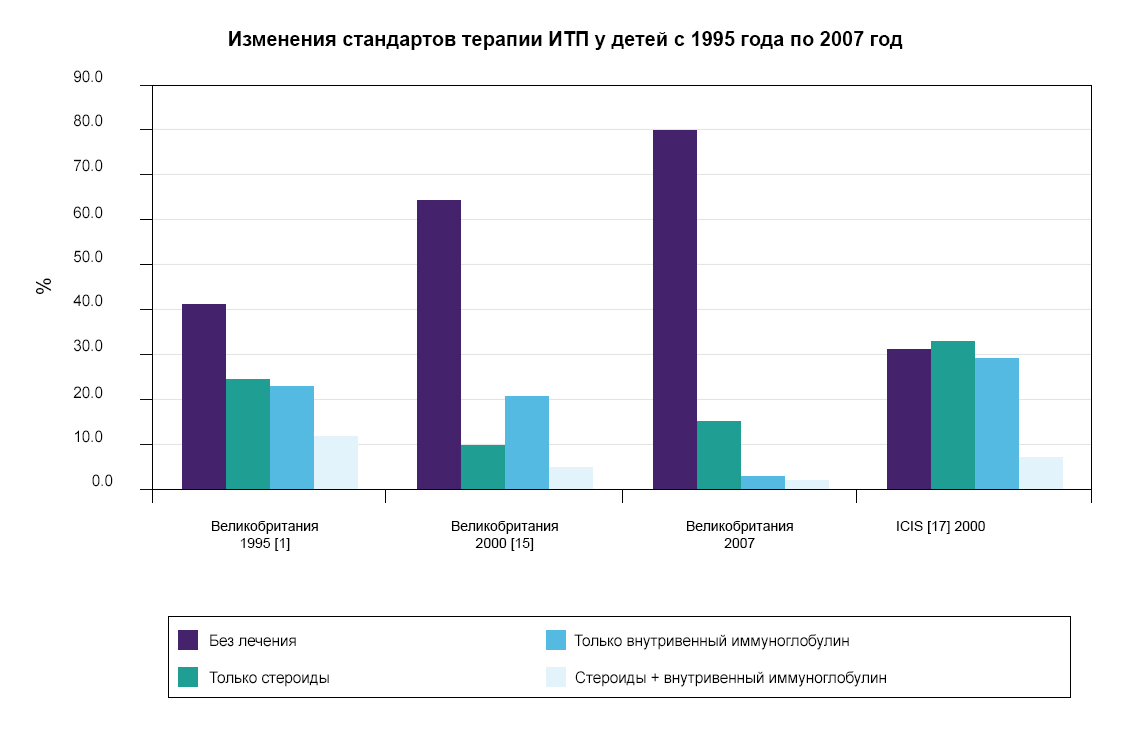
Вариативность показателей терапии иммунной тромбоцитопении у детей в разных странах
| Страна | Ссылка | Обзорный период (лет) | Пациенты (n) | Частота терапии | Заболеваемость |
|---|---|---|---|---|---|
| USA | Kime et al (2013) | 2 (2008-2010) | 2314 | 72% | ВЧК 0-6% |
| Скандинавские страны | Rosthoj et al (2012) | 5 | % | ВЧК 1% | |
| Великобритания | Grainger et al (2012) | 5 | 225 | 16%* | ВЧК 0-5% |
| Япония | Shirahata et al (2009) | 5 | 986 | 64% | |
| Южная Африка | Paling and Stefen (2008) | 10 | 106 | 81%* | ВЧК 3% |
| Италия | Del Vecchio et al (2008) | 609 | 75% | ||
| Канада | Bdletrutti et al (2007) | 10 (1994-2003) | 198 | 90%* | ВЧК 0% |
ВЧК = внутричерепное кровотечение;
* Частота лечения 61% в 1995 году, 38% в 2003 году;
** Частота лечения была более низкой в период с 1999 по 2003 год;
| Кровотечение/качество жизни | Подход к лечению |
|---|---|
| Степень 1. Малое кровотечение, малое число петехий (всего ≤100) и/или ≤5 небольших синяков (диаметром не более 3 см); без кровотечений из слизистых оболочек. | Согласие на наблюдение. |
| Степень 2. Легкое кровотечение, много петехий (более 100) и/или более 5 крупных синяков (диаметром более 3 см); без кровотечений из слизистых оболочек. | Согласие на наблюдение или лечение некоторых детей. |
| Степень 3. Умеренное кровотечение, скрытое кровотечение из слизистых оболочек, затруднения образа жизни. | Вмешательство у некоторых детей с целью достижения степени 1/2. |
| Степень 4. Кровотечения из слизистых оболочек или подозрение на внутреннее кровотечение. | Вмешательство. |
Модифицировано на основе Buchanan & Adix177; Bolton-Maggs & Moon170; Imbach et al1
Лечение ИТП у детей: международный согласованный отчет12
- Целью терапии у детей с стойкой или хронической ИТП является поддержание гемостатического числа тромбоцитов препаратами первой линии (внутривенным иммуноглобулином, внутривенным анти-D, короткими курсами кортикостероидов) и минимизация пролонгированных курсов кортикостероидов.
- Варианты терапии для детей с хронической ИТП перечислены в алфавитном порядке, не указывающем на предпочтение.
- Агонисты TPO-R: Учитывая, что подтверждена длительная безопасность этих препаратов, они могут использоваться не только у детей с хронической рефрактерной ИТП, но также у детей с стойким и выраженно симптоматическим заболеванием, резистентным к обычным препаратам первой линии.
Рекомендации ASH 201123
Адекватная терапия второй линии при ИТП у детей
- Ритуксимаб может рассматриваться для лечения детей или подростков с ИТП и значительным продолжающимся кровотечением, несмотря на терапию внутривенным иммуноглобулином, анти-D или стандартными дозами кортикостероидов (степень 2C). Ритуксимаб также может являться альтернативой спленэктомии у детей и подростков с хронической ИТП или у пациентов, не отвечающих на спленэктомию (степень 2C).
- Спленэктомия у детей и подростков с хронической или стойкой ИТП и значимыми или стойкими кровотечениями, а также отсутствием ответа или непереносимостью других видов терапии, в том числе кортикостероидов, в/в Ig, анти-D, и/или у которых имеется потребность в улучшении качества жизни (степень 1В).
- Продолжаются исследования агонистов TPO-R у детей и подростков, но результаты в настоящее время не опубликованы. Таким образом, нельзя сделать рекомендации о применении данных препаратов.
Обзор руководств4,12,22
Таргетная терапия в зависимости от тяжести кровотечения и связанного со здоровьем качества жизни.
Первичный диагноз
- Кортикостероиды, в/в Ig, анти-D в случае кровотечений
Стойкая или хроническая ИТП
- В большинстве случаев вмешательство не требуется
- На момент подготовки руководств IWG и ASH доказательства отсутствовали
- Хирургический подход: спленэктомия
- Терапевтический подход: ритуксимаб (и агонисты TPO-R?)
Национальные рекомендации по применению агонистов TPO-R при ИТП у взрослых25
NICE: National Institute of Clinical Excellence
FDA: Food and Drug Administration
Как лечить хроническую ИТП у детей6,14,26
- У большинства детей с хронической ИТП она протекает бессимптомно, за исключением образования синяков.
- У большинства детей с хронической ИТП происходит спонтанное улучшение или ремиссия, с вмешательством или без него.
Кому проводить лечение?6,14,26
Частые кровотечения, особенно меноррагия
Тяжелые кровотечения
Сопутствующие заболевания
Отсутствие ответа или непереносимость терапии первой линии
Качество жизни
- Летаргия
- Нарушение активности
Как лечить?6,14,26
Попробовать наблюдение с применением стероидов или в/в Ig при прорывных кровотечениях
- Рассмотреть пробную терапию, если она не применялась ранее
Спленэктомия должна выполняться только для пациентов с неудачей терапевтического лечения
Начальное медикаментозное лечение определяется
- Предпочтениями и ожиданиями пациента
- Опытом врача
- Финансированием/стоимостью
- Доступными клиническими исследованиями
Иммунная тромбоцитопения (ИТП) у детей: результаты исследования PETIT2
Введение12,21,28-41
В 15%–30% случаев острая ИТП у детей переходит в хроническую
- Вероятно сохранение тромбоцитопении и риска кровотечений
- Продолжающиеся ограничения образа жизни
Не существует стандарта терапии хронической ИТП у детей
Для многих неприемлемы риски отдаленных последствий доступной в настоящее время терапии
Элтромбопаг
- Пероральный, непептидный агонист TPO-R
- Увеличивает выработку тромбоцитов за счет стимуляции дифференцировки и пролиферации мегакариоцитов
- Зарегистрирован для лечения тромбоцитопении у взрослых с хронической ИТП
В исследовании PETIT II фазы были получены предварительные данные безопасности и эффективности элтромбопага при хронической ИТП у детей
PETIT2 – исследование III фазы с целью подтверждения эффективности, безопасности и переносимости элтромбопага при хронической ИТП у детей.
PETIT: Элтромбопаг у детей с тромбоцитопенией на фоне ИТП (Eltrombopag in PEdiatric patients with Thrombocytopenia from ITP)
Дизайн исследования PETIT221
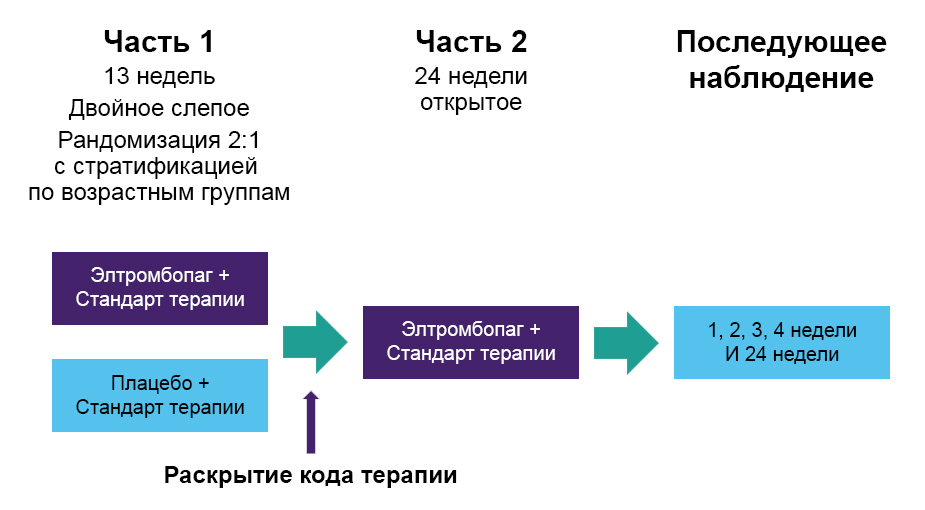
Допускалось продолжение ранее начатой терапии по поводу ИТП, а также применение дополнительной терапии
Отбор пациентов21
Критерии участия:
- Возраст от 1 до <18 лет
- Число тромбоцитов <30 х109/л в день 1
- Подтвержденный диагноз хронической ИТП в течение по крайней мере 12 месяцев
- Рефрактерное течение или рецидив после по крайней мере 1 линии терапии
- Ранее не получали агонистов TPO-R
Субпопуляции:
- Субпопуляция 1: 12–17 лет
- Субпопуляция 2: 6–11 лет
- Субпопуляция 3: 1–5 лет
Первичная конечная точка21,41
PETIT:
- Ответ: Доля пациентов, достигших числа тромбоцитов ≥50 х109/л по крайней мере 1 раз между неделями 1 и 6 в отсутствии дополнительной терапии.
PETIT2:
- Пациенты с ответов: Доля пациентов, достигших числа тромбоцитов ≥50 х109/л (без дополнительной терапии) в течение по крайней мере 6 из 8 недель между неделями 5 и 12 в двойном слепом периоде.
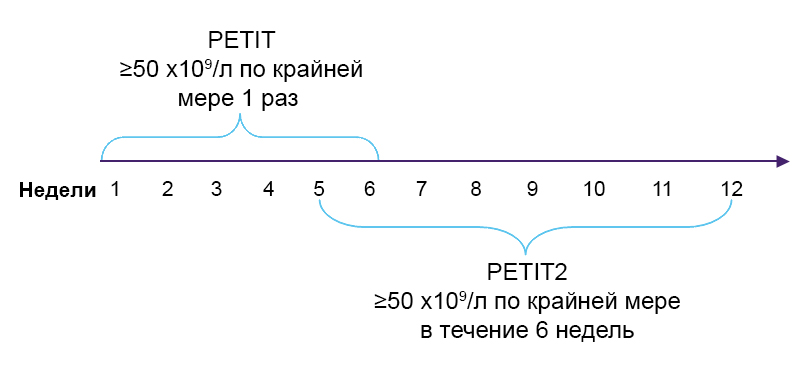
Вторичные конечной точки21
- Безопасность и переносимость
- Ответ: Доля пациентов, достигших числа тромбоцитов ≥50 х109/л по крайней мере 1 раз между неделями 1 и 6 в отсутствии дополнительной терапии
- Ответ в любой момент в течение 6 или 12 недель
- Потребность в дополнительной терапии
- Частота кровотечений по классификации ВОЗ
- Максимальный период поддержания числа тромбоцитов ≥50 х109/л
Исходные характеристики: двойное слепое исследование, все субпопуляции21
| Характеристики | Плацебо (n = 29) | Элтромбопаг (n = 63) |
|---|---|---|
| Возраст, лет | 9,4 | 9,8 |
| Мужской пол, % (n) | 52% (15) | 52% (33) |
| Масса тела, кг | 42.7 (33.2-52.3) | 41 (35.5-46.4) |
| Тромбоциты ≤15 х109/л, % (n) | 66% (19) | 60% (38) |
| Медиана времени с постановки диагноза ИТП (месяцев) | 53 (40.3) | 41 (34.1) |
| Терапия ИТП в начале исследования, % (n) | 3.4% (1) | 21% (13) |
| Терапия ИТП в анамнезе, % (n) | 97% (28) | 95% (60) |
| Ритуксимаб, % (n) | 21% (6) | 14% (9) |
| Спленэктомия, % (n) | 0% (0) | 6% (4) |
| Раса: Восточноазиатское происхождениеa; Европеоидная расаb, % (n) | 34% (10); 66% (19) | 32% (20); 68% (43) |
a Восточно-азиатское происхождение = пациенты японского, восточноазиатского или юго-восточноазиатского происхожденияb Европеоидная раса = пациенты арабского происхождения или из Северной Африки, пациенты европеоидной расы
Первичная конечная точка21
- Пациенты с ответов: Доля пациентов, достигших числа тромбоцитов ≥50 х109/л (без дополнительной терапии) в течение по крайней мере 6 из 8 недель между неделями 5 и 12 в двойном слепом периоде.
| Плацебо (n = 29) | Элтромбопаг (n = 63) | |
| Доля пациентов с ответом, % (n) | 3% (1) | 40% (25) |
| Отношение шансов, 95% Доверительный Интервал (элтромбопаг по сравнению с плацебо) | 18.0 (2.3, 140.9) | |
| P-значениеa (элтромбопаг по сравнению с плацебо) | 0.0004 | |
a Означает значимость на двустороннем уровне в 5%
Первичный ответ в зависимости от субпопуляции21
12–17 лет | 6–11 лет | 1–5 лет | ||||
|---|---|---|---|---|---|---|
Плацебо | Элтромбопаг | Плацебо | Элтромбопаг | Плацебо | Элтромбопаг | |
| Терапия | (n = 10) | (n = 23) | (n = 13) | (n = 26) | (n = 6) | (n = 14) |
| Пациенты с ответом, % (n) | 10% (1) | 39% (9) | 0% (0) | 42% (11) | 0% (0) | 36% (5) |
| 95% ДИ | 0%, 45% | 20%, 61% | NA | 23%, 63% | NA | 13%, 65% |
ДИ = доверительный интервал; NA = нет доступных данных.
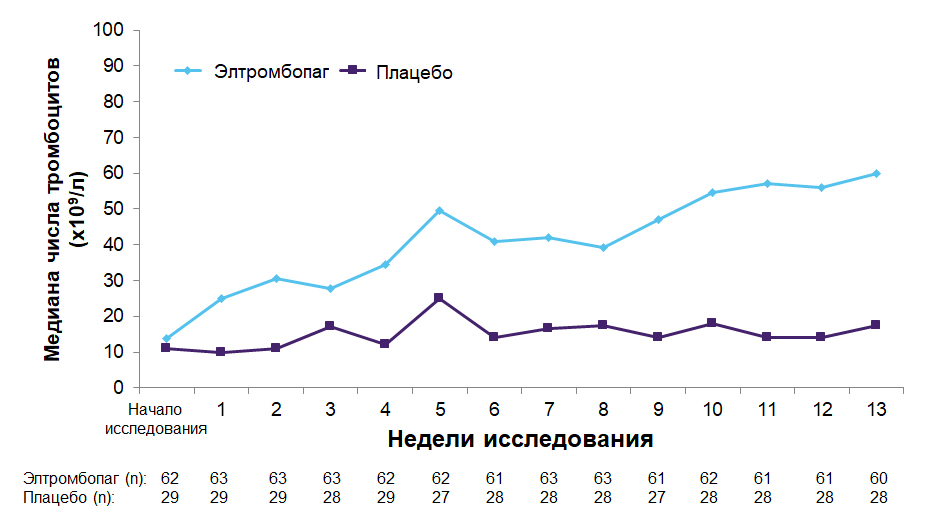
Медиана числа тромбоцитов в двойной слепой фазе исследования21
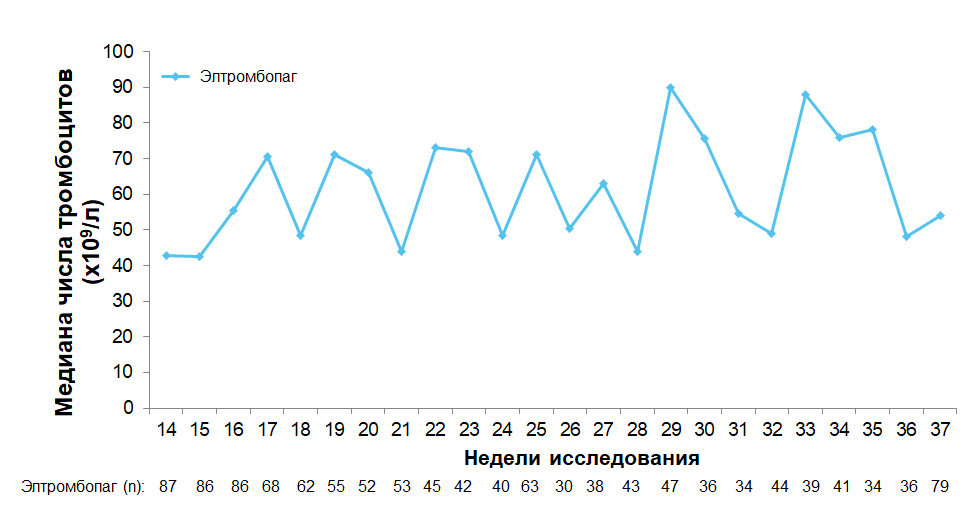
Медиана числа тромбоцитов в открытой фазе исследования21
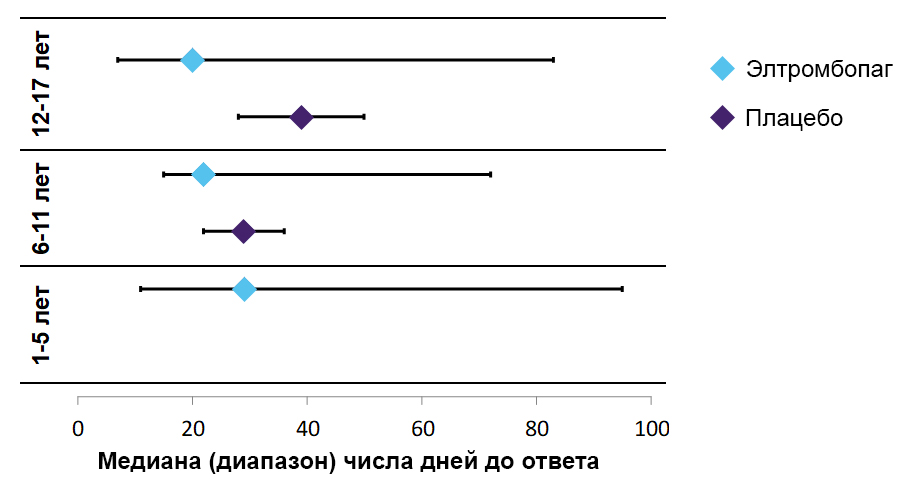
Медиана (диапазон) времени до ответа в зависимости от субпопуляции21
Вторичные конечные точки: двойная слепая фаза21,40
Ответ/дополнительная терапия | Плацебо (n = 29) | Элтромбопаг (n = 63) |
|---|---|---|
Ответ в любое время за 6 недель, % (n) | 17% (5) | 62% (39) |
Ответ в любое время за 12 недель, % (n) | 21% (6) | 75% (47) |
Пациенты, нуждающиеся дополнительной терапии, % (n) | 24% (7) | 19% (12) |
Кровотечения по классификации ВОЗ | Плацебо (n = 29) | Элтромбопаг (n = 63) |
|---|---|---|
Начало исследования Степени 1–4 (любое кровотечение), % (n) | 69% (20) | 71% (45) |
Неделя 12 Степени 1–4 (любое кровотечение), % (n) | 55% (16) | 37% (23) |
Классификация кровотечений ВОЗ: степень 0 = кровотечение отсутствует; степень 1 = петехии; степень 2 = легкая потеря крови; степень 3 = выраженная потеря крови; степень 4 = инвалидизирующая потеря крови.
Вторичные конечные точки в открытой фазе исследования21,40
Ответ/дополнительная терапия | Элтромбопаг (n = 87) |
|---|---|
Ответ в любое время в течение 24 недель, % (n) | 81% (70) |
Ответ при ≥75% оценок в течение последних 12 недель открытой фазы, % (n) | 44% (38) |
Пациенты, нуждающиеся в дополнительной терапии, % (n) | 13% (11) |
Снижение или отмена сопутствующей терапии по поводу ИТП, % (n/N) | 53% (8/15) |
Кровотечения по классификации ВОЗ за 24 недели | Элтромбопаг (n = 79) |
|---|---|
Степени 1–4 (любое кровотечение), % (n) | 24% (19) |
Классификация кровотечений ВОЗ: степень 0 = кровотечение отсутствует; степень 1 = петехии; степень 2 = легкая потеря крови; степень 3 = выраженная потеря крови; степень 4 = инвалидизирующая потеря крови.
Нежелательные явления (по крайней мере 5% пациентов)21
- В исследовании PETIT2 не сообщалось о тромбоэмболических событиях или гематологических злокачественных опухолях.
| Нежелательные явления, % (n) | Двойная слепая фаза | |
|---|---|---|
Плацебо (n = 29) | Элтромбопаг (n = 63) | |
| Назофарингит | 7% (2) | 17% (11) |
| Ринит | 7% (2) | 16% (10) |
| Носовое кровотечение | 21% (6) | 13% (8) |
| Кашель | 0% (0) | 11% (7) |
| Инфекция верхних дыхательных путей | 3% (1) | 11% (7) |
| Боль в животе | 0% (0) | 10% (6) |
| Головная боль | 10% (3) | 10% (6) |
| Повышение уровня аспартатаминотрансферазы | 0% (0) | 6% (4) |
| Повышение температуры тела | 6% (4) | 6% (4) |
Серьёзные нежелательные явления21
| Серьёзные нежелательные явления, % (n) | Двойная слепая фаза | |
|---|---|---|
Плацебо (n = 29) | Элтромбопаг (n = 63) | |
| Все события | 14% (4) | 8% (5) |
| Гингивит | 0% (0) | 2% (1) |
| Грипп | 0% (0) | 2% (1) |
| Асептический менингит | 0% (0) | 2% (1) |
| Пневмония | 0% (0) | 2% (1) |
| Грибковая пневмония | 0% (0) | 2% (1) |
| Отклонение уровня аланинаминотрансферазы | 0% (0) | 2% (1)a |
| Отклонение уровня аспартатаминотрансферазы | 0% (0) | 2% (1)a |
| Носовое кровотечение | 3% (1) | 0% (0) |
| Петехии | 3% (1) | 0% (0) |
| Кровотечение | 3% (1) | 0% (0) |
| Гипертензивный криз | 3% (1) | 0% (0) |
a Расценено как связанное с исследуемым препаратом.
Общий обзор нежелательных явлений у всех пациентов21,40
Двойная слепая фаза | Открытая фаза | ||
Плацебо (n = 29) | Элтромбопаг (n = 63) | Элтромбопаг (n = 87) | |
| Нежелательные явления (НЯ), % (n) | 72% (21) | 81% (51) | 79% (69) |
| Серьёзные нежелательные явления (СНЯ), % (n) | 14% (4) | 8% (5) | 10% (9) |
| НЯ, связанные с исследуемым препаратом, % (n) | 10% (3) | 19% (12) | 20% (17) |
| НЯ, приведшие к выбыванию, % (n) | 3% (1) | 5% (3) | 3% (3) |
| НЯ степени 3 или 4, % (n) | 10% (3) | 13% (8) | 9% (8) |
- Повышение уровня аспартатаминотрансферазы/ аланинаминотрансферазы было наиболее частым событием, приводящим к отмене исследуемого препарата
Заключение21,40
В исследовании PETIT2 достигнута первичная конечная точка эффективности
- У 40% пациентов было достигнуто число тромбоцитов ≥50 х109/л без применения дополнительной терапии в течение по крайней мере 6 из 8 недель между неделями 5 и 12 двойной слепой фазы
- У 44% был достигнут ответ по крайней мере при 75% оценок за последние 12 недель открытой фазы
Клинический ответ
- Снижение кровотечений с 71% в начале исследования до 37% на неделе 12 и до 24% на неделе 24
- Снижение применения исходных препаратов по поводу ИТП у 52% детей
- Снижение применения дополнительной терапии с 19% в начале исследования до 13% в открытой фазе
Безопасность согласуется с известным профилем элтромбопага
- Не наблюдалось тромбоэмболических событий
- Отмечалось повышение уровня трансаминаз
- Очень мало случаев выбывания по причине НЯ
Список литературы
- Chessells JM et al. Lancet. 1995: 21;345(8943):143-8; Neunert CE et al. Blood. 2013 :30;121(22):4457-62
- Rodeghiero, Blood 2009; 113(11): 2386-2393
- Cooper N. Br J Haematol. 2014 Jun;165(6):756-67;
- Neunert CE et al. Blood. 2013 :30;121(22):4457-62;
- Blanchette V et al. Hematol Oncol Clin North Am. 2010 Feb;24(1):249-73
- Grainger JD et al. Arch Dis Child. 2012 Jan;97(1):8-11
- Kühne T et al. J Pediatr 2003;143(5):605; Lilleyman JS et al. Arch Dis Child 1994; 71(3):251
- Grainger JD et al. ASH 2012: Abstract 3334
- Young NL et al. Health Qual Life Outcomes. 2009 Oct 23;7:92
- Klaassen RJ et al. Pediatr Blood Cancer. 2013: 60(1):95-100
- Grainger JD et al. Arch Dis Child. 2013; 98(11):895-7
- Provan D et al. Blood. 2010;115(2):168-186
- Grainger JD et al. Ann Hematol .(2010) 89 (Suppl 1):S11–S17
- Kühne. T. Hematology Education: the education program for the annual congress of the EHA 2014;8:291-298
- Bisharat, N et al. J Infect. 2001;43:182–186
- Kristinsson et al. Haematologica. 2014; 99(2):392-8; Boyle et al. Blood. 2013;121(23):4782–4790
- Neunert CE. Hematology ASH Educ Program. 2013
- Arnold Dm et al. Blood 2012; 119(6): 1356
- Bussel et al. J. Pediatr Blood Cancer 2015;62:208–213
- Grainger JD, et al. Oral Presentation. EHA 2014
- Grainger JD, et al. Lancet. 2015 E-publication
- British Committee for Standards in Haematology General Haematology Task Force. Br J Haematol. 2003 Feb;120(4):574-96
- Neunert C, et al. Blood 2011; 117: 4190–207
- Rodeghiero F, et al. Blood 2013.121(14):2596-606
- FDA. PROMACTA Prescribing Information. 2015. [US Food and Drug Administration. Highlights of prescribing information. June, 2015. www.ассеssdata.fda.gov/drugsatfda_docs/label/2015/022291s015lbl.pdf (accessed August, 2015). Revolade SmPC. 2015. [www.mеdiсines.org.uk (accessed August 2015) National Institute of Clinical excellence. niсе.org.uk/guidance/ta293 (accessed August 015)]
- BSH GUIDELINES. Br J Haematol. 2003;120:574–596
- Grainger JD et al. Lancet 28 July 2015 E-Publicaiton
- Rodeghiero F, et al. Blood. 2009;113:2386-2393
- El-Bostany EA, et al. Blood Coagul Fibrinolysis. 2008;19:26-31
- Imbach P, et al. Pediatr Blood Cancer. 2006;46:351-356
- Bussel JB, et al. Blood. 2011;118:28-36
- Elalfy MS, et al. Blood. 2010;116:Abstract 1443
- Patel VL, et al. Blood. 2012; 21;119(25):5989-95
- Cooper N, Bussel JB. Curr Rheumatol Rep. 2010;12:94-100
- Bussel JB, et al. N Engl J Med. 2007;357:2237-2247
- Bussel JB, et al. Lancet. 2009;373:641-648
- Cheng G, et al. Lancet. 2011;377:393-402
- Bussel JB, et al. Blood. 2008;112:Abstract 3431
- Bussel JB et al. Oral Presentation. EHA 2014
- Grainger JD et al. Oral Presentation. EHA 2014
- Bussel JB et al. Lancet Haematol. 28 July 2015 E-Publication
11213634/REV/WEB/07.24/0