Informationen für Ihre Patienten
Entdecken Sie unser Patientenportal und erfahren Sie wichtige Informationen rund um die Multiple Sklerose.
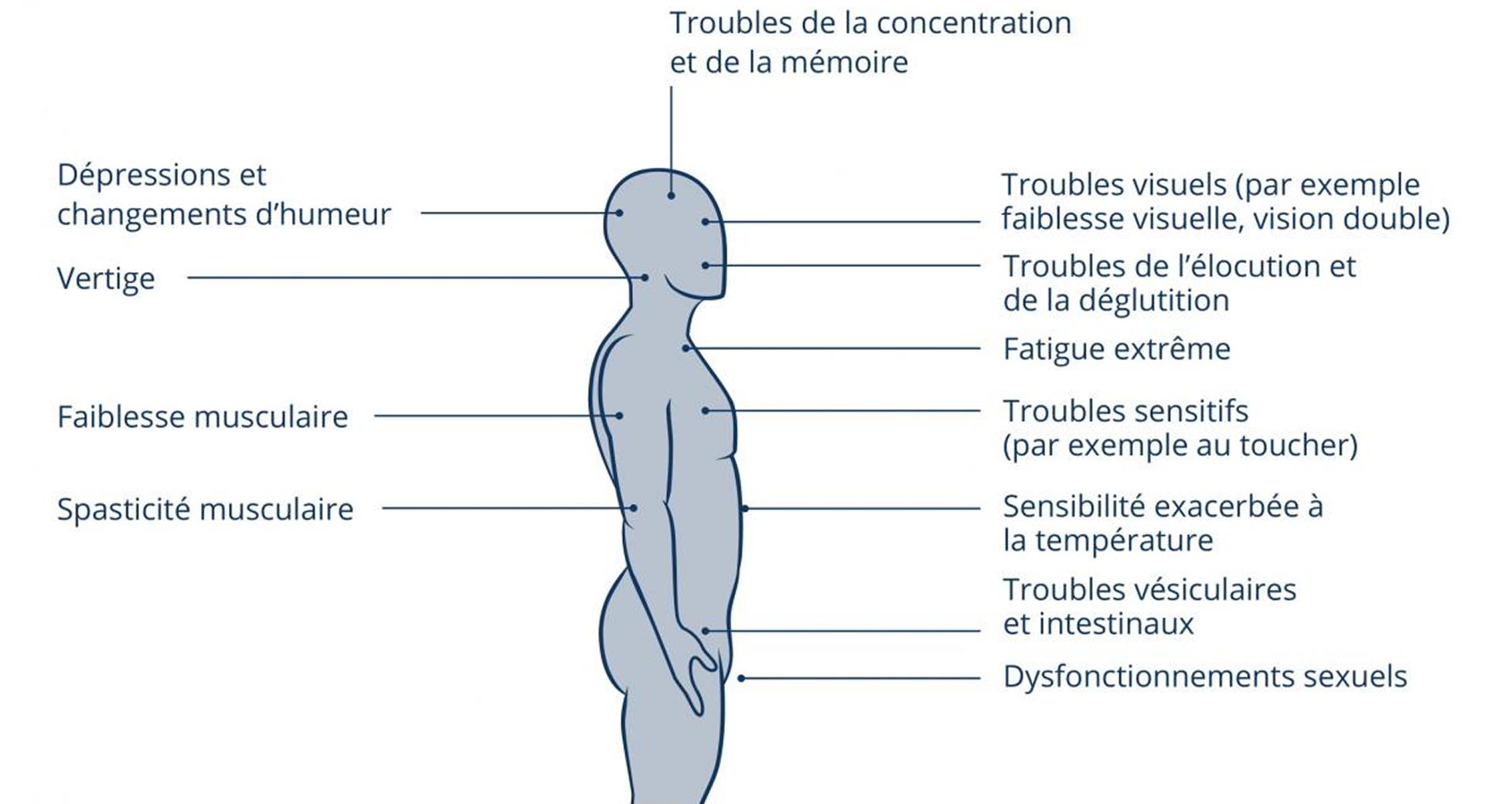
La sclérose en plaques (SEP) est une pathologie démyélinisante du système nerveux central caractérisée par des altérations neurologiques et un handicap progressif. Il existe une multitude de symptômes possibles qui diffèrent respectivement en fonction de l’évolution de la maladie et du patient. La fatigue, des troubles vésiculaires et/ou intestinaux, des déficits cognitifs, des altérations de la motilité, la spasticité ainsi que des troubles visuels comptent parmi les symptômes fréquents.1
Symptômes possibles de la SEP
Les limitations cognitives se manifestent à tous les stades de la sclérose en plaques. Cependant les patients atteints de la forme progressive en souffrent le plus fréquemment:
35 % des patients avec un syndrome clinique isolé (CIS),
45 % des patients avec une sclérose en plaques récurrente rémittente (SEP-RR),
79 % des patients avec une sclérose en plaques secondaire progressive (SEP-SP)
91 % des patients avec une sclérose en plaques primaire progressive (SEP-PP) présentent des déficits cognitifs.2
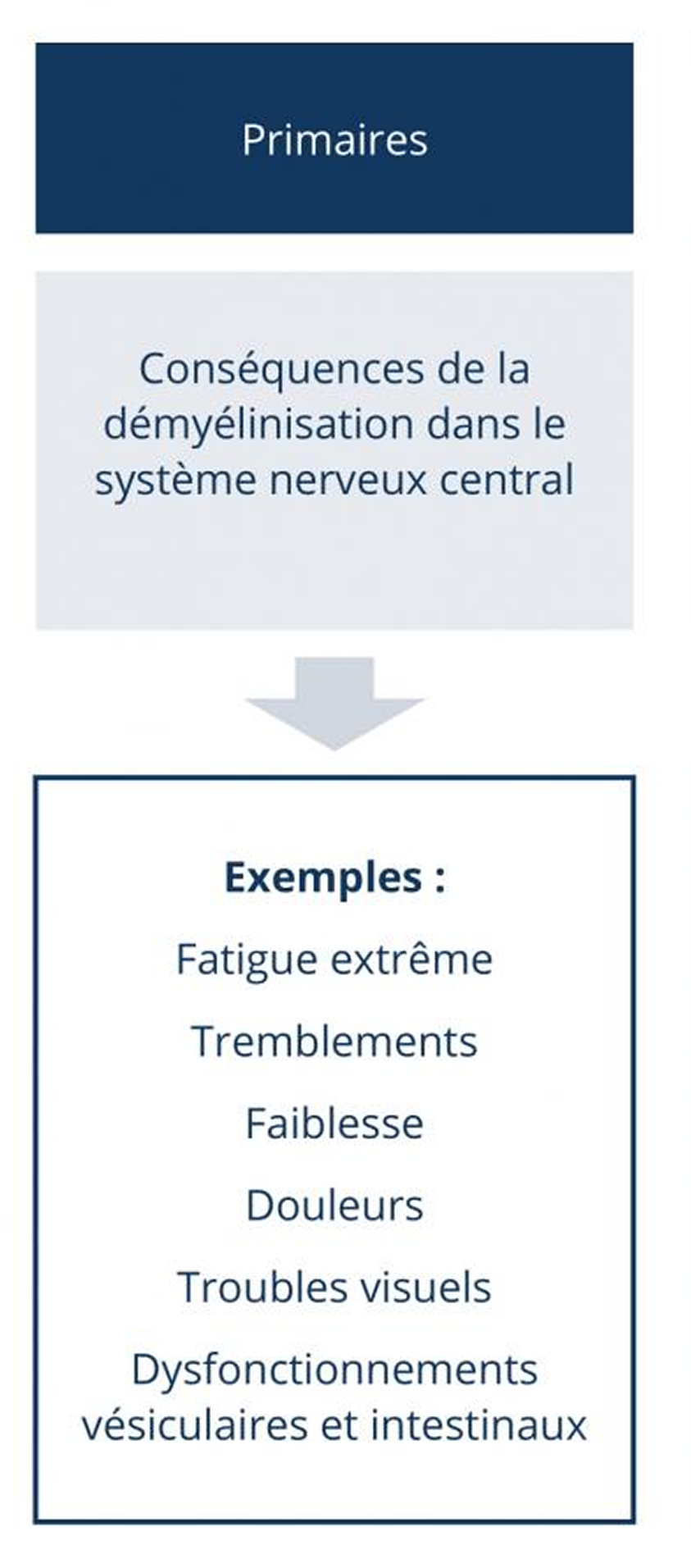
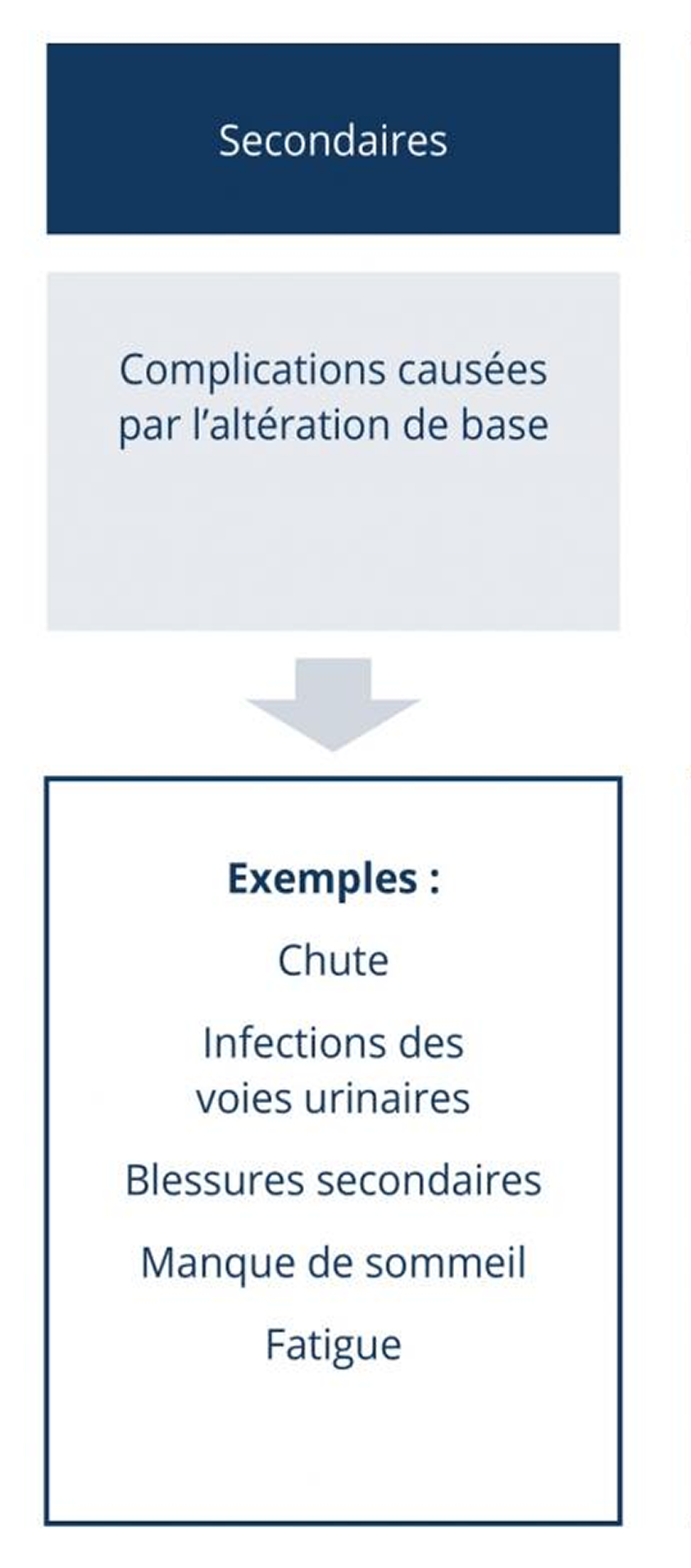
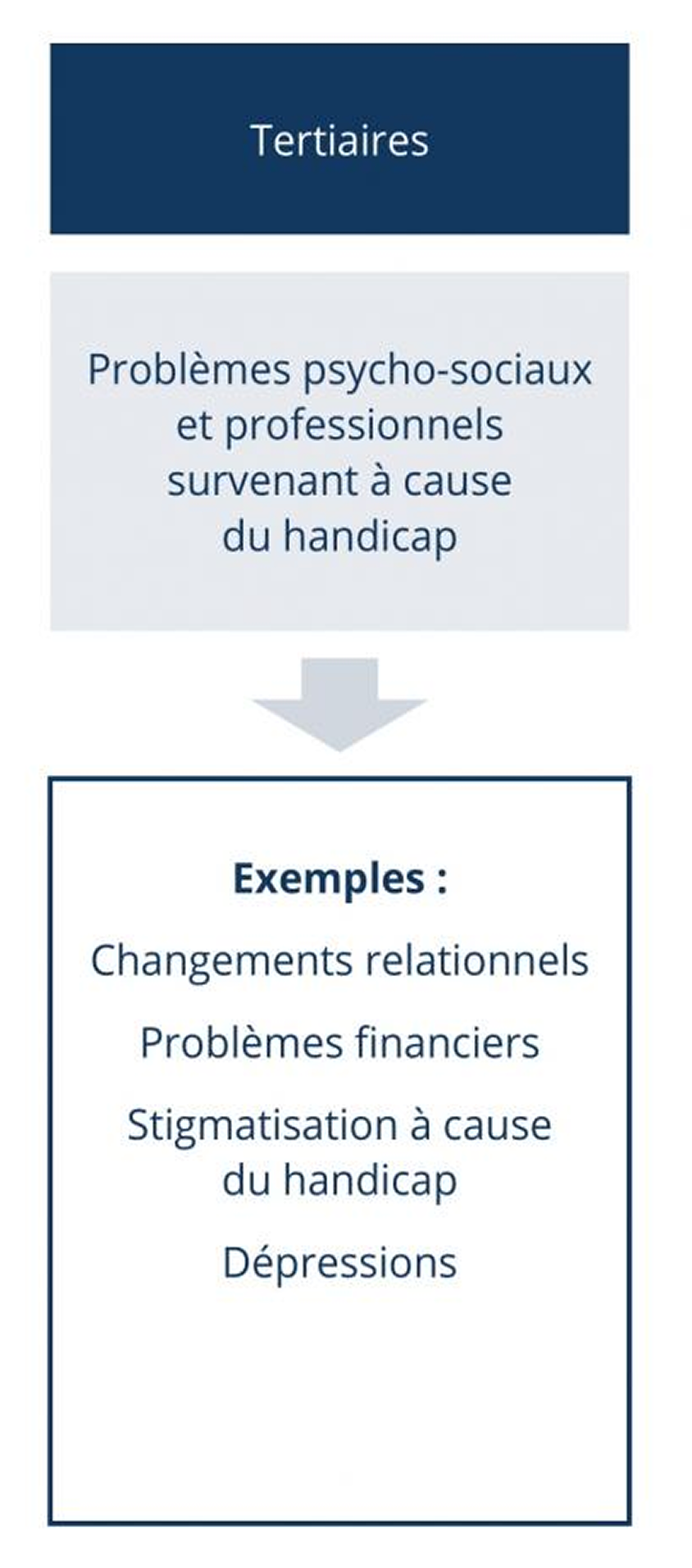
Les symptômes primaires induits par la démyélinisation (par exemple les tremblements ou les dysfonctionnements vésiculaires ou intestinaux) sont souvent la cause de symptômes secondaires (par exemple des chutes ou des infections des voies urinaires). L’altération de la mobilité, la baisse de la productivité ou la fatigue peuvent finalement causer des problèmes psychologiques. Les modifications de l’environnement privé, des problèmes financiers ou des dépressions peuvent résulter de différents symptômes, qui influencent donc considérablement la qualité de vie du patient (symptômes tertiaires).
Certains symptômes peuvent en causer d’autres
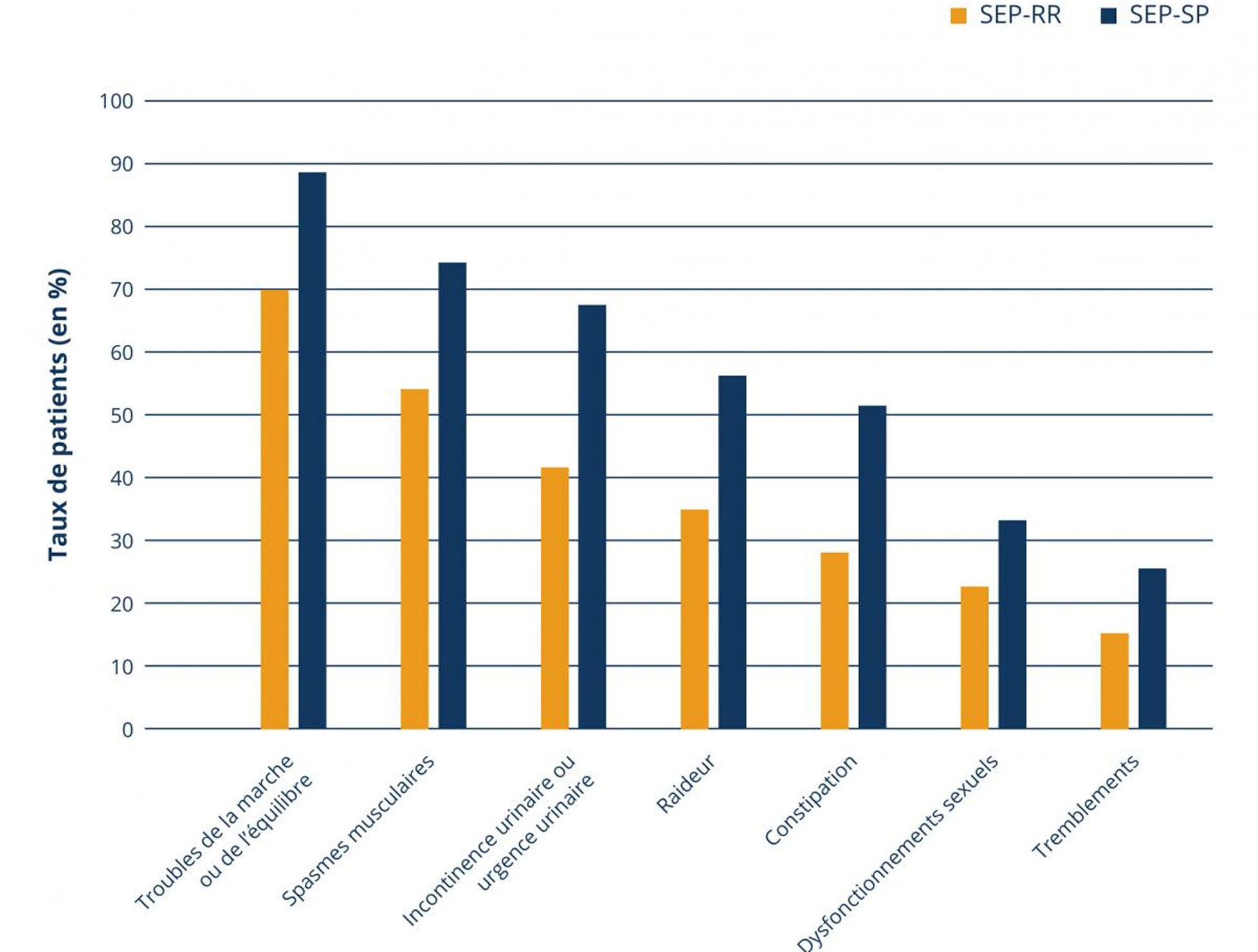
En cours d’évolution de la maladie, les lésions cérébrales s’accumulent. Au début, la perte de cellules nerveuses et l’atrophie cérébrale peuvent être compensée par les capacités de plasticité neuronale. Celles-ci ne sont toutefois pas infinies. Une fois que les capacités sont épuisées, le handicap progresse constamment sans aucune rémission.4 Les symptômes s’aggravent de plus en plus et l’atrophie cérébrale s’accroît.1,4 Une comparaisons entre les symptômes de patients avec une SEP-RR et une SEP-SP montrent la survenue accrue de symptômes en présence d’une progression secondaires (illustration 1).1
Survenue de symptômes chez le patients avec une SEP-RR ou avec une SEP-SP 1
En sus de l’aggravation des symptômes, les patients atteints de SEP-SP ont décrit leur maladie comme plus lourde et présentent un taux d’hospitalisation plus élevé que les patients atteints de SEP-RR.1 Une étude rétrospective menée en Suisse a montré que seulement 65 % des patients en âge de travailler et atteints de SEP-SP exerçaient une activité professionnelle.5 Une perte d’emploi va de pair avec la perte de l’indépendance. La sécurité financière ainsi qu’une partie de l’environnement social sont compromis.
Le diagnostic de la sclérose en plaques (SEP) se base sur une anamnèse exhaustive, l’exclusion de diagnostics différentiels et un examen neurologique permettant de déterminer la dissémination temporelle et spatiale des lésions.6,7
L’imagerie par résonance magnétique (IRM) met en évidence une poussée asymptomatique/silencieuse à travers l’observation des lésions. Celles-ci reflètent un ou plusieurs processus pathologiques possibles : démyélinisation, inflammation, œdème ou perte axonale.2 L’IRM en pondération T1 recourt souvent au gadolinium (Gd) comme agent de contraste. Les zones claires mettent en évidence des lésions réhaussées par le gadolinium (Gd+) qui démontrent une activité inflammatoire récente et une altération de la barrière hématoencéphalique. Il existe une corrélation entre les lésions Gd+ T1 et les poussées. À l’aide d’IRM en pondération T2, il est possible d’évaluer une activité pathologique cumulative.
Pour environ 85 % des patients, le premier diagnostic de SEP est celui d’une sclérose en plaques récurrente rémittente (SEP-RR)8 clairement définie sur la base des critères de McDonald.9
Critères d’une dissémination spatiale:9
au moins une lésion à hypersignal T2 dans au moins deux des quatre zones typiquement affectées par la SEP (périventriculaire, cortical à juxta-cortical, infratentoriel, moelle épinière) ou
poussée autrement localisée
Critères d’une dissémination temporelle:
mise en évidence d’une lésion réhaussée (Gd+) et d'une lésion non réhaussée ou
IRM d’évolution avec un nouvel hypersignal T2 et/ou une lésion réhaussée Gd+ ou
une deuxième poussée
Une ponction lombaire peut également être réalisée. L’analyse du liquide cérébrospinal permet de diagnostiquer différentes pathologies neurologiques et n’est pas spécifique à la SEP.6,7 Les résultats de cette analyse peuvent soit confirmer un diagnostic de sclérose en plaques (par exemple en cas de présence de bandes oligoclonales ou d’une augmentation de l’index IgG), soit contribuer à l’exclure.7
Il est également tenu compte de diagnostics complémentaires tels que les diagnostics paracliniques, par exemple des potentiels évoqués (sensoriels et moteurs), qui peuvent identifier des lésions cliniques silencieuses dans le système nerveux central.7
Alors que le diagnostic de la sclérose en plaques récurrente rémittente (SEP-RR) est clairement défini par les critères de McDonald9, des paramètres cliniquement définis ou des biomarqueurs de la progression font défaut, de sorte que le diagnostic de la sclérose en plaques secondaire progressive (SEP-SP) n’est souvent établi que rétrospectivement.10 Il est difficile de déceler une progression car les symptômes de la maladie sont très diversifiés et individuels.1,10,11 La progression de la maladie peut être constatée au moyen de tests mettant en évidence une aggravation insidieuse de différents symptômes.
Dans ce contexte, il est particulièrement important que ces tests soient réalisés régulièrement.11
La vitesse de traitement de l’information peut être déterminée au moyen du Symbol Digit Modalities Test (SDMT). Le test SDMT est un test cognitif considéré comme prédicteur de l’aptitude au travail.12 L’évaluation de la mobilité et de la capacité à marcher peut être effectuée au moyen du test de marche le Timed 25-Foot Walk (T25FW).13 Le test du 9-Hole Peg Test (9HPT) mesure la mobilité et la dextérité manuelle.14
L’échelle de l’Expanded Disability Status Scale (EDSS)15 sert à mesurer le degré du handicap des patients et de saisir la progression physique avec une évaluation neurologique régulière.
Exemple de tests adaptés à la pratique en cabinet médical
|
|
|
|
|
|
|
|
|
| |
|
|
|
|
Découvrez ici plus d'informations utiles sur la sclérose en plaques :
Gross HJ und Watson C. Characteristics, burden of illness, and physical functioning of patients with relapsing remitting and secondary progressive multiple sclerosis: a cross-sectional US survey. Neuropsychiatr Dis Treat. 13:1349–1357 (2017).
Ruano L et al. Age and disability drive cognitive impairment in multiple sclerosis across disease subtypes. Mult Scler. 23(9):1258-1267. doi: 10.1177/1352458516674367 (2017).
Crayton H, et al. A multimodal approach to managing the symptoms of multiple sclerosis. Neurology 2004:63(11 Suppl 5):S12–S18.
Baecher-Allan C et al. Multiple Sclerosis: Mechanisms and Immunotherapy. Neuron. 97(4):742–768 (2018).
Calabrese P et al. New insights into the burden and costs of multiple sclerosis in Europe: results for Switzerland. Mult Scler. 23:192-203 (2017).
Yamout B et al. Consensus recommendations for the diagnosis and treatment of multiple sclerosis: 2019 revisions to the MENACTRIMS guidelines. Mult Scler Relat Disord. 37:101459. doi: 10.1016/j.msard.2019.101459 (2019).
Filippi M et al. Multiple sclerosis. Nat Rev Dis Primers. 4(1):43 (2018).
Dendrou CA et al. Immunopathology of multiple sclerosis. Nat Rev Immunol. 15(9):545–558 (2015).
Thompson AJ et al.. Diagnosis of multiple sclerosis: 2017 revisions of the McDonald criteria. Lancet Neurol. 17(2):162–173 (2018).
Inojosa H et al. A focus on secondary progressive multiple sclerosis (SPMS): challenges in diagnosis and definition. J Neurol. 268, pages1210–1221 (2021).
Torkildsen O et al. Living with secondary progressive multiple sclerosis in Europe: perspectives of multiple stakeholders. Neurodegener Dis Manag. 11(1):9-19. doi: 10.2217/nmt-2020-0054 (2021).
Benedict RHB et al. Validity of the Symbol Digit Modalities Test as a cognition performance outcome measure for multiple sclerosis. Mult Scler. 23(5):721–733 (2017).
Motl RW, Cohen JA, Benedict R et al. Validity of the timed 25-foot walk as an ambulatory performance outcome measure for multiple sclerosis. Mult Scler; 23 (5): 704–710 (2017)
Feys P, Lamers I, Francis G et al. The Nine-Hole Peg Test as a manual dexterity performance measure for multiple sclerosis. Mult Scler 2017; 23: 711–720
Kurtzke JF. Rating neurologic impairment in multiple sclerosis: an expanded disability status scale (EDSS). Neurology. (11):1444–1452 (1983).