Epidemiología e impacto de la Psoriasis
Psoriasis (PsO) en placas
La PsO es una enfermedad crónica no transmisible que compromete la piel y las uñas, y se caracteriza por la aparición de lesiones inflamatorias que llevan al dolor, la desfiguración y la discapacidad, con alto impacto en la calidad de vida de los pacientes afectados. La psoriasis en placas o psoriasis vulgar es la forma más frecuente de psoriasis, esta corresponde al 80-90% de los casos. Tiene elementos comunes fisiopatogénicos con las espondiloartritis y hasta uno de cada tres pacientes con PsO desarrolla una artropatía inflamatoria conocida como artritis psoriásica (APs). Asimismo, porcentajes variables de afectados presentan enfermedad inflamatoria intestinal y uveítis. Se asocia, además, a comorbilidades como cardiopatía isquémica, diabetes, hipertensión arterial, síndrome metabólico, esteatosis hepática, depresión y osteoporosis1-5. La PsO tiene alto impacto en la calidad de vida de los pacientes afectados1.
Prevalencia
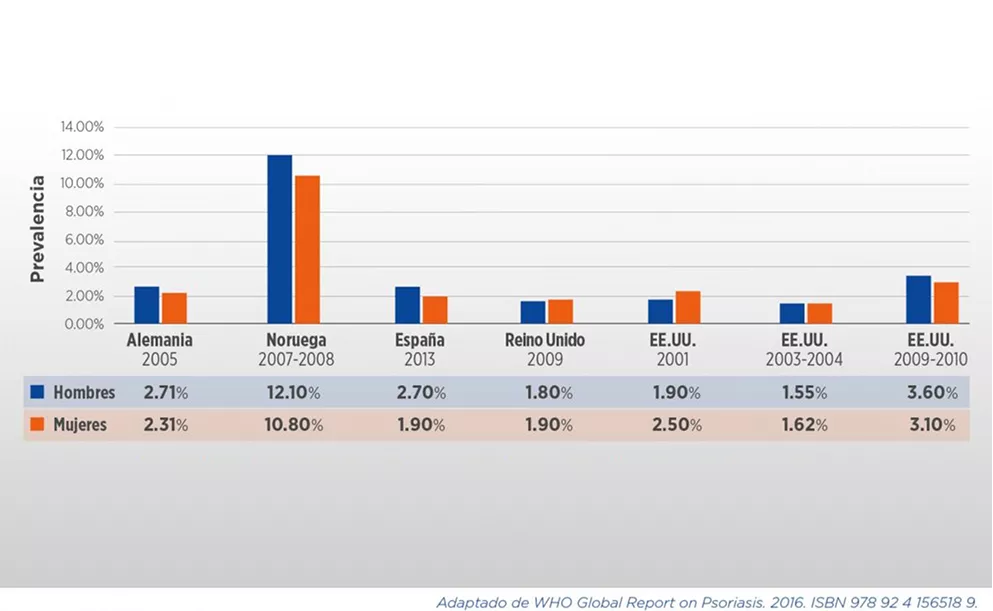
La prevalencia de PsO está estimada en un 2-4% de la población, con variaciones importantes determinadas por la edad, el sexo, la región geográfica, factores ambientales, étnicos y genéticos (ver Cuadros 1 y 2). En determinadas cohortes, se encontró que la prevalencia estaba por debajo de este promedio, en 0.27%, y en ciertas regiones geográficas de Europa la prevalencia puede ser tan alta como 11%. Como regla general, se ha reportado una mayor prevalencia de PsO en latitudes más elevadas y en pacientes caucásicos, comparados con otros grupos étnicos.
La incidencia de la PsO no está bien estudiada a nivel global y la mayoría de los reportes vienen de Europa y Norteamérica. Se ha estimado una incidencia variable: entre 31.4 y 521.1 por cada 100.000 personas/año en distintos países y regiones.
La mayoría de los pacientes se ven afectados antes de los 35 años; la incidencia de PsO se incrementa desde la infancia y a partir de la adultez, y luego disminuye hasta presentar un segundo pico de incidencia en la 5.a-6.a década de vida. La relación hombre: mujer en términos de afección es discrepante entre distintos reportes1,6.
La prevalencia global de PsO es altamente variable y depende de factores étnicos, genéticos y ambientales, entre otros1.
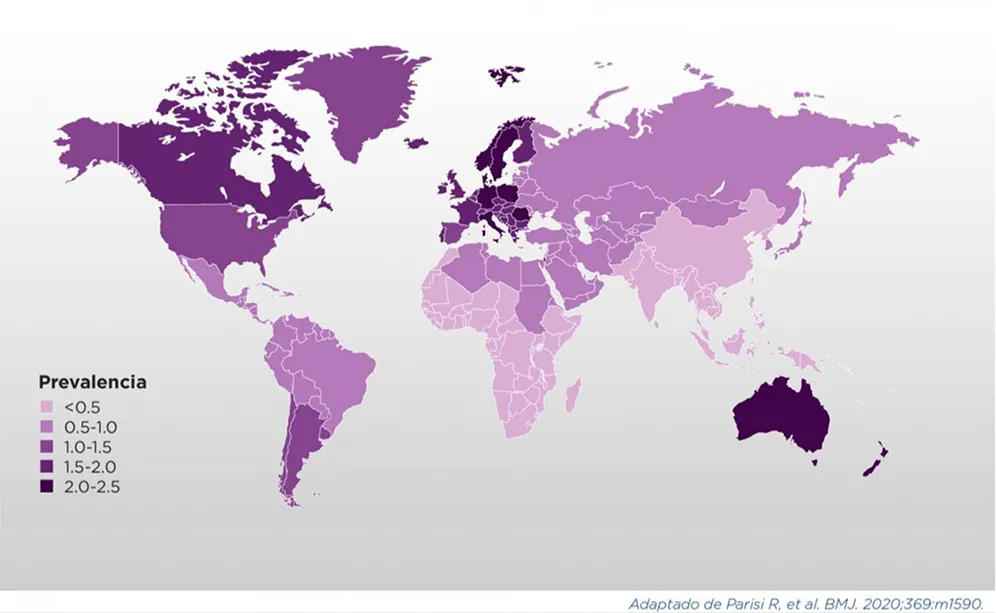
Prevalencia de psoriasis cutánea (diagnosticada por dermatólogo o médico general) a lo largo de la vida según país, en porcentaje de población adulta.
Se incluye el año de encuesta de prevalencia, no el año de publicación
Carga de la enfermedad
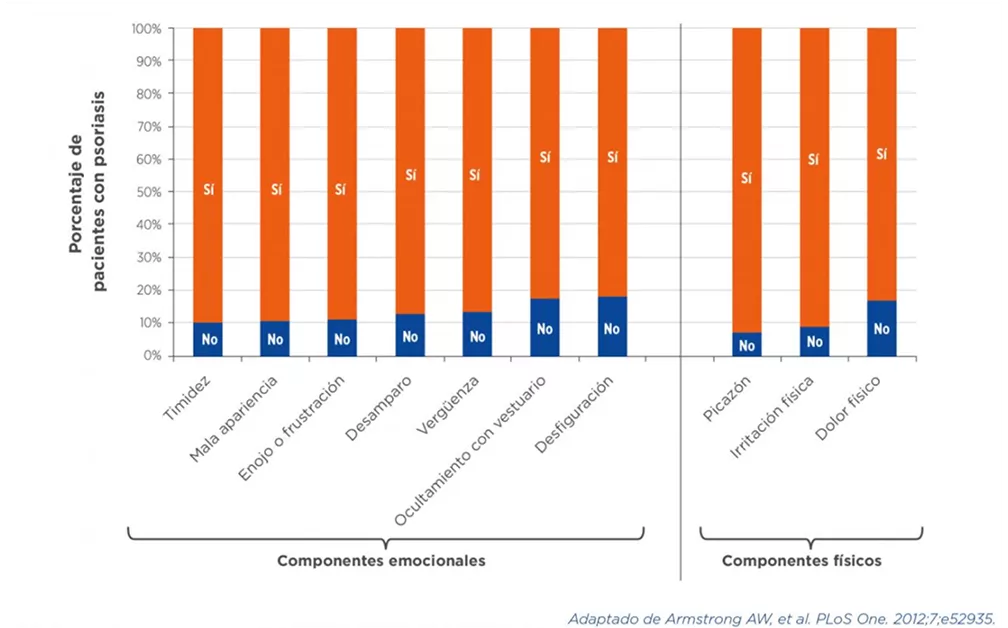
La PsO tiene un impacto negativo en el bienestar de los pacientes, tanto en términos físicos como emocionales, sociales, sexuales, financieros y profesionales, ya que se asocia a discriminación, pérdida de productividad, ausentismo y desempleo. Independientemente de la gravedad de la PsO, casi un 60% de los pacientes consideran que la enfermedad tiene un gran impacto en su calidad de vida.1,7-10
La psoriasis no solo causa síntomas físicos dolorosos y debilitantes, sino que, además, se asocia a múltiples manifestaciones psicológicas, en ocasiones con consecuencias devastadoras. Los pacientes experimentan baja autoestima y una prevalencia aumentada de ansiedad y depresión, y presentan una mayor frecuencia de ideación suicida comparados con otros pacientes.
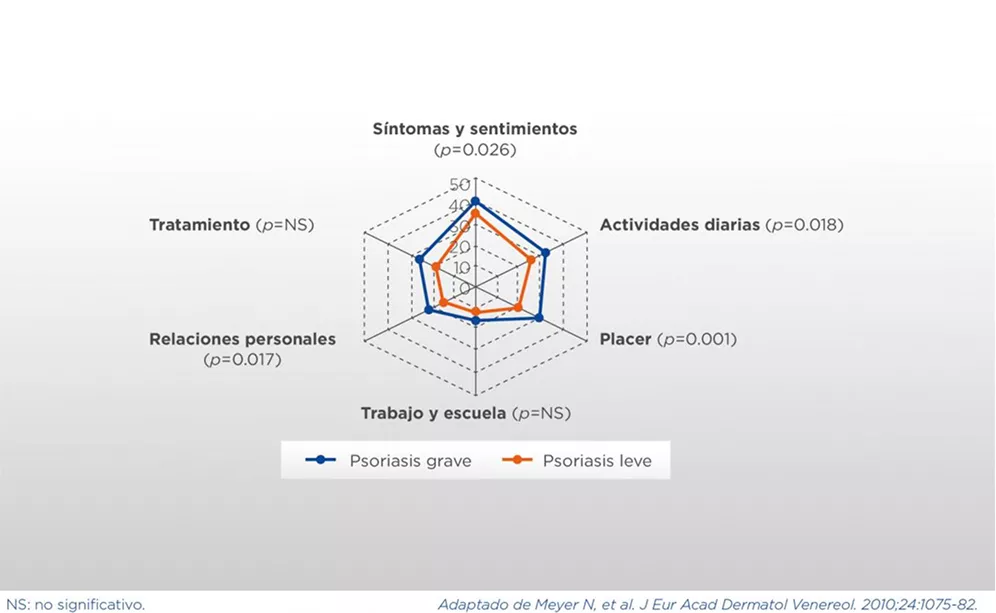
La PsO impacta sobre muchas de las actividades diarias, lo que incluye la necesidad de baños más frecuentes y de tener que asear la casa repetidamente por la descamación, la incapacidad de utilizar determinados tipos de ropa o la necesidad de limpiarla con más frecuencia o, por ejemplo, la incapacidad de participar en ciertas actividades deportivas, todo lo cual impacta de forma negativa en la calidad de vida de los pacientes. Es interesante notar que, en muchos estudios, la correlación entre el impacto en la calidad de vida y la gravedad clínica aparente de la PsO es baja, lo que indica que la magnitud del impacto excede el tema de la gravedad de las lesiones cutáneas.
La carga global de enfermedad medida en DALY (disability-adjusted life years), que es la suma de años vividos con discapacidad y años de vida perdidos a causa de enfermedad, ha alcanzado en 2010 la cifra de 1.050.660 (1 DALY = 1 año de vida saludable perdido), el doble de la carga de la hepatitis C aguda en el mismo año.
La PsO tiene un impacto negativo en la calidad de vida en múltiples dominios, no únicamente físicos, sino también psicológicos, sociales y económicos1,9 (ver Cuadros 3 y 4).
El impacto en la calidad de vida no necesariamente se asocia a la gravedad clínica de las lesiones de PsO1,9.
Fisiopatogenia
La PsO se caracteriza por una inflamación sostenida que conduce a la proliferación descontrolada de queratinocitos y a su diferenciación disfuncional, con lesiones histológicas caracterizadas por la presencia de acantosis, con infiltrados inflamatorios subyacentes compuestos de células dendríticas dérmicas, macrófagos, linfocitos y neutrófilos. Los fenómenos subyacentes implican la activación del sistema inmune innato con elementos autoinflamatorios y la activación del sistema inmune adaptativo, con una respuesta autoinmune mediada por linfocitos T10,11.
Se propone que la activación de células dendríticas ocurre mediante el reconocimiento de péptidos antimicrobianos secretados por los queratinocitos en respuesta al daño y que se encuentran sobreexpresados en la piel psoriásica (como el péptido LL37, las ẞ-defensinas y la proteína S100). LL37 forma complejos con material genético propio de células dañadas, y el complejo LL37-ADN estimula la vía del receptor tipo toll (TLR) 9 en las células dendríticas plasmocitoides. Esto lleva a la secreción de interferones de tipo I, que promueven la maduración de células dendríticas mieloides, las cuales secretan TNF-α, IL-23 e IL-12, y estas sustancias promueven la diferenciación de los linfocitos T en Th1 y Th17. Adicionalmente, el complejo LL37-ARN estimula a las células dendríticas plasmocitoides mediante TLR7 y TLR8. La activación del sistema inmune innato mantiene la inflamación psoriásica e induce la proliferación de queratinocitos mediante la secreción de TNF-α, IL-17, IL-21 e IL-2211.
El eje TNF-α/IL-23/IL-17 caracteriza la psoriasis en placas, y la IL-17 parece ser un mediador clave (ver cuadro 5). La unión de IL-17A con su receptor estimula la señalización vía múltiples quinasas, como ERK, p38, TAK1 e IKK, las cuales activan vías como NFkB y JAK-STAT, que actúan como efectores inflamatorios12-16.
Se han identificado más de 60 loci asociados a la predisposición genética a la psoriasis. PSORS1 es el más prominente: representa el 50% de la heredabilidad de la enfermedad y corresponde al alelo del complejo mayor de histocompatibilidad tipo I HLA-Cw6. Múltiples polimorfismos en diversos genes han mostrado su asociación con la psoriasis, con el involucramiento de elementos del sistema inmune innato y adaptativo17,18.
TNF-α /IL-23/IL-17
El eje TNF-α /IL-23/IL-17 juega un rol importante en la fisiopatogenia de la PsO.
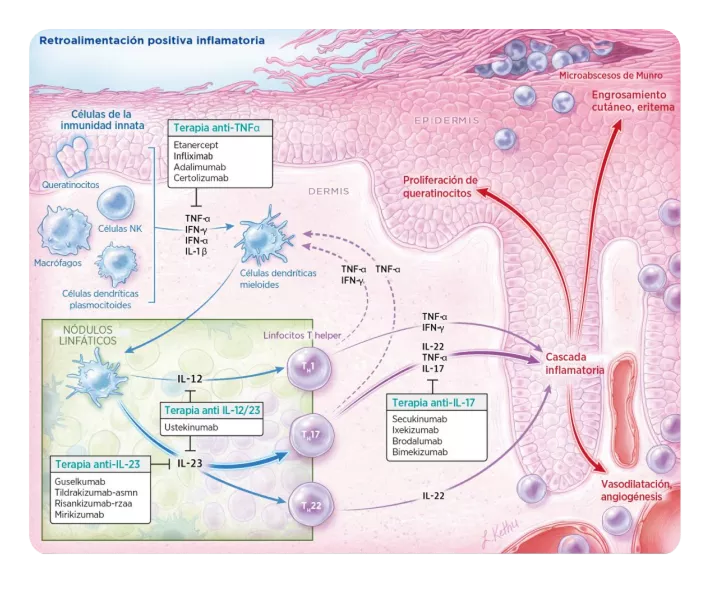
La fisiopatogenia de la psoriasis involucra un ciclo de activación recurrente del sistema inmune adaptativo, en el que las células dendríticas mieloides activadas secretan IL-12 e IL-23. La IL-12 induce la diferenciación de Th1 y estos linfocitos producen TNF-α la IL-23 induce la diferenciación de Th17 y Th22, que a su vez producen IL-17 e IL-22. Estas moléculas activan a los queratinocitos, lo que genera un ciclo de retroalimentación positiva de inflamación.
Características clínicas
La psoriasis en placas es la forma más frecuente de psoriasis y se caracteriza por la aparición de lesiones cutáneas eritematosas escamadas, claramente demarcadas de la piel sana. Si bien estas pueden aparecer en cualquier área del cuerpo, las áreas más frecuentemente afectadas son el tronco, las superficies extensoras como los codos y las rodillas, el cuero cabelludo y los pliegues glúteos. Las lesiones pueden ir desde pequeñas pápulas escamosas eritematosas a gruesas placas confluentes y pueden aparecer en áreas de trauma por rascado o presión, lo que se conoce como fenómeno de Koebner. Los pacientes pueden experimentar prurito importante como manifestación de su psoriasis y el rascado puede promover la aparición de nuevas lesiones, perpetuando el ciclo. Las lesiones de rostro, palmas, plantas o genitales determinan un mayor impacto en la calidad de vida de los pacientes afectados19. Cuando la psoriasis aparece en zonas de pliegues, se la denomina psoriasis invertida; esta puede carecer de las manifestaciones clásicas y ser confundida con micosis u otras entidades, lo que retrasa el diagnóstico específico y el correcto manejo de los pacientes19.
El compromiso de las uñas es frecuente en pacientes con PsO y alcanza hasta el 80% de los casos. Todas las estructuras de la uña pueden verse afectadas y pueden producir distintas manifestaciones como “pitting”, leuconiquia, máculas rojas en la lúnula (por daño de la matriz ungueal), manchas de aceite, hiperqueratosis y hemorragias en astilla, que culminan en onicólisis, al afectar el lecho ungueal20.
Hasta uno de cada tres pacientes con PsO presentarán artritis psoriásica durante su evolución. Asimismo, los pacientes con PsO tienen mayor frecuencia de uveítis y de enfermedad inflamatoria intestinal respecto de la población general, dado que comparten el espectro de las espondiloartritis. Estas patologías deben ser investigadas y detectadas, ya que pueden condicionar decisiones terapéuticas21-23.
La PsO produce lesiones cutáneas características y puede afectar cualquier parte del cuerpo, incluyendo zonas de alto impacto en la calidad de vida como el rostro y los genitales19. Como se señaló, el compromiso ungueal es frecuente y afecta la estructura y funcionalidad de las uñas20.
Diagnóstico
Dado que hasta la fecha no se han descripto biomarcadores específicos, el diagnóstico de psoriasis se basa en opinión de experto y depende, en la mayoría de los casos, del reconocimiento de lesiones típicas en el examen físico. Cuando la presentación no es completamente clásica, como puede ocurrir con la psoriasis invertida o el compromiso genital aislado, la búsqueda de lesiones en “sitios ocultos” puede ayudar al diagnóstico, por ejemplo, la localización periumbilical, retroauricular, en el cuero cabelludo o en el pliegue Interglúteo. De la misma manera, la presencia de lesiones ungueales típicas o elementos claros de artritis psoriásica puede contribuir al diagnóstico. La reproducción de lesiones en sitios de trauma (fenómeno de Koebner) apoya el diagnóstico de psoriasis. En casos atípicos o cuando persisten las dudas, puede ser necesaria la realización de una biopsia para certificar el diagnóstico.
Ya que no existen biomarcadores específicos, el diagnóstico de PsO se basa en elementos clínicos, de acuerdo a la opinión de expertos11. En algunas ocasiones, puede ser necesaria la realización de una biopsia cutanea11.
Clinimetría
Ya que no existen biomarcadores que permitan evaluar la gravedad de la enfermedad, se han desarrollado distintas herramientas de valoración clinimétrica para definir los estadios de enfermedad y la efectividad de los tratamientos.
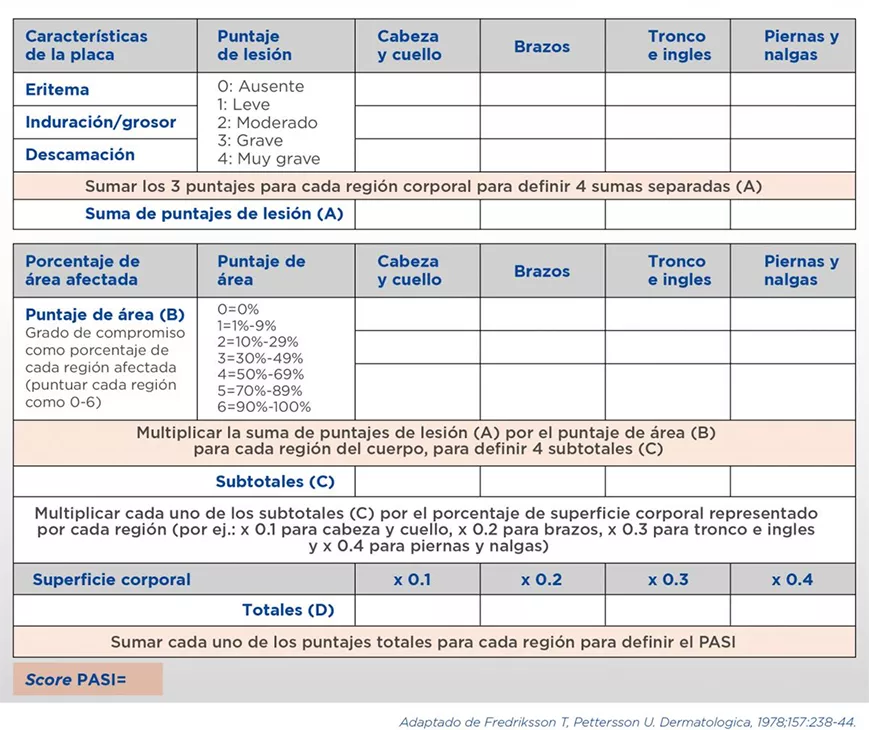
El PASI (Psoriasis Area Severity Index) es un score desarrollado empíricamente por Fredriksson y Pettersson en 1978 para evaluar la efectividad de la acitretina en un ensayo clínico. Este score combina la superficie afectada con la gravedad de las lesiones (eritema, grosor, descamación) para construir un puntaje continuo de 0 a 72 (ver Cuadro 6). La disminución porcentual del PASI permite definir las respuestas como PASI50, PASI75, PASI90 y PASI100, de acuerdo con el grado de disminución registrado (50%, 75%, 90% o 100% respecto del valor basal). Para calcular el valor de PASI, se consideran 4 regiones corporales (cabeza y cuello, tronco e ingles, brazos, piernas y nalgas) y para cada región se puntúa el eritema, el grosor y la descamación de las lesiones con valores que van desde 0 (ausente) hasta 4 (muy grave); además se tiene en cuenta el área afectada y se realiza un cálculo matemático. La aplicación del PASI requiere entrenamiento específico y, eventualmente, el uso de calculadores especiales24,25.
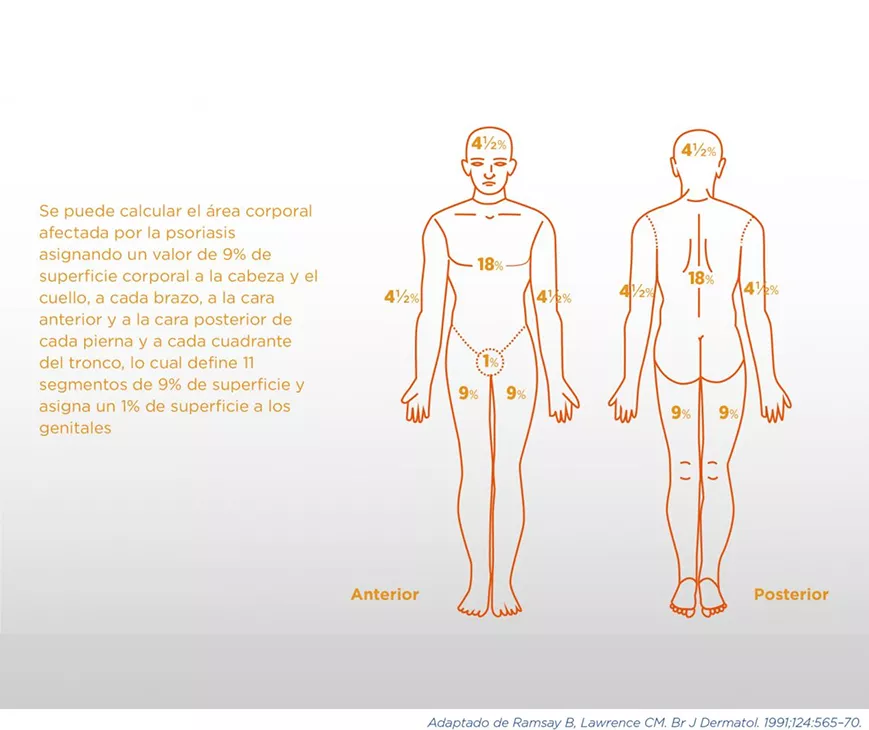
El BSA (Body Surface Area) estima el área de superficie corporal afectada por las lesiones. Esto puede hacerse por diferentes métodos, como la “regla de la palma” (la superficie correspondiente a la palma de la mano del paciente representa el 1% de su superficie corporal) o la “regla de los nueves”, asignando un valor de 9% de superficie corporal a la cabeza y el cuello, a cada brazo, a la cara anterior y a la cara posterior de cada pierna y a cada cuadrante del tronco, lo cual define 11 segmentos de 9% de superficie, y asigna un 1% de superficie a los genitales (ver Cuadro 7). Si bien el BSA tiene una alta variabilidad interobservador, tiene muy buena correlación intraobservador26.
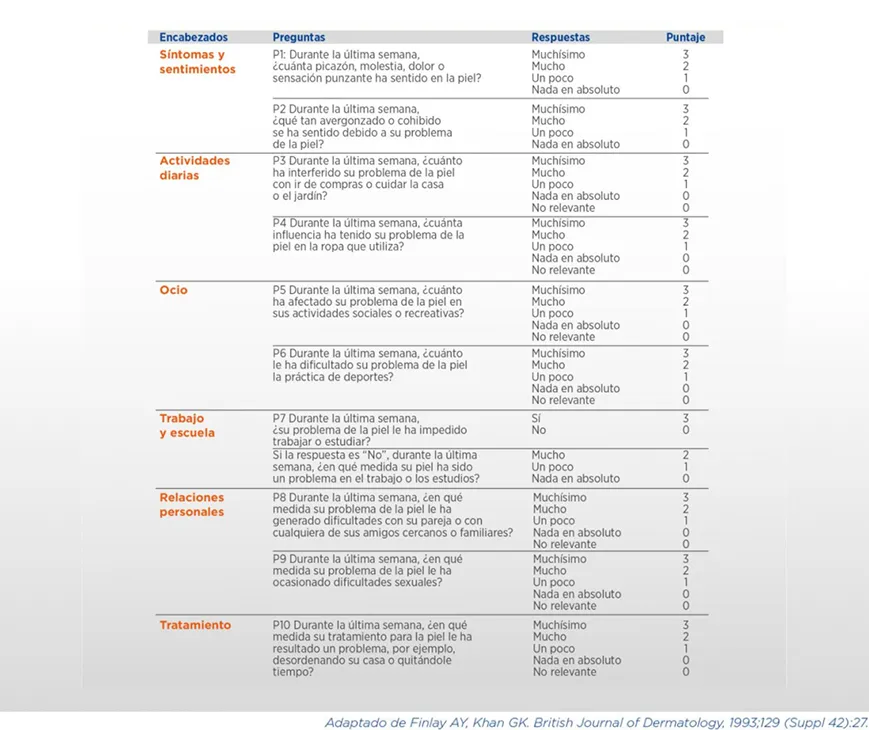
El DLQI (Dermatology Life Quality Index) es un cuestionario de 10 ítems que aborda múltiples aspectos de la calidad de vida relacionada con la salud de los pacientes con patologías dermatológicas, incluyendo síntomas y sentimientos, actividades diarias, ocio, trabajo o educación, relaciones personales y tratamientos (ver Cuadro 8). Cada pregunta se puntúa de 0 a 3 en una escala ordinal, reflejando en qué medida estos aspectos afectan la calidad de vida del paciente: 0 (nada), 1 (poco), 2 (mucho), 3 (muchísimo). El score total va de 0 a 30, donde puntajes más altos representan mayor impacto en la calidad de vida relacionada con la salud27.
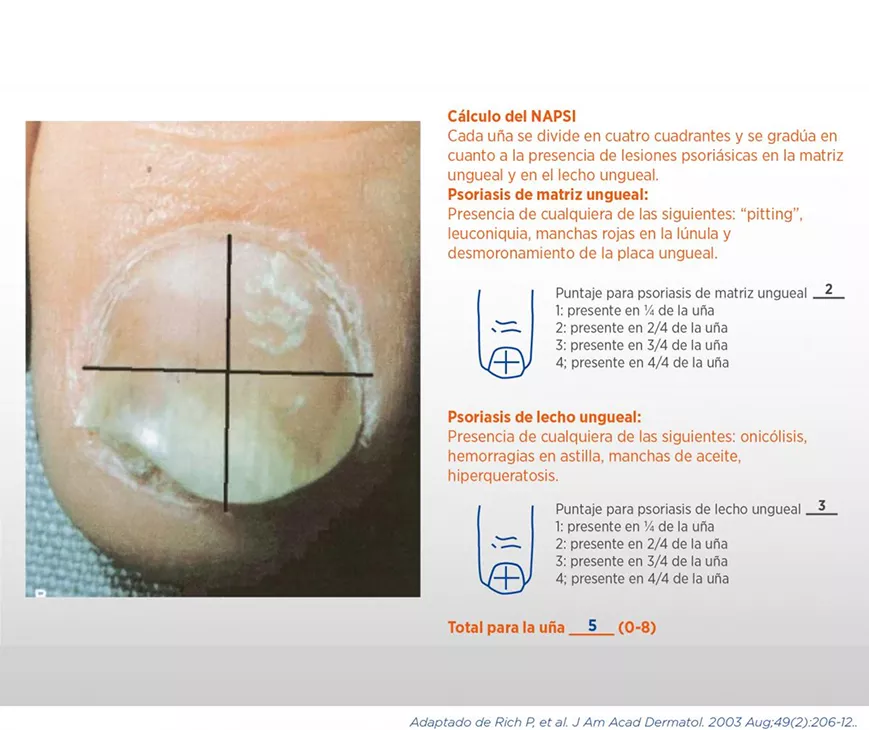
El NAPSI es un score que cuantifica el compromiso psoriásico ungueal. Cada uña se divide en cuatro cuadrantes y suma 1 punto en cada cuadrante si presenta psoriasis del lecho ungueal (onicólisis, hemorragias en astilla, hiperqueratosis, manchas de aceite) y 1 punto en cada cuadrante si presenta psoriasis de la matriz ungueal (“pitting”, leuconiquia, desmoronamiento o lesiones en la lúnula), por lo que cada uña suma de 0 a 8 puntos y el score total va de 0 a 80, si considera solo las manos, o de 0 a 160 si también considera los pies (ver cuadro 9). Es una herramienta relativamente fácil de aplicar y es sensible al cambio28.
Cálculo del PASI (Psoriasis Area Severity Index)
Cálculo del BSA (Body Surface Area) con la "regla de los nueve"
Cálculo del DLQI (Dermatology Life Quality Index)
Cálculo del NAPSI
Tratamientos
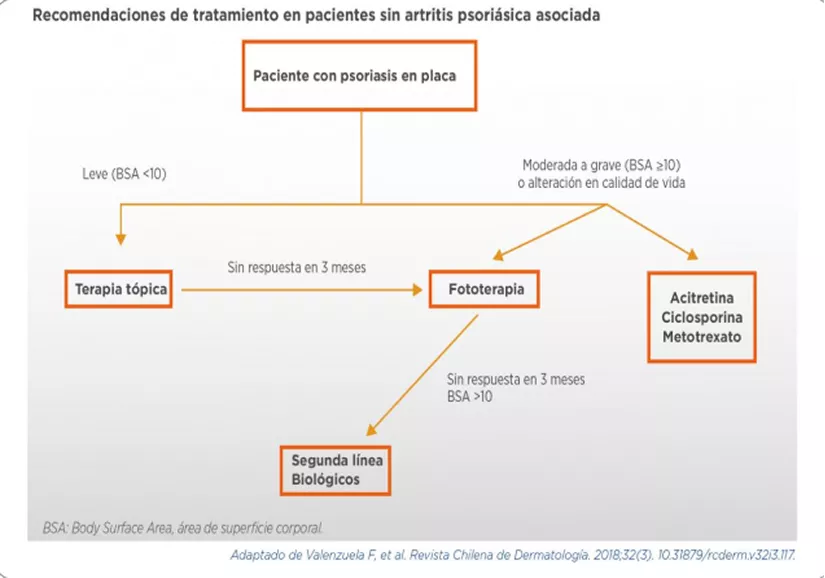
La elección del tratamiento de la psoriasis depende de la extensión y gravedad de las lesiones, de los sitios anatómicos específicos de afectación, de las comorbilidades del paciente y de la presencia de entidades asociadas, como artritis psoriásica, uveítis o enfermedad inflamatoria intestinal29.
Para el manejo de la psoriasis leve, definida generalmente como aquella que afecta <3-5% de la superficie corporal, las opciones de tratamiento, por lo común, son tópicas o locales e incluyen los esteroides tópicos, que ejercen efectos antiinflamatorios, antiproliferativos y vasoconstrictores. Es posible elegir la potencia y el vehículo de estos agentes para maximizar la efectividad, mejorar el cumplimiento de la aplicación y disminuir los eventos adversos. Otras opciones tópicas son los análogos tópicos de vitamina D, que inducen el bloqueo de la proliferación de los queratinocitos y potencian su diferenciación; los inhibidores tópicos de calcineurina, como el tacrolimus, que inhiben la activación de linfocitos T y suelen utilizarse para áreas donde el corticoide puede ser menos deseable, como el rostro o las áreas de intertrigo; los agentes queratolíticos tópicos, como retinoides locales o ácido salicílico; y la fototerapia localizada, basada en la aplicación de terapia lumínica con rayos UV-B, que producen resolución de las lesiones psoriásicas con mínimo riesgo carcinogénico29-31.
La psoriasis moderada es aquella que afecta >3-5% de la superficie corporal y la psoriasis grave la que afecta >10% de la superficie. En estos casos, al igual que en aquellas formas que afectan zonas especiales, como el cuero cabelludo, las palmas y las plantas o los genitales, suele optarse por tratamiento sistémico, sumado al tratamiento tópico o sustituyéndolo. La fototerapia utiliza múltiples esquemas de banda, como UV-B o UV-A, con fotosensibilizantes (como los psoralenos), aunque su utilización ha ido decayendo por la disponibilidad de nuevos agentes, ya que los pacientes suelen requerir desplazarse al centro de salud varias veces por semana durante meses para realizar la fototerapia. Los agentes orales incluyen el metotrexato, que es un inmunomodulador convencional que inhibe la dihidrofolato reductasa, entre otros mecanismos, y alcanza una respuesta PASI75 en alrededor de un tercio de los pacientes; además es efectivo para el componente articular de la artritis psoriásica.
La facilidad de administración una vez por semana es una ventaja, pero sus limitaciones son la hepatotoxicidad, la teratogenicidad y la posible toxicidad medular. La ciclosporina, un inhibidor de calcineurina, logra una respuesta cutánea elevada en gran parte de los pacientes, pero con un margen terapéutico estrecho por su posibilidad de toxicidad renal, neurológica y metabólica. También se emplean retinoides como la acitretina, que actúan a través de receptores específicos y consiguen respuestas PASI75 en casi la mitad de los pacientes, con un perfil de seguridad aceptable consistente en toxicidad hepática, metabólica, fotosensibilización y teratogenicidad. El apremilast, un inhibidor de la fosfodiesterasa 4, con efectividad similar a metotrexato en lo cutáneo y efectos discretos en articulaciones, entesitis y dactilitis, presenta un perfil de seguridad bueno, caracterizado únicamente por diarrea y sin requerimiento de controles periódicos de laboratorio32-36.
Los tratamientos han representado un avance significativo en el manejo de la psoriasis; han permitido altas tasas de respuesta cutánea y, en muchos casos, el manejo simultáneo de entidades asociadas, como la artritis psoriásica. Otras terapias sistémicas para el tratamiento de la psoriasis incluyen las terapias biológicas, agrupadas en cuatro tipos principales: inhibidores del TNF-α, inhibidores de IL-12/23 (p40), inhibidores de la IL-17 e inhibidores de la IL-23 (p19)37.
Los inhibidores del TNF-α son el grupo más antiguo de biológicos aprobados para el manejo de la psoriasis y son efectivos también para tratar la artritis psoriásica, la uveítis y la enfermedad inflamatoria intestinal. Si bien de forma global son seguros, presentan algunas contraindicaciones específicas, como pacientes con tuberculosis activa, con historia de trastornos desmielinizantes o insuficiencia cardíaca grave. Los pacientes con tuberculosis latente podrían recibir estos agentes en la medida que reciban tratamiento para dicha condición38-41.
El único inhibidor de IL-12/23 disponible es ustekinumab; este fármaco inhibe la subunidad p40 común a ambas citoquinas y se aplica de forma trimestral. Se cree que el efecto terapéutico obedece, principalmente, a la inhibición de la IL-23. Es un fármaco efectivo en cuanto a las respuestas cutáneas y también tiene efectividad en el control de la artritis psoriásica y algunas formas de enfermedad inflamatoria intestinal. Tiene un buen perfil de seguridad y en los ensayos clínicos, los únicos eventos adversos que aparecieron con mayor frecuencia que en el placebo fueron infección respiratoria superior y cefalea42.
Los inhibidores de la IL-17 pueden estar dirigidos directamente contra la citoquina (p. ej., secukinumab e ixekizumab, que inhiben la IL-17A, o bimekizumab, que inhibe la IL-17A y la IL-17F) o contra su receptor (p. ej., brodalumab, que inhibe el IL-17R). Por lo general, tienen un rápido inicio de acción y una respuesta cutánea robusta. Además, algunos están aprobados para su uso en pacientes con artritis psoriásica. En términos de seguridad, no han mostrado aumento de infecciones serias ni de neoplasias, pero se asocian a candidiasis mucocutánea en una baja proporción de pacientes (estas generalmente no son graves ni requieren la suspensión del tratamiento) y a la exacerbación o el debut de la enfermedad inflamatoria intestinal, con un índice de incidencia ajustado a exposición de 0.01 eventos cada 100 pacientes/año para el caso de secukinumab en estudios de seguridad extendidos a 5 años en pacientes con psoriasis43-47.
Los inhibidores de la IL-23 son el grupo más reciente de biológicos para el manejo de la PsO; estos inhiben la sububidad p19 de esta citoquina. Incluyen guselkumab, risankizumab y tildrakizumab, todos ellos han sido aprobados por la FDA y la EMA para su uso en psoriasis cutánea; desde 2019 y 2020, risankizumab y guselkumab están aprobados para su uso en artritis psoriásica48-49 por las autoridades regulatorias de Japón y la FDA, respectivamente. Como grupo, presentan una excelente respuesta cutánea y, en términos de seguridad, no han mostrado aumento de neoplasias ni infecciones serias. Únicamente se ha señalado su asociación con infecciones respiratorias superiores y reacciones locales en el sitio de inyección50-54.
El tratamiento de la PsO puede ser variable y depende de la gravedad, extensión y localización de las lesiones, de la presencia de entidades asociadas (APs, uveítis, EII) y de las comorbilidades del paciente11. En los Cuadros 10 y 11 se indican algunos algoritmos para la elección de tratamientos contra la psoriasis.
Los tratamientos biológicos permiten altas tasas de respuestas cutáneas PASI90 y PASI10011.
Abordaje terapéutico de la psoriasis en placas (Guías chilenas, 2018)
Presentaciones clínicas
La psoriasis se manifiesta en diversas formas, que incluyen psoriasis en placas, flexural, guttata, pustular o eritrodérmica.
La forma más común es la psoriasis en placas, que se presenta con placas bien delimitadas, de color rosa salmón y con descamación plateada blanquecina, de distribución típicamente simétrica y que aparecen en superficies extensoras, sobre todo en codos y rodillas, en el tronco y el cuero cabelludo. Puede presentarse el signo de Auspitz, que consiste en puntos hemorrágicos que aparecen tras el desprendimiento de las placas.55
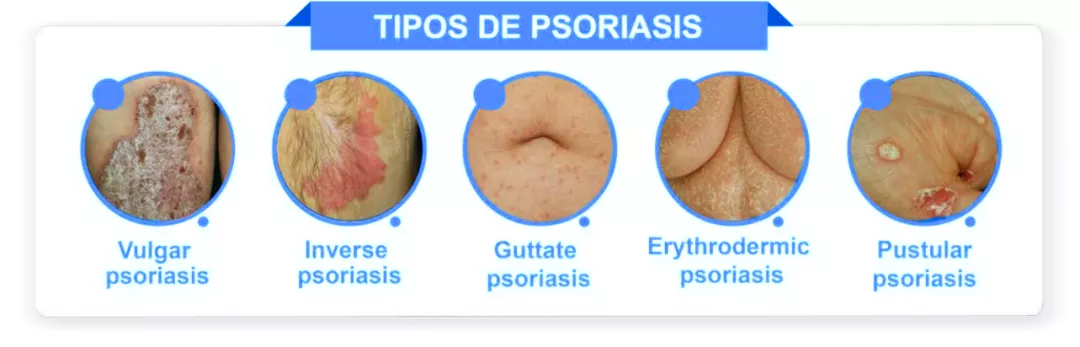
La psoriasis flexural se presenta sin muchas escamas y puede afectar la piel de las axilas, así como las zonas submamaria y genital. Por su parte, la psoriasis guttata causa una erupción aguda y simétrica de pequeñas pápulas o placas, que afectan principalmente al tronco y extremidades, y que suelen ser precedidas por infección estreptocócica. Esta variante puede anteceder la aparición de psoriasis en placas. En los casos raros de enfermedad severa y descontrolada, la psoriasis puede causar una erupción eritematosa diseminada (eritrodermia), que puede poner en riesgo la vida debido a complicaciones potenciales como hipotermia, el riesgo de infecciones, lesión renal aguda e insuficiencia cardíaca.55 El fenómeno de Koebner describe la aparición de la psoriasis en áreas de piel afectadas por traumatismos. Hasta 50% de los pacientes pueden desarrollar psoriasis ungueal, que puede manifestarse como indentación de las uñas, onicolisis, decoloración del lecho ungueal, distrofia e hiperqueratosis subungueal.55
Comorbilidades
Las enfermedades comórbidas de la psoriasis incluyen artritis psoriásica, enfermedad de Crohn, cáncer, depresión, enfermedad del hígado graso no alcohólico, síndrome metabólico (o componentes del mismo) y trastornos cardiovasculares, que contribuyen sustancialmente al grado de afectación y la mortalidad en los pacientes.
Referencias
1. WHO Global Report on Psoriasis.
2. Lancet. 2015;386:983-94. doi: 10.1016/S0140-6736(14)61909-7
3. Bedi TR. Indian J Dermatol Venereol Leprol. 1995;61:202-5. PMID: 20952954
4. Reich K, et al. Br J Dermatol. 2009;160(5):1040-7. doi: 10.1111/j.1365-2133.2008.09023.x.
5. Vena GA, et al. Eur J Dermatol. 2010;20:593-8. doi: 10.1684/ejd.2010.1017.
6. Parisi R, et al. BMJ. 2020;369:m1590. doi: 10.1136/bmj.m1590
7. Meyer N, et al. J Eur Acad Dermatol Venereol. 2010;24:1075-82. doi: 10.1111/j.1468-3083.2010.03600.x.
8. Stern RS, et al. The journal of investigative dermatology Symposium proceedings/the Society for Investigative Dermatology, Inc [and] European Society for Dermatological Research. 2004;9:136-139. doi: 10.1046/j.1087-0024.2003.09102.x.
9. Armstrong AW, et al. PLoS One. 2012;7;e52935. doi: 10.1371/journal.pone.0052935.
10. Norlin JM, et al. Br J Dermatol. 2012;166:797-802. doi: 10.1111/j.1365-2133.2011.10778.
11. Armstrong AW, et al. JAMA. 2020;323:1945-1960. doi: 10.1001/jama.2020.4006.
12. Rendon A, et al. Int. J. Mol. Sci. 2019;20:1475; doi:10.3390/ijms20061475.
13. Di Meglio, P, et al. Psoriasis. Cold Spring Harb Perspect Med. 2014;4:6. doi:10.1101/cshperspect.a015354.
14. Harden JL, et al. J Autoimmun. 2015;64:66-73. doi: 10.1016/j.jaut.2015.07.008
15. Liang Y, et al. Curr Opin Immunol. 2017;49:1-8. doi: 10.1016/j.coi.2017.07.007
16. Hansel A, et al. J Allergy Clin. Immunol. 2011;127:787-794. doi: 10.1016/j.jaci.2010.12.009
17. Bowcock AM, et al. Nat Rev Immunol. 2005;5:699-711. doi: 10.1038/nri1689.
18. Trembath RC, et al. Hum Mol Genet. 1997;6:813-820. doi: 10.1093/hmg/6.5.813.
19. Manhart R, et al. Clin Exp Rheumatol. 2015;33(5 Suppl 93):S7-13 PMID: 26472140
20. Jiaravuthisan MM, et al. J Am Acad Dermatol. 2007;57:1-27. doi: 10.1016/j.jaad.2005.07.073.
21. Ogdie A, Weiss P. Rheum Dis Clin North Am 2015;41:545-68. doi: 10.1016/j.rdc.2015.07.001.
22. Cottone M, et al. Dig Dis. 2019;37:451-457. doi: 10.1159/000500116.
23. Chayada C, et al. Biomed Res Int. 2020;2020:9308341. doi: 10.1155/2020/9308341.
24. Mease PJ, et al. Arthritis Care Res (Hoboken). 2011 Nov;63 Suppl 11:S64-85. doi: 10.1002/acr.20577
25. Naldi L, et al. Clin Dermatol. 2010;28(1):67-72. doi: 10.1016/j.clindermatol.2009.03.001.
26. Spuls PI, et al. J Invest Dermatol. 2010 Apr;130(4):933-43. doi: 10.1038/jid.2009.391.
27. DLQI Finlay AY, Khan GK. British Journal of Dermatology, 1993;129 (Suppl 42):27. DOI: 10.25251/SKIN.1.SUPP.7
28. NAPSI Rich P, et al. J Am Acad Dermatol. 2003 Aug;49(2):206-12. doi: 10.1067/s0190-9622(03)00910-1
30. Soleymani T, et al. Int J Dermatol. 2015;54:383-392. doi: 10.1111/ijd.12790.
31. Weinstein GD, et al. J Am Acad Dermatol. 1997;37:85-92. doi: 10.1016/s0190-9622(97)70216-0.
32. Warren RB, et al. Lancet. 2017; 389:528-537. doi: 10.1016/S0140-6736(16)32127-4.
33. Dogra S, et al. J Eur Acad Dermatol Venereol. 2013;27(3):e305-e311. doi: 10.1111/j.1468-3083.2012.04644.x.
34. Ellis CN, et al. N Engl J Med. 1991;324(5):277-284. doi: 10.1056/NEJM199101313240501.
35. Gooderham M, et al. BioDrugs. 2015; 29(5): 327–339. doi: 10.1007/s40259-015-0144-3
36. Papp K, et al. J Am Acad Dermatol. 2015;73:37-49. doi: 10.1016/j.jaad.2015.03.049
37. Armstrong AW, et al. JAMA Dermatol. 2020. doi:10.1001/jamadermatol.2019.4029.
38. Papp KA, et al. Br J Dermatol. 2005;152:1304-1312. doi: 10.1111/j.1365-2133.2005.06688.x.
39. Menter A, et al. J Am Acad Dermatol. 2008;58:106-115. doi: 10.1016/j.jaad.2007.09.010.
40. Gottlieb AB, et al. J Am Acad Dermatol. 2018;79:302-314. doi: 10.1016/j.jaad.2018.04.012.
41. Reich K, et al. Lancet. 2005;366(9494):1367-1374. doi: 10.1016/S0140-6736(05)67566-6.
42. Papp KA, et al. Lancet. 2008;371(9625):1675-1684. doi: 10.1016/S0140-6736(08)60726-6
43. Langley RG, et al. N Engl J Med. 2014;371:326-338. doi: 10.1056/NEJMoa1314258
44. Reich K, et al. Br J Dermatol. 2019;181:954-966. doi: 10.1111/bjd.17351.
45. Paul C, et al. J Am Acad Dermatol. 2019;80:70-79. doi: 10.1016/j.jaad.2018.06.039.
46. Lebwohl M, et al. N Engl J Med. 2015;373:1318-1328. doi: 10.1056/NEJMoa1503824.
47. Deohdar A, et al. Arthritis Res Ther. 2019;21:111. doi: 10.1186/s13075-019-1882-2.
48. TREMFYA® (guselkumab) Approved by U.S. Food and Drug Administration as the First Selective Interleukin (IL)-23 Inhibitor for Active Psoriatic Arthritis . Disponible en https://www.janssen.com/us/sites/www_janssen_com_usa/files/tremfya_psa_fda_approval_press_release_071420_final.pdf. Accedido por última vez 31/05/2021.
49. AbbVie Announces First Regulatory Approval of SKYRIZI™ (risankizumab) for the Treatment of Plaque Psoriasis, Generalized Pustular Psoriasis and Erythrodermic Psoriasis and Psoriatic Arthritis in Japan. Disponible en https://news.abbvie.com/news/press-releases/abbvie-announces-first-regulatory-approval-skyrizi-risankizumab-for-treatment-plaque-psoriasis-generalized-pustular-psoriasis-and-erythrodermic-psoriasis-and-psoriatic-arthritis-in-japan.html Accedido por última vez 31/05/2021.
50. Blauvelt A, et al. J Am Acad Dermatol. 2017;76:405-417. doi: 10.1016/j.jaad.2016.11.041.
51. Reich K, et al. Lancet. 2019;394(10201):831-839. doi: 10.1016/S0140-6736(19)31773-8.
52. Gordon KB, et al. Lancet. 2018;392(10148):650-661. doi: 10.1016/S0140-6736(18)31713-6.
53. Reich K, et al. Lancet. 2017;390(10091):276-288. doi: 10.1016/S0140-6736(17)31279-5
54. Valenzuela F, et al. Revista Chilena de Dermatología. 2018;32(3). doi:10.31879/rcderm.v32i3.117.
55. Raharja A, Mahil SK, Barker JN. Psoriasis: a brief overview. Clin Med (Lond). 2021 May;21(3):170-173. Boehncke WH, Schöne MP. Psoriasis. Lancet 2015; 386: 983-94.

