Риск пирексии при лечении дабрафенибом и траметинибом снижается с возрастом
Пирексия — наиболее распространенное нежелательное явление (НЯ) у пациентов с меланомой кожи, получающих таргетную терапию (ТТ) комбинацией дабрафениба и траметиниба. Общая частота развития пирексии в рандомизированных клинических исследованиях (РКИ) составляет 55—68%1—4. В условиях реальной клинической практики (РКП) этот показатель ниже и колеблется в пределах 19—41%5—8.
К сожалению, попытки описать патогенез развития пирексии на фоне приема дабрафениба и траметиба и выявить факторы, связанные с повышенным риском развития пирексии, пока не увенчались успехом9—13.
Особый интерес представляет вопрос, связан ли риск пирексии с возрастом пациента. Пожилым пациентам часто назначают более низкие дозы лекарственных препаратов, в том числе из-за потенциально повышенного риска развития НЯ. Однако редукция доз может повлиять на эффективность лечения5. Оправданы ли такие опасения в отношении пирексии и требуется ли снижение дозы препаратов для пожилых пациентов?
Исследование ELDERLYMEL
В испанском исследовании ELDERLYMEL была оценена связь между частотой возникновения пирексии и возрастом пациентов5. Авторы проанализировали данные 159 пациентов с метастатической или неоперабельной меланомой с мутацией BRAF V600, получивших хотя бы одну дозу дабрафениба в режиме монотерапии или в сочетании с траметинибом. Результаты представлены в табл. 1.
Частота развития пирексии и ее осложнений
Частота развития пирексии в общей когорте пациентов составила 37,1%, частота развития пирексии ≥3 степени тяжести — 3,8%, частота прекращения лечения по причине развившейся пирексии — 3,1%5.
Таблица 1. Частота возникновения пирексии в исследовании ELDERLYMEL5
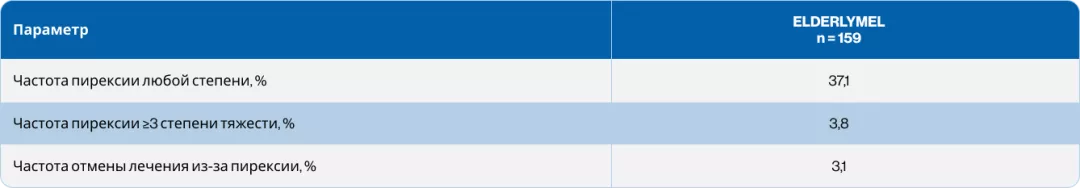
Среднее время до начала развития пирексии составило 19 дней5. В более ранних исследованиях этот показатель составлял 27 дней9.
Влияние возраста на частоту развития пирексии
Анализ показал, что частота развития пирексии снижалась с увеличением возраста пациентов (рис. 1). У пациентов в возрасте ≥ 75 лет (n = 29) частота пирексии составляла 13,8% против 42,3% у пациентов в возрасте < 75 лет (n = 130). Увеличение возраста на 1 год снижало риск развития пирексии в 1,03 раза (95% ДИ: 1,0—1,1; р = 0,011)5.
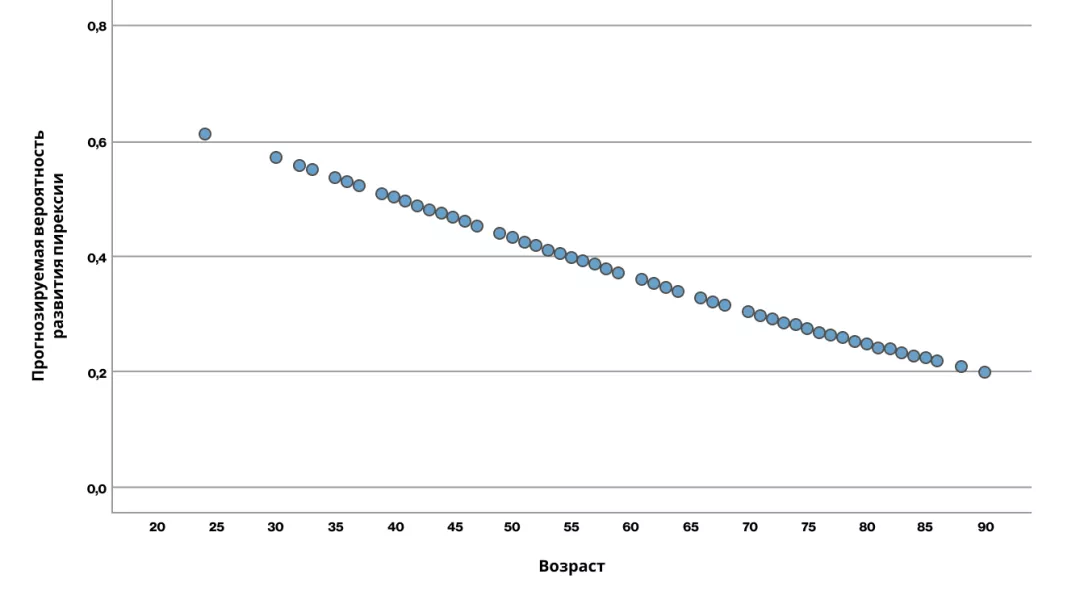
Рисунок 1. Прогнозируемая вероятность развития пирексии с учетом возраста пациента (в виде непрерывной переменной)5
В поисках оптимальной возрастной границы
В протоколе исследования авторы предварительно установили границу пожилого возраста на уровне 75 лет. Однако при проведении анализа был установлен возраст, который является наилучшей точкой отсечения с оптимальным соотношением чувствительности и специфичности для прогнозирования риска развития пирексии: 61,5 года. Анализ показал, что по отношению к этой границе у более пожилых пациентов вероятность развития пирексии была в 2,53 раза ниже, чем у более молодых пациентов (95% ДИ: 1,3—4,9; р = 0,006)5.
Факторы, влияющие на частоту развития пирексии
Действительно ли именно возраст был причиной снижения риска развития пирексии или какие‑то другие особенности, присущие пожилым людям, могли оказать влияние на эту зависимость? Чтобы ответить на этот вопрос, авторы исследования дополнительно оценили связь между частотой развития пирексии и различными факторами.
Однако проведенный авторами многофакторный анализ показал, что именно возраст был единственной независимой клинической переменной, связанной с развитием пирексии5.
На частоту развития пирексии не влияли5:
- стартовая доза дабрафениба и траметиниба
- число сопутствующих заболеваний
Пожилой возраст — не повод отказываться от таргетной терапии или снижать дозы препаратов
Полученные данные подтверждают, что возраст пациента не должен быть ограничивающим фактором при назначении таргетной терапии. Они также доказывают нецелесообразность снижения доз препаратов у пожилых пациентов, что часто происходит в условиях РКП1. Назначение более низких доз пожилым пациентам не влияет на риск развития пирексии, зато может снизить эффективность лечения.
Выводы
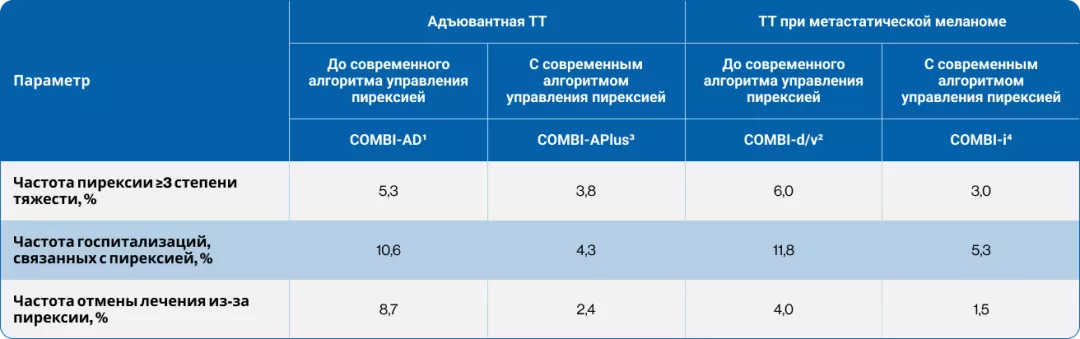
Данные по частоте развития осложнений пирексии в рандомизированных клинических исследованиях
В более ранних исследованиях (COMBI-AD1, COMBI-d/v2) пирексия чаще приводила к развитию осложнений (табл. 2). В настоящее время в качестве стандарта применяется специально разработанный алгоритм действий при пирексии:
- Немедленное прерывание приема дабрафениба и траметиниба при развитии пирексии (t ≥ 38 °C).
- Прием жаропонижающих средств.
- При отсутствии симптомов пирексии (t < 38 °C в течение 24 часов) возобновление приема дабрафениба и траметиниба в начальной дозировке при первом эпизоде и по решению врача в сниженной дозировке при повторном эпизоде.
В исследованиях, проводимых по современному алгоритму (COMBI-APlus3, COMBI-i4), связанные с пирексией осложнения встречались гораздо реже:
в 1,4—3,6 раза (табл. 2).
Список сокращений
ДИ — доверительный интервал;
НЯ — нежелательные явления;
РКИ — рандомизированные клинические исследования;
РКП — реальная клиническая практика;
ТТ — таргетная терапия.
Список литературы
- Long, Georgina V., et al. "Adjuvant dabrafenib plus trametinib in stage III BRAF-mutated melanoma." New England Journal of Medicine 377.19 (2017): 1813-1823.
- Robert, Caroline, et al. "Five-year outcomes with dabrafenib plus trametinib in metastatic melanoma." New England Journal of Medicine 381.7 (2019): 626-636.
- Atkinson, Victoria, et al. "Improved pyrexia-related outcomes associated with an adapted pyrexia adverse event management algorithm in patients treated with adjuvant dabrafenib plus trametinib: Primary results of COMBI-APlus." European Journal of Cancer 163 (2022): 79-87.
- Ascierto, Paolo Antonio, et al. "Pyrexia-related outcomes upon application of an adapted pyrexia management algorithm in patients (pts) with BRAF V600: Mutant unresectable or metastatic melanoma treated with dabrafenib plus trametinib (DabTram) in the COMBI-i trial." (2021): 9560-9560.
- González-Barrallo, Inés, et al. "Relation between dabrafenib plus trametinib-induced pyrexia and age in BRAF V600-mutated metastatic melanoma patients: A post hoc analysis of the real-world ELDERLYMEL study." Melanoma Research 35.3 (2025): 170-175.
- Atkinson, Victoria, et al. "Dabrafenib plus trametinib is effective in the treatment of BRAF V600-mutated metastatic melanoma patients: analysis of patients from the dabrafenib plus trametinib Named Patient Program (DESCRIBE II)." Melanoma research 30.3 (2020): 261-267.
- Berking, C., et al. "1122P Real-world analysis of dabrafenib plus trametinib in patients with BRAFV600-mutated melanoma brain metastases." Annals of Oncology 31 (2020): S755.
- Dima, Danai, et al. "Real‐world outcomes of patients with resected stage III melanoma treated with adjuvant therapies." Cancer Medicine 13.12 (2024): e7257.
- Schadendorf, Dirk, et al. "Pyrexia in patients treated with dabrafenib plus trametinib across clinical trials in BRAF-mutant cancers." European Journal of Cancer 153 (2021): 234-241.
- Clay, Timothy D., and Samantha E. Bowyer. "Dabrafenib and trametinib treatment-associated fevers in metastatic melanoma causing extreme elevation in procalcitonin in the absence of infection." Anti-Cancer Drugs 29.8 (2018): 802-805.
- Hajek, Eva, et al. "BRAF inhibitors stimulate inflammasome activation and interleukin 1 beta production in dendritic cells." Oncotarget 9.47 (2018): 28294.
- Maeda, Takuya, et al. "Dynamics of neutrophil and C‐reactive protein reflect the clinical course of pyrexia during combination therapy with dabrafenib and trametinib." The Journal of dermatology 46.8 (2019): 716-719.
- Schaefer, Hannah, et al. "A distinct four-value blood signature of pyrexia under combination therapy of malignant melanoma with dabrafenib and trametinib evidenced by an algorithm-defined pyrexia score." PLoS One 17.8 (2022): e0273478.
11507661/DAB/web/09.25/0