GEOMETRY Mono-1: экспрессия MET и ответ на капматиниб у пациентов с НМРЛ
Анализ полного транскриптома пациентов, участвовавших в исследовании GEOMETRY Mono-1.
Резюме
- METex14 — драйверная мутация, встречающаяся у 3–4% пациентов с немелкоклеточным раком легкого (НМРЛ).
- В отсутствие других драйверных мутаций МЕТех14, как правило, связана с плохим прогнозом.
- Более высокая исходная экспрессия МЕТ была связана с лучшим ответом на капматиниб у пациентов с НМРЛ.
Введение1
Примерно в 3–4% НМРЛ обнаруживается мутация МЕТех14. Данная мутация, как правило, регистрируется в отсутствие других драйверных мутаций, при этом она связана с более плохим прогнозом для пациентов.
Капматиниб является высокоселективным и выраженным ингибитором МЕТ с противоопухолевой активностью как у ранее леченных, так и у нелеченных пациентов с распространенным НМРЛ с мутацией МЕТех14. Вашему вниманию представлен анализ транскриптома пациентов, получавших капматиниб в рамках исследования GEOMETRY Mono-1 (NCT02414139).
Дизайн исследования1
GEOMETRY Mono-1 — это исследование фазы II, в котором оценивали эффективность и безопасность капматиниба у пациентов с НМРЛ с нарушениями регуляции МЕТ. Пациенты были распределены в когорты на основании предыдущих линий терапии и статуса МЕТ (мутация пропуска экзона 14 или амплификация в соответствии с количеством копий гена в опухолевой ткани). Пациенты получали капматиниб в таблетках по 400 мг два раза в день. Первичной конечной точкой был общий ответ (полный или частичный), а ключевой вторичной конечной точкой была продолжительность ответа. Обе конечные точки оценивались независимым наблюдательным комитетом.
Для текущего анализа были секвенированы мРНК исходных образцов опухолей пациентов. Различия в экспрессии МЕТ и PD-L1 у ответчиков и неответчиков (в соответствии с критериями RECIST 1.1) оценивали с помощью t-критерия. Был проведен анализ обогащения набора генов с поправкой на статус предшествующей терапии, расчетную оценку чистоты опухоли и частоту ложных результатов. Также был проведен многофакторный регрессионный анализ для выявления связи между экспрессией МЕТ и характером экспрессии генов (gene expression signatures, GES) с реакцией опухоли на лечение.
Результаты исследования1
Были успешно профилированы 111 исходных образцов опухолей из 160 пациентов с МЕТех14 НМРЛ при помощи методики RNAseq. Из этих 111 пациентов 41 получал капматиниб в качестве первой линии терапии, 70 пациентов — в качестве второй или третьей линий терапии.
Исходная экспрессия МЕТ и PD-L1 была сравнима для пациентов, получавших препарат в первой или второй/третьей линиях терапии. Более высокая исходная экспрессия МЕТ (выше медиана) была в значительной степени связана с лучшим общим ответом у пациентов, получавших капматиниб в первой линии (p < 0,01, рис.). В то же время для пациентов, получавших препарат во второй/третьей линиях, была показана аналогичная тенденция (р = 0,08).
У пациентов с высокой экспрессией МЕТ, получавших препарат в первой линии, была зарегистрирована значимо более длительная выживаемость без прогрессирования, чем у пациентов с низкой экспрессией МЕТ, получавших препарат в первой линии. Экспрессия PD-L1 не коррелировала с ответом. Характер экспрессии генов клеточной пролиферации был в значительной степени связан с ответом, но не был независимым предиктором ответа после учета экспрессии MET в модели многофакторной регрессии.
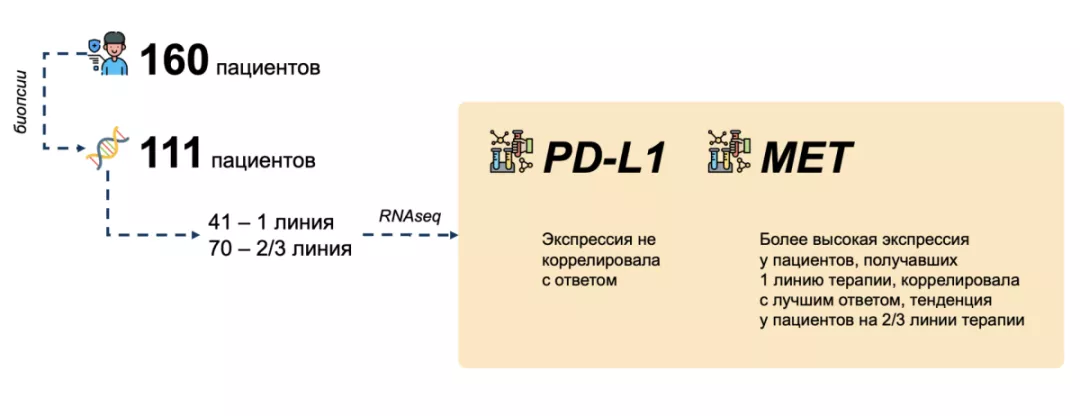
Рисунок. Влияние экспрессии МЕТ на ответ на терапию капматинибом1
Заключение
Таким образом, при полнотранскриптомном анализе исходных образцов опухолей пациентов с МЕТех14 НМРЛ, получавших капматиниб, было обнаружено, что более высокая исходная экспрессия МЕТ связана с лучшим ответом на терапию препаратом.
Список литературы
- Wolf J. Annals of Oncology (2022) 33 (suppl_7): S448-S554. 10.1016/annonc/annonc1064
787846/WEB/GEN/03.24/1