Антитела к факторам комплемента и молекулярно-генетический скрининг на мутации
Пожалуйста, нажмите на интересующий вас раздел, чтобы его открыть.
Система комплемента и ее уязвимости: антитела и генетические мутации
Система комплемента — это важнейшая часть врожденного иммунитета, представляющая собой каскад протеинов, взаимодействующих для защиты организма от инфекций и поддержания иммунного гомеостаза. Они синтезируются преимущественно гепатоцитами, тканевыми макрофагами и фибробластами и присутствуют в плазме крови в неактивном состоянии. Основные функции комплемента включают опсонизацию патогенов, лизис клеток-мишеней и активацию воспалительного ответа. Однако нарушение регуляции комплемента может приводить к аномальной активации, повреждению тканей и развитию патологий. Понимание природы этих нарушений важно для диагностики, прогноза и лечения комплемент-опосредованных заболеваний1.
Ключевые уязвимости системы комплемента можно разделить на две группы2,3,4:
- Антитела к компонентам комплемента. Антитела могут удлинять плазменную экспозицию факторов комплемента, что повышает их активность и приводить к гиперактивации системы или, наоборот, блокировать ее работу, приводя к дисфункции.
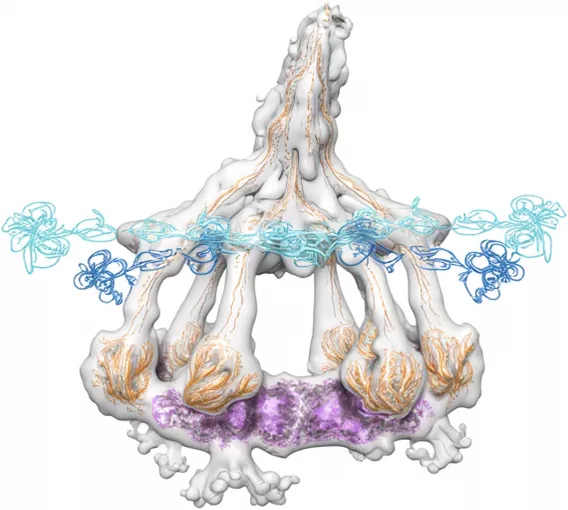
Рисунок 1. Комплемент C1 в комплексе с антителом IgG1.
- Генетические мутации. Мутации в генах, кодирующих белки системы комплемента или ее регуляторы, могут приводить к нарушению баланса между активацией и ингибицией комплемента.
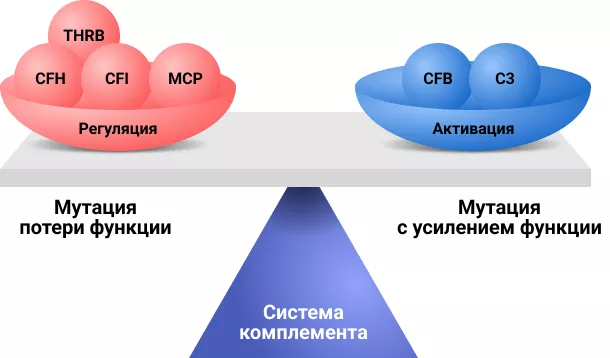
Рисунок 2. Влияние мутаций на работу системы комплемента.
Мутации, чаще всего провоцирующие нарушение системы работы комплемента, можно разделить на две группы5:
- Мутации потери функции (loss of function mutations) представляют собой изменения, приводящие к утрате функциональной активности регуляторов комплемента, вызывая чрезмерную активацию системы комплемента и последующее повреждение эндотелиальных клеток.
Хотя эти мутации приводят к неконтролируемой активации белков комплемента на поверхностях (таких как эндотелий сосудов), регуляция комплемента в плазме может оставаться сохранной. - Мутации с усилением функции (gain of function mutations) приводят к повышенной стабильности и, соответственно, активности факторов системы комплемента. Это вызывает избыточное производство конечного продукта терминального пути системы комплемента — мембраноатакующего комплекса (МАК/C5b-9).
Типы антител к комплементу и их роль в заболеваниях
Антитела к системе могут быть направлены против различных компонентов каскада, включая C1q, C3, C5, фактор H и фактор B и другие.
Основные патологические механизмы включают:
- Гиперактивацию комплемента. Например, антитела к фактору H нарушают его регуляторную функцию, что может приводить к неконтролируемой активации альтернативного пути комплемента. Аутоантитела C3Nef связываются с компонентами С3-конвертазы альтернативного пути, тем самым продлевая ее функциональный период полувыведения, повышая активность всей регуляции системы.
- Блокирование активации. Антитела к C1q ассоциируются с нарушением классического пути активации. Они приводят к снижению уровня C1q в крови, способствуют образованию иммунных комплексов, которые, в свою очередь, откладываются в тканях и нарушают их функцию.
Наиболее изученными клиническими примерами влияния антител на заболевания почек являются4,5,6:
- Атипичный гемолитико-уремический синдром. Антитела к фактору H часто обнаруживаются у пациентов с этой орфанной патологией.
- Аллоантитела против человеческих лейкоцитарных антигенов (HLA), могут активировать систему комплемента, способствуя отторжению, опосредованному антителами, при трансплантации почки.
- Системная красная волчанка (СКВ). Антитела к C1q являются диагностическим маркером и связаны с волчаночным нефритом.
- Мембранозная нефропатия запускается аутоантителами PLA2R и THSD7A, NELL1 и SEMA3B и ряда других. Аутоантитела связываются с антигенами на поверхности подоцитов, что приводит к активации системы комплемента по классическому или лектиновому пути. Определение уровней антител к PLA2R и THSD7A стало стандартом в диагностике и мониторинге мембранозной нефропатии.
Разработка высокоспецифичных тестов для обнаружения антител позволяет уточнить диагноз и выбрать таргетную терапию.
Основные методы диагностики антител к комплементу

Рисунок 3. Виды иммуноферментного анализа.
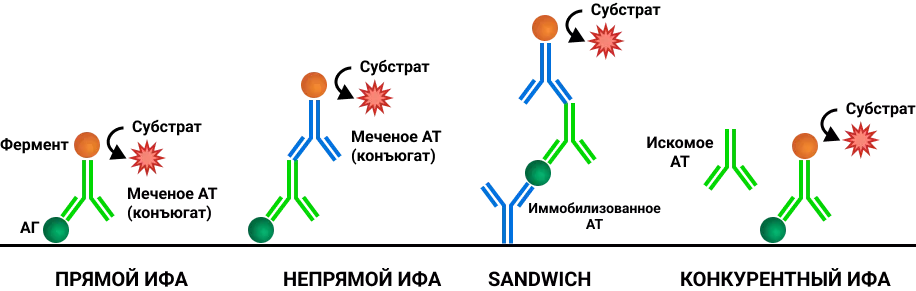

Рисунок 4. Методика иммунохемилюминесцентного тестирования.
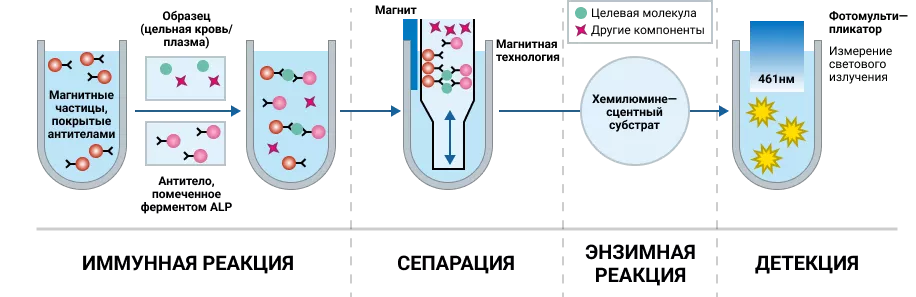

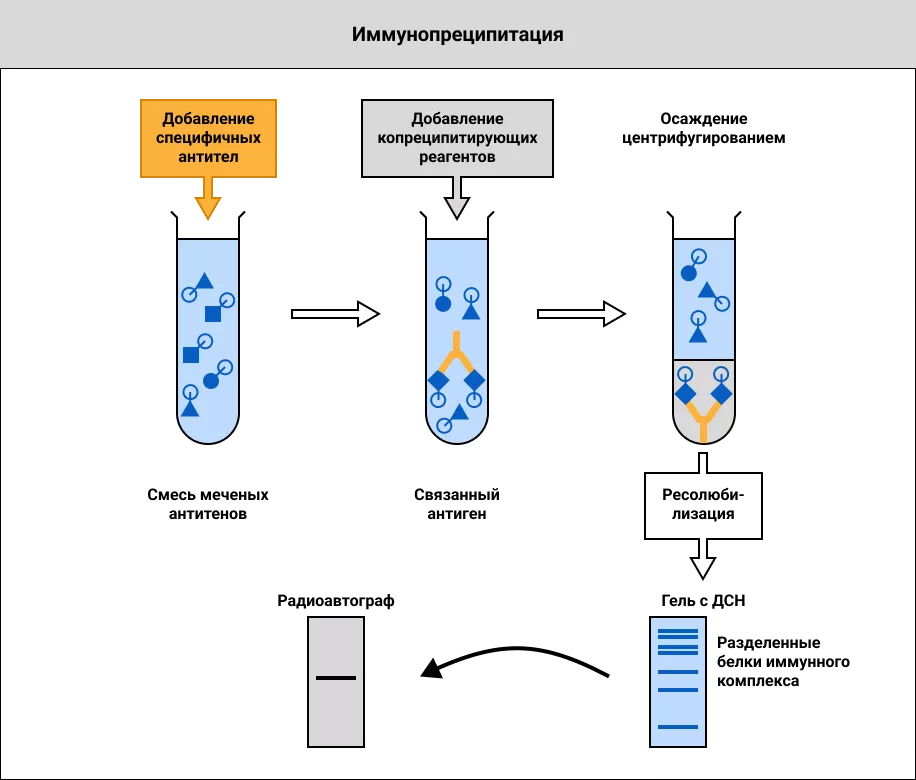
Рисунок 5. Реакция иммунопреципитации.
Когда необходимо обследовать пациента на антитела к системе комплемента?
Следует принять во внимание сохраняющуюся коммерческую недоступность обследования на антитела к белкам системы комплемента. Их выполнение в академических и научных базах не позволяет подвести к единым рекомендациям, валидным для применения в клинической практике.
Можно отметить некоторые закономерности в их назначении, описанные в разных литературных источниках с учетом выше обозначенной оговорки6-10:





Мутации системы комплемента и связанные заболевания
Мутации в системе комплемента являются одной из ключевых причин дисфункции этой системы. Они могут быть наследственными или возникать у пациента de novo5,9,10,11.
С3-гломерулопатия (С3ГП) и болезнь плотных депозитов
Причиной формирования С3-позитивного МПГН, в том числе болезни плотных депозитов (БПД), могут являться мутации гена фактора Н. Моногенная мутация CFHR5, наследуемая по аутосомно-доминантному пути, является причиной эндемической Кипрской нефропатии, представляющей собой С3 позитивный МПГН. Эту форму С3ГП некоторые исследователи выделяют в качестве отдельной нозологии в спектре комплемент-опосредованного МПГН.
В литературе описаны также мутации генов основных белков системы комплемента. Так, при гетерозиготной мутации С3-протеина, в плазме крови присутствуют мутантный С3-протеин одновременно с нативным. В результате спонтанного гидролиза мутантного С3-протеина образуется С3-конвертаза, резистентная к действию фактора Н, которая расщепляет С3-протеин, синтезируемый нормальным геном, вследствие чего образуются в избытке продукты деградации С3-фракции комплемента, что запускает каскадную реакцию активации комплемента по альтернативному пути. Подобный механизм может лежать в основе ответной гломерулярной реакции в виде формирования БПД.
Система комплемента имеет многоступенчатую систему регуляции, а поэтому не всякая генетическая мутация или генный полиморфизм реализуется клинически.
Атипичный гемолитико-уремический синдром (аГУС)
— это заболевание, которое появляется в детстве и характеризуется микроангиопатической гемолитической анемией, тромбоцитопенией и острой почечной недостаточностью, возникающей в результате мембранопролиферативного гломерулонефрита.
Причиной этого заболевания является дисрегуляция активации комплемента после мутации в факторе H, факторе I, мембрано-связанном кофакторном белке или белках, связанных с фактором H (FHR) 1, 3 или 5, что нарушает функционирование этих ингибиторов.
Мутации в гене фактора H являются наиболее частой причиной аГУС. Дефектный фактор H не может эффективно ингибировать C3-конвертазу, что приводит к неконтролируемой активации комплемента и повреждению эндотелия. Кроме того, мутации в C3 и факторе B тоже могут приводить к развитию патологии.
Клиническая значимость мутаций
Генетические нарушения системы комплемента чаще всего проявляются в органах с высоким уровнем микроциркуляции, таких как почки. Существуют доказательства в пользу того, что наличие мутаций в генах системы комплемента является прогностически вероятностным фактором в пожизненном назначении комплемент-блокирующей терапии, так как после окончания терапии высок риск обострения. Помимо этого, у таких пациентов значительно выше и риск рецидива заболевания в трансплантате10,12.
Диагностика мутаций имеет важное значение для:
- Определения возможного прогноза и исхода заболевания;
- Подбора таргетной терапии;
- Генетического консультирования семей;
- Изменение тактики ведения реципиентов почечного трансплантата.
Когда необходимо проводить молекулярно-генетическое тестирование на маркеры нарушения системы комплемента?
Молекулярно-генетическое тестирование на маркеры нарушения системы комплемента проводится в следующих случаях10,13,14,15:
Исследования, применяемые в рамках генетического анализа на комплемент-опосредованные заболевания8,10,15,16
Развитие современных технологий открывает новые горизонты в диагностике и лечении заболеваний системы комплемента, позволяя существенно улучшить прогноз пациентов. Успешная реализация этих возможностей требует внедрения стандартов обследования и повышения осведомленности врачей.
Список сокращений
PLA2R — рецептор фосфолипазы A2 типа М;
THSD7A — тромбоспондиновый тип домена 7A;
NELL1 — нейрональный эпидермальный фактор роста типа 1;
SEMA3B — семафорин 3B;
C1q — фактор комплемента, компонент классического пути активации;
C3Nef — C3-нефритогенный фактор, аутоантитело, стабилизирующее C3-конвертазу альтернативного пути комплемента;
ELISA — ферментно-связанный иммуносорбентный анализ;
IP — иммунопреципитация;
PLA2R, THSD7A, NELL1 и SEMA3B — аутоантитела;
CGH — сравнительная геномная гибридизация;
FISH — флуоресцентная гибридизация in situ;
HLA — антигены человеческого лейкоцитарного антигена (human leukocyte antigen);
аГУС — атипичный гемолитико-уремический синдром;
ИФА — иммуноферментный анализ;
БПД — болезнь плотных депозитов;
MАК — мембраноатакующий комплекс;
СКВ — системная красная волчанка;
С3ГП — С3-гломерулопатия;
ТМА — тромботическая микроангиопатия;
МПГН — мембранопролиферативный гломерулонефрит.
Список литературы
- Литвицкий Петр Францевич, Синельникова Т. Г. Врожденный иммунитет: механизмы реализации и патологические синдромы. Часть 3 // ВСП. 2009. №3. URL: https://cyberleninka.ru/article/n/vrozhdennyy-immunitet-mehanizmy-realiz... (дата обращения: 27.12.2024).
- Willows J, Brown M, Sheerin NS. The role of complement in kidney disease. Clin Med (Lond). 2020 Mar;20(2):156-160. doi: 10.7861/clinmed.2019-0452. PMID: 32188650; PMCID: PMC7081808.
- Mathern DR, Heeger PS. Molecules Great and Small: The Complement System. Clin J Am Soc Nephrol. 2015 Sep 4;10(9):1636-50. doi: 10.2215/CJN.06230614. Epub 2015 Jan 7. PMID: 25568220; PMCID: PMC4559511.
- Fakhouri F, Frémeaux-Bacchi V, Noël LH, Cook HT, Pickering MC. C3 glomerulopathy: a new classification. Nat Rev Nephrol. 2010 Aug;6(8):494-9. doi: 10.1038/nrneph.2010.85. Epub 2010 Jul 6. PMID: 20606628.
- Feitz WJC, van de Kar NCAJ, Orth-Höller D, van den Heuvel LPJW, Licht C. The genetics of atypical hemolytic uremic syndrome. Med Genet. 2018;30(4):400-409. doi: 10.1007/s11825-018-0216-0. Epub 2018 Dec 21. PMID: 30930551; PMCID: PMC6404389.
- Цанян М. Э., Торгашина А. В., Александрова Е. Н., Соловьев С. К., Насонов Е. Л. АНТИТЕЛА К КОМПОНЕНТУ С1Q КОМПЛЕМЕНТА У БОЛЬНЫХ СИСТЕМНОЙ КРАСНОЙ ВОЛЧАНКОЙ НА ФОНЕ ЛЕЧЕНИЯ РИТУКСИМАБОМ // Терапевтический архив. 2013. №5. URL: https://cyberleninka.ru/article/n/antitela-k-komponentu-s1q-komplementa-... (дата обращения: 27.12.2024).
- Nilsson B, Ekdahl KN. Complement diagnostics: concepts, indications, and practical guidelines. Clin Dev Immunol. 2012;2012:962702. doi: 10.1155/2012/962702. Epub 2012 Nov 14. PMID: 23227092; PMCID: PMC3511841.
- Seelen MA, Roos A, Wieslander J, et al. Functional analysis of the classical, alternative, and MBL pathways of the complement system: standardization and validation of a simple ELISA. Journal of Immunological Methods. 2005;296(1-2):187–198. doi: 10.1016/j.jim.2004.11.016.
- Gale DP, de Jorge EG, Cook HT, Martinez-Barricarte R, Hadjisavvas A, McLean AG, Pusey CD, Pierides A, Kyriacou K, Athanasiou Y, Voskarides K, Deltas C, Palmer A, FrémeauxBacchi V, de Cordoba SR, Maxwell PH, Pickering MC. Identification of a mutation in complement factor H-related protein 5 in patients of Cypriot origin with glomerulonephritis. Lancet. 2010 Sep 4;376(9743):794-801. doi: 10.1016/S0140-6736(10)60670-8.
- Длин Владимир Викторович, Игнатова Майя Сергеевна Нефропатии, связанные с патологией системы комплемента // Рос вестн перинатол и педиат. 2016. №6. URL: https://cyberleninka.ru/article/n/nefropatii-svyazannye-s-patologiey-sis... (дата обращения: 27.12.2024).
- Noris M, Caprioli J, Bresin E, Mossali C, Pianetti G, Gamba S, Daina E, Fenili C, Castelletti F, Sorosina A, Piras R, Donadelli R, Maranta R, van der Meer I, Conway EM, Zipfel PF, Goodship TH, Remuzzi G. Relative role of genetic complement abnormalities in sporadic and familial aHUS and their impact on clinical phenotype. Clin J Am Soc Nephrol. 2010 Oct;5(10):1844-59. doi: 10.2215/CJN.02210310. Epub 2010 Jul 1. PMID: 20595690; PMCID: PMC2974386.
- Fakhouri F, et. al. Kidney Int Rep. 2022 Mar 4;7(6):1165-1178.
- Lemaire M, Noone D, Lapeyraque AL, Licht C, Frémeaux-Bacchi V. Inherited Kidney Complement Diseases. Clin J Am Soc Nephrol. 2021 Jun;16(6):942-956. doi: 10.2215/CJN.11830720. Epub 2021 Feb 3. PMID: 33536243; PMCID: PMC8216622.
- Osborne AJ, Breno M, Borsa NG, Bu F, Frémeaux-Bacchi V, Gale DP, van den Heuvel LP, Kavanagh D, Noris M, Pinto S, Rallapalli PM, Remuzzi G, Rodríguez de Cordoba S, Ruiz A, Smith RJH, Vieira-Martins P, Volokhina E, Wilson V, Goodship THJ, Perkins SJ. Statistical Validation of Rare Complement Variants Provides Insights into the Molecular Basis of Atypical Hemolytic Uremic Syndrome and C3 Glomerulopathy. J Immunol. 2018 Apr 1;200(7):2464-2478. doi: 10.4049/jimmunol.1701695. Epub 2018 Mar 2. PMID: 29500241; PMCID: PMC6324840.
- Robert, Thomas & Raymond, Laure & Dancer, Marine & Torrents, Julia & Jourde-Chiche, Noémie & Burtey, Stephane & Béroud, Christophe & Mesnard, Laurent. (2023). Beyond the kidney biopsy: genomic approach to undetermined kidney diseases. Clinical Kidney Journal. 17. 10.1093/ckj/sfad099.
- https://www.labtestsguide.com/fish-fluorescence-in-situ-hybridization#go... (дата обращения 21.01.25).
Полезные материалы
11351348/IPT/DIG/01.25