TELESTO: исследование безопасности и эффективности деферазирокса при лечении пациентов с миелодиспластическим синдромом
Миелодиспластический синдром (МДС) представляет собой группу заболеваний, характеризующихся гипоклеточностью костного мозга, цитогенетическими и молекулярными изменениями с высоким риском развития острого миелоидного лейкоза (ОМЛ).
Симптомы заболевания зависят от того, какая из клеточных линий поражена наиболее сильно, — они могут включать:
- Утомляемость.
- Слабость.
- Бледность (вследствие анемии).
- Повышение частоты инфекций и лихорадку (вследствие нейтропении).
- Кровоточивость и склонность к кровоизлияниям (вследствие тромбоцитопении).
Большинство пациентов с МДС низкого риска в конечном итоге нуждаются в хроническом переливании эритроцитов из-за нарушения процессов кроветворения. Это приводит к перегрузке железом, повреждающей функции органов, и способствует сокращению продолжительности жизни.
• После всего лишь 10 переливаний (~20 единиц pRBC) уровень ферритина в сыворотке крови может превышать 1000 мкг/л, что подвергает пациентов риску хронической перегрузки железом1.
TELESTO — первое и единственное исследование, подтверждающее клиническую пользу от использования хелаторной терапии при лечении пациентов с МДС низкого или ПРОМ-1 риска по шкале IPSS3.
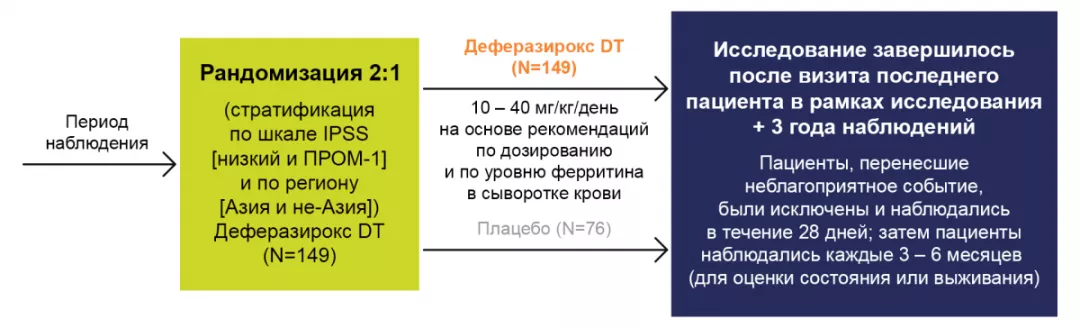
Дизайн исследования
Конечные точки
Первичная конечная точка
Бессобытийная выживаемость в обеих группах, определяемая как:
- Составная первичная конечная точка — от времени рандомизации до времени первого задокументированного нефатального события или смерти, в зависимости от произошедшего раньше.
- Нефатальные события включали: ухудшение функций сердца, нарушение функций печени, цирроз печени, госпитализация по поводу застойной сердечной недостаточности или развитие в ОМЛ.
Вторичные конечные точки
- Общая выживаемость.
- Изменение уровня ферритина в сыворотке крови.
- Гематологическое улучшение с точки зрения эритроидного ответа (на основе критериев Международной рабочей группы по МДС).
- Изменение эндокринной функции.
- Прогрессирование заболевания (прогрессирование МДС и прогрессирование до ОМЛ).
- Изменение функций сердца.
- Частота возникновения инфекций, требующих внутривенного введения антибактериальных препаратов.
- Безопасность.
Общее число пациентов (N=225)
МДС.
- Низкий риск: n=62 [27,6%].
- Риск ПРОМ-1: n=163 [72,4%].
Возраст: от 20 до 88 (средний возраст — 61 год).
- Процент пациентов ≥75 лет был больше в группе деферазирокса DT по сравнению с группой, получавшей плацебо (25,5% против 17,1%).
- Мужчины: n=137 (61%); женщины: n=88 (39%).
- Большинство пациентов были хелатно-наивными: n=176 (78,2%).
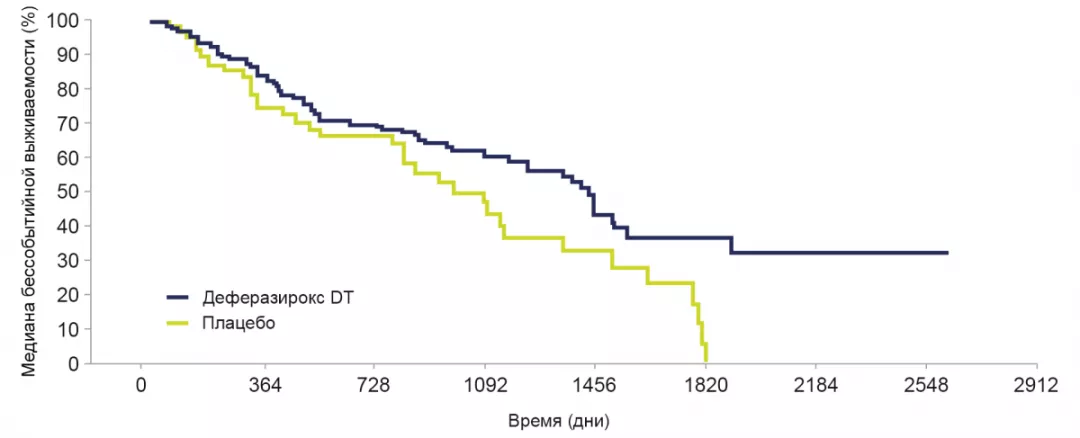
Лечение деферазироксом DT приводило к более длительной бессобытийной выживаемости по сравнению с плацебо.
Медиана бессобытийной выживаемости была увеличена на 349 дней при применении деферазирокса ДТ (1440 дней; 95% Ди: 1167–1559) по сравнению с плацебо (1091 день; 95% Ди: 820–1348).
Отношение рисков: 0,636; 95% Ди: 0,42–0,96; номинальный Р=0,015.
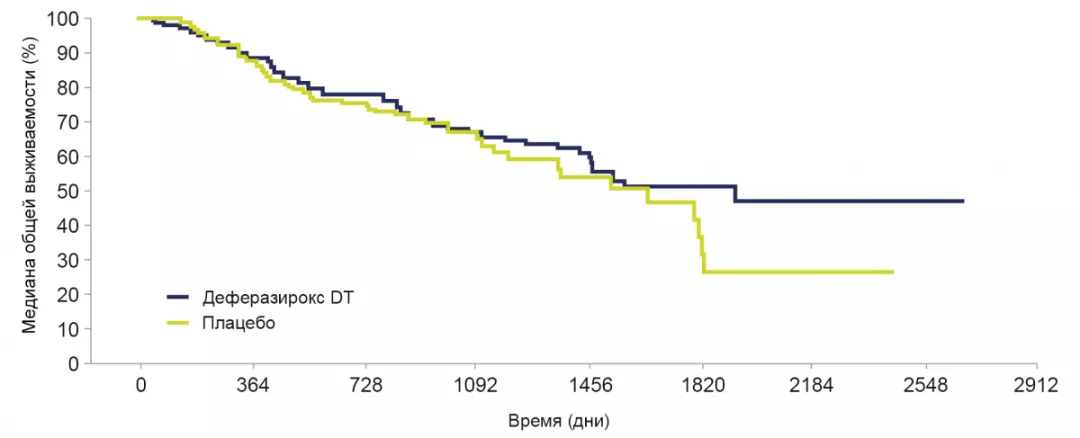
Лечение деферазироксом DT показало положительное влияние на общую выживаемость.
Медиана общей выживаемости при применении деферазирокса составила 1907 дней (95% Ди: 1440, не достигнут) и 1509 дней при применении плацебо (95% Ди: 1095, 1804). Коэффициент опасности: 0,832; 95% Ди: 0,54, 1,28 (номинальный Р=0,200).
Деферазирокс DT эффективно снижает уровень ферритина в сыворотке крови.
- Наблюдалась тенденция к снижению уровня сывороточного ферритина по сравнению с исходным уровнем в группе деферазирокса DT и тенденция к увеличению — в группе плацебо.
- В группе деферазирокса DT наблюдалось снижение риска повышения сывороточного ферритина на 80,5% (>2 исходных значений) по сравнению с группой плацебо (ОР=0,195, 95% Ди: 0,11, 0,36).
Нежелательные явления
Частота нежелательных явлений, связанных с терапией, была одинаковой между группами деферазирокса DT и плацебо — за исключением повышенного уровня креатинина в крови.
| Деферазирокс DT (n=148) | Плацебо (n=76) | |||
|---|---|---|---|---|
| Все НЯ (%) | Тяжелые НЯ (%) | Все НЯ (%) | Тяжелые НЯ (%) | |
| Диарея | 24.7 | 1.3 | 23.9 | 1.9 |
| Пирексия | 21.8 | 3.8 | 18.7 | 2.9 |
| Повышение уровня креатинина в крови | 15.9 | 0.3 | 0.9 | 0 |
| Инфекция верхних дыхательных путей | 16.7 | 1.3 | 22.7 | 1.9 |
| Кашель | 12.6 | 0.3 | 11.3 | 0 |
| Тошнота | 10.7 | 0.7 | 10.4 | 0 |
| Периферический отек | 8.2 | 0 | 10.9 | 1.9 |
| Утомляемость | 8.0 | 0.3 | 13.5 | 0.9 |
| Запоры | 7.0 | 0.7 | 12.9 | 0.9 |
| Головная боль | 6.3 | 0 | 14.6 | 1.9 |
| Боль в животе | 4.9 | 0.3 | 10.1 | 0.9 |
НЯ — нежелательные явления.
| НЯ, приводящие к прерыванию лечения | 20.3% Деферазирокс | 17.1% Плацебо |
|---|---|---|
| Деферазирокс DT (N=148), n (%) | Плацебо (N=76), n (%) | |
| Всего | Всего | 1.9 |
| Повышение уровня креатинина в крови | 5 (3.4) | 0 |
| Снижение уровня почечного клиренса креатинина | 5 (3.4) | 0 |
| Диарея | 3 (2.0) | 0 |
| ОМЛ | 1 (0.7) | 2 (2.6) |
| Смертность во время лечения | 16.2% Деферазирокс | 13.2% Плацебо |
НЯ — нежелательные явления; ОМЛ — острый миелоидный лейкоз.
Наиболее частыми причинами смерти на фоне лечения в группах деферазирокса ДТ и плацебо были, соответственно:
- МДС (0,7% против 3,9%);
- легочная инфекция (0,7% против 2,6%);
- сепсис (2,0% против 0,0%);
- септический шок (1,4% против 0,0%);
- синдром полиорганной дисфункции (1,4% против 0,0%);
- сердечная недостаточность (1,4% против 0,0%).
Деферазирокс имеет проверенный долгосрочный профиль безопасности с соответствующим мониторингом1,4–6. Нежелательные явления обычно бывают легкими или умеренными, могут управляться без прерывания приема препарата1,4.
Нежелательные явления, связанные с изменением уровня креатинина, были не критическими, не прогрессирующими и являются обратимыми4.
- Результаты более длительного наблюдения за расширенными и долгосрочными наблюдательными исследованиями деферазирокса продемонстрировали отсутствие поздних или кумулятивных нефротоксических эффектов.
- Было проанализировано 282 пациента, и более 90% пациентов наблюдались в течение не менее 7 лет — из наблюдаемых пациентов большинство имели талассемию и у 9 пациентов был поставлен диагноз МДС.
Список литературы
- Data on file. Exjade/Jadenu Core Data Sheet v3.3. Novartis Pharmaceuticals Corp; July 2018.
- Lyons RM, Marek BJ, Paley C, et al. Relation between chelation and clinical outcomes in lower-risk patients with myelodysplastic syndromes: registry analysis at 5 years. Leuk Res. 2017;56:88-95.
- Data on File. TELESTO Study ICL670A2302. Novartis Pharmaceuticals Corp. 2018.
- Cappellini MD, Porter J, El-Beshlawy A, et al; EPIC study investigators. Tailoring iron chelation by iron intake and serum ferritin: the prospective EPIC study of deferasirox in 1744 patients with transfusion dependent anemias. Haematologica. 2010;95(4):557-566.
- Origa R, Piga A, Tartaglione I, et al. Renal safety under long-course deferasirox therapy in iron overloaded transfusion dependent β-thalassemia and other anemias [correspondence]. Am J Hematol. 2018;93(7):E172-E175.
- Taher AT, Origa R, Perrotta S, et al. New film-coated tablet formulation of deferasirox is well tolerated in patients with thalassemia or lower-risk MDS: results of the randomized, phase II ECLIPSE study. Am J Hematol. 2017;92(5):420-428.
11279958/JAD/WEB/10.24/0