Обзор исследования RESPONSE
Рандомизированное открытое многоцентровое исследование III фазы по оценке эффективности и безопасности ингибитора JAK2 руксолитиниба (INC424) в сравнении с наилучшей доступной терапией у пациентов с истинной полицитемией (ИП) с резистентностью и/или непереносимостью гидроксикарбамида1–3.
Ключевые выводы исследования
Терапия руксолитинибом:
- обеспечивает эффективный и длительный контроль гематокрита и сокращение размеров селезенки;
- позволяет эффективно контролировать симптомы опухолевой интоксикации1–3.
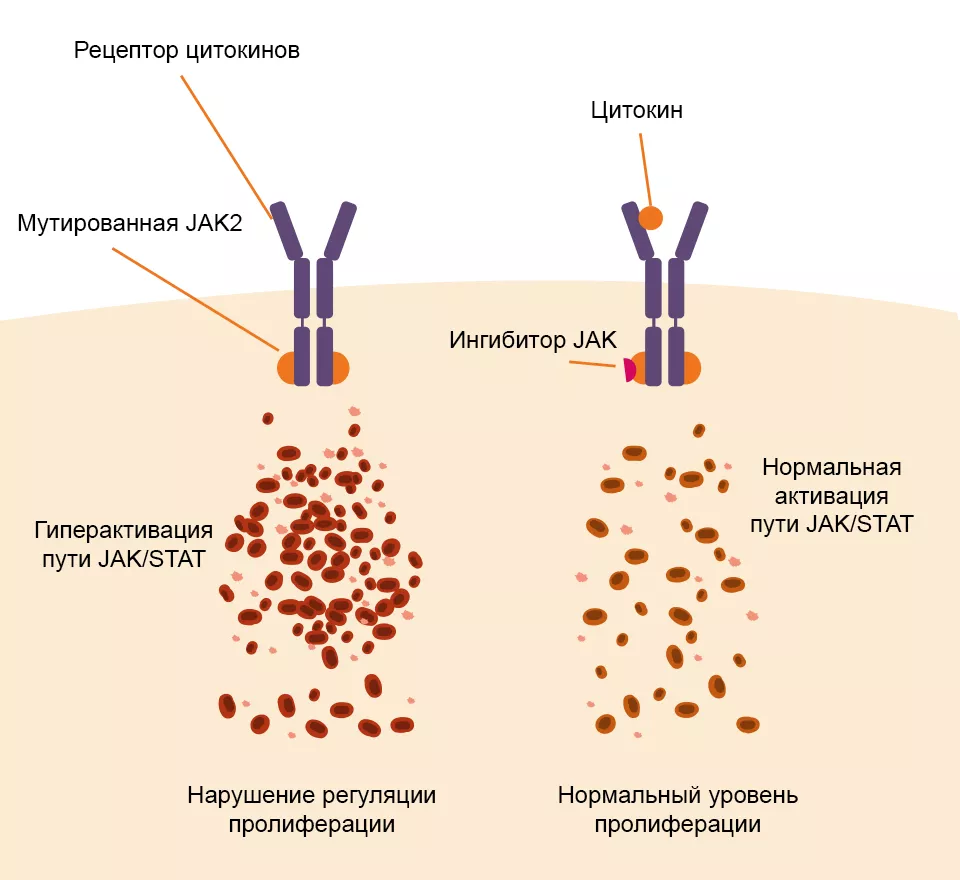
Роль мутаций JAK21–3
JAK2 — янус-киназа II типа; STAT — сигнальный белок и активатор транскрипции.
Руксолитиниб — терапевтическая опция для больных с резистентностью/непереносимостью гидроксимочевины3–5
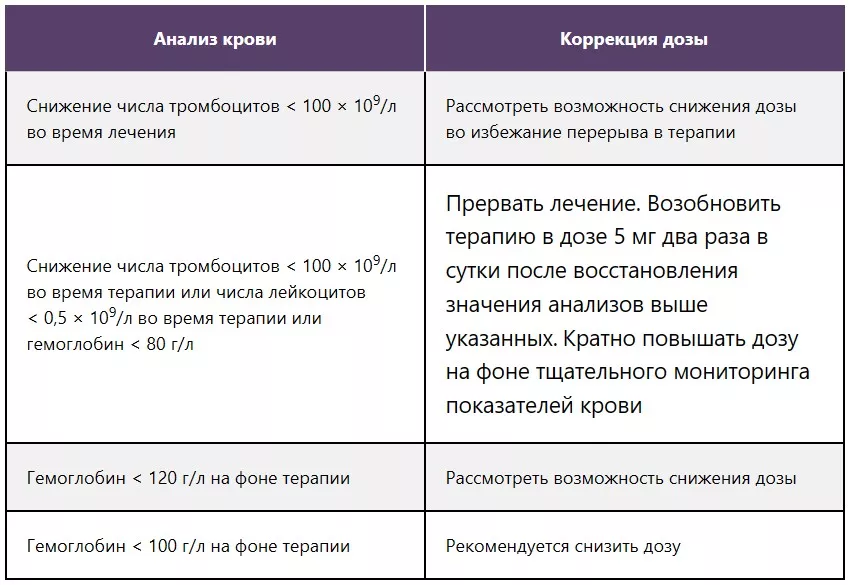
- Рекомендуемая стартовая доза зависит от уровня тромбоцитов: 10 мг два раза в сутки.
- Максимальная доза: 25 мг два раза в сутки.
Коррекция дозы по результатам оценки анализов крови4
RESPONSE: открытое рандомизированное исследование III фазы3

Примечание.
ЛДТ — лучшая доступная терапия.
Ключевые критерии включения3
- Подтвержденный диагноз ИП.
- Наилучший эффект флеботомии достигается среди пациентов низкого риска на ранних стадиях болезни:
- ≥ 2 флеботомии с интервалом ≥ 4 недель в течение 24 недель до скрининга;
- ≥ 1 флеботомия в течение 16 скрининга, если уровень гематокрита на момент скрининга > 45%;
- Спленомегалия ≥ 450 см3 по данным МРТ или КТ.
Ключевые критерии исключения3
- Нарушение функции печени6.
- Значимая инфекция, требующая лечения6.
- Активное злокачественное заболевание в предшествующие 5 лет (исключая некоторые виды рака кожи)6.
- Клинически значимая болезнь сердца7.
Первичная конечная точка3
Контроль гематокрита и ответ со стороны селезенки на 32-й неделе.
- Контроль гематокрита: отсутствие флеботомий с 8-й по 32-ю неделю, ≥ 1 флеботомия до 8-й недели.
- Ответ селезенки на лечение: уменьшение объема селезенки ≥ 35% по данным МРТ на 32-й неделе.
Характеристики исследуемой популяции (n = 222)
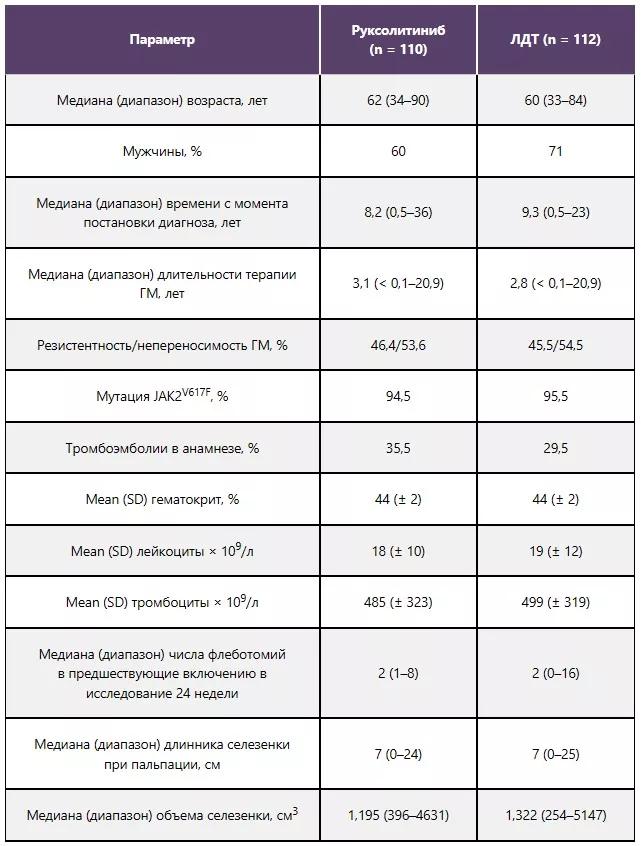
Комбинированная первичная конечная точка5,8
77% пациентов, получавших руксолитиниб, достигли ≥ 1 компонента первичной конечной точки.
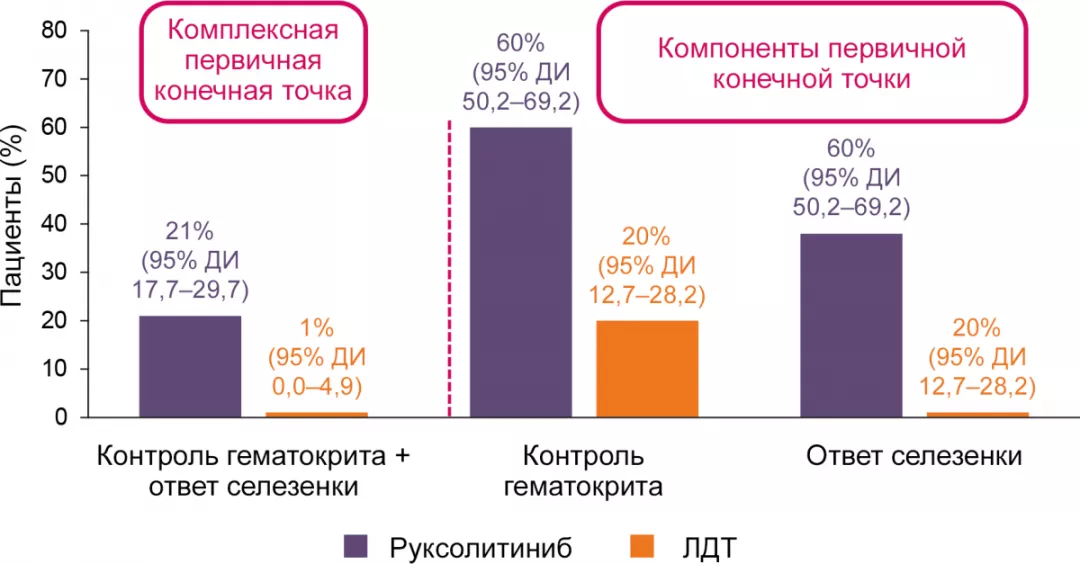
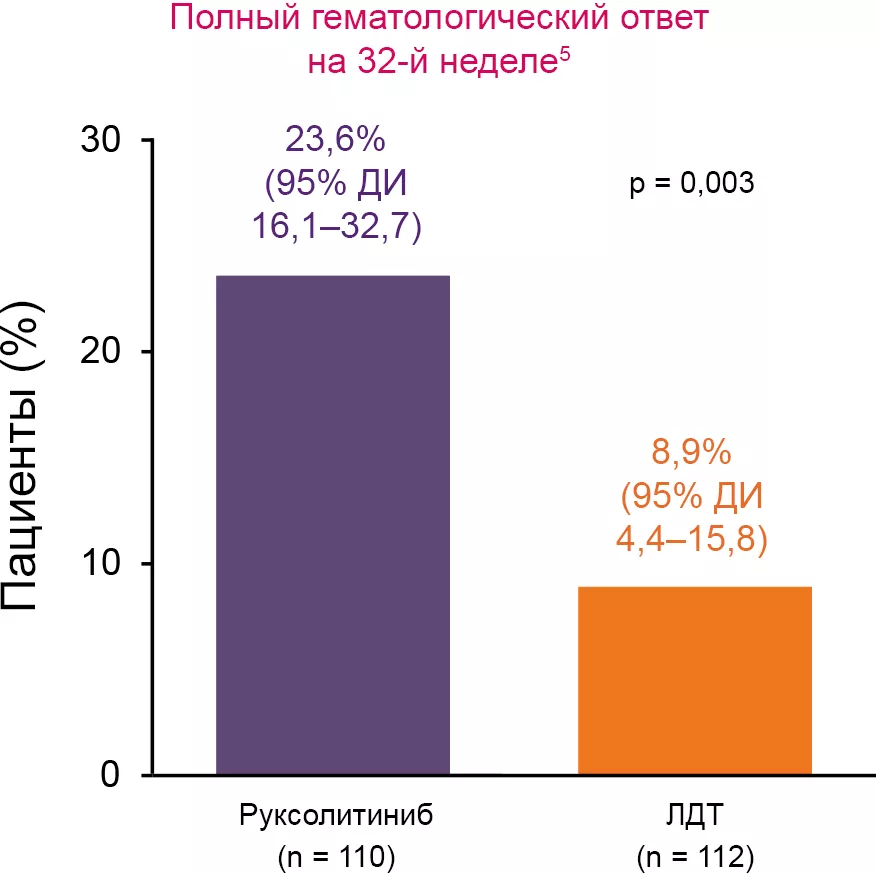
Гематологический ответ5,8
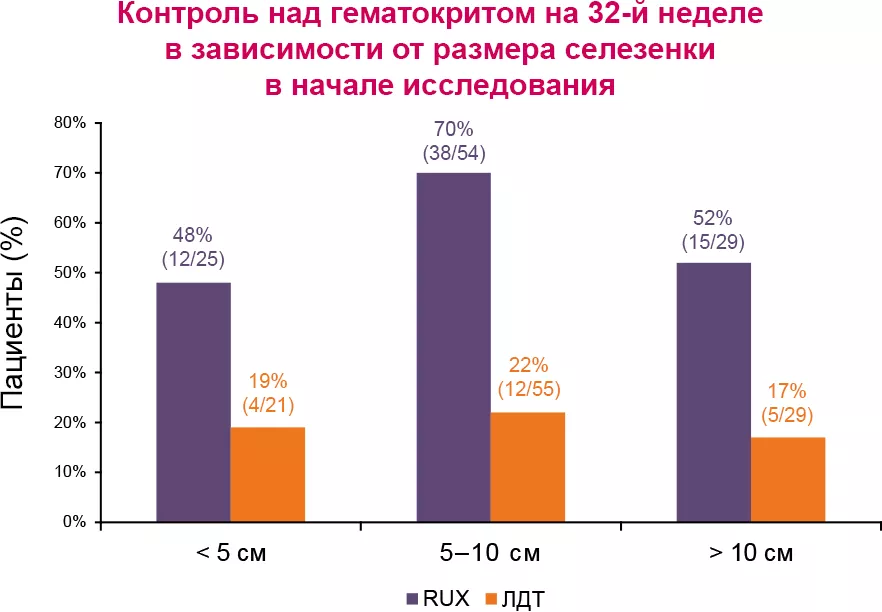
Ответ по уровню гематокрита
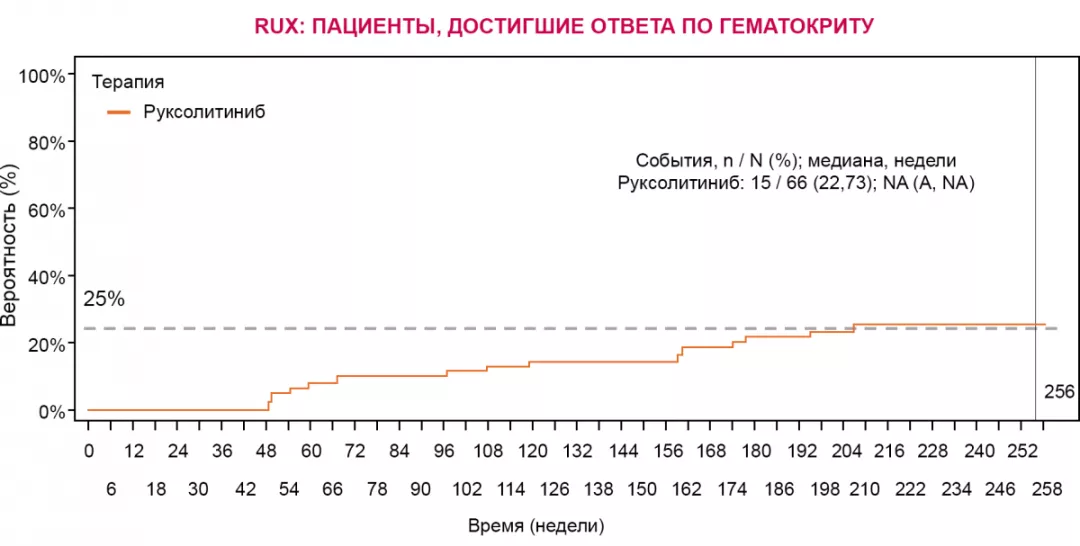
Примечание.
RUX — руксолитиниб; NA — недоступно.
Ответ по уровню гематокрита: отсутствие потребности в проведении флеботомии с 8-й по 32-ю неделю исследования, не более одной флеботомии с момента рандомизации до 8-й недели.
Среди пациентов группы RUX, достигших ответа в отношении гематокрита, медиана потребности во флеботомии не достигнута.
Уровень лейкоцитов (р = 0,0198), начальная аллельная нагрузка JAK2V617F (p = 0,0159) и группа терапии (RUX vs ЛДТ; р < 0,0001) стали предикторами ответа по гематокриту.
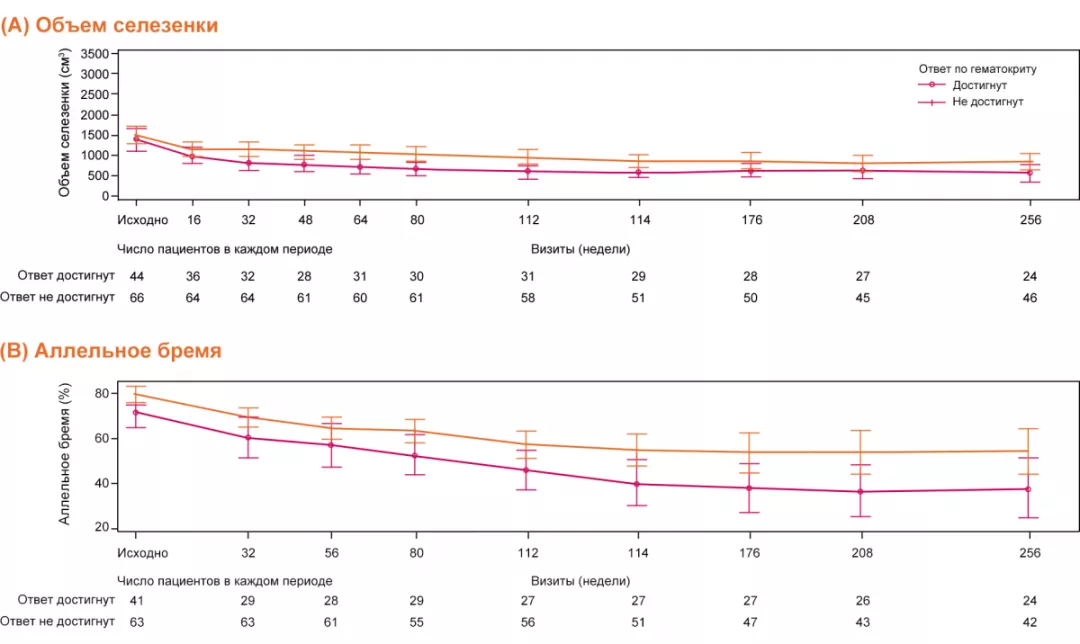
Примечание.
Ответ по уроню гематокрита: отсутствие потребности в проведении флеботомии с 8-й по 32-ю неделю исследования, не более одной флеботомии с момента рандомизации до 8-й недели.
Объем селезенки и аллельная нагрузка JAK2V617F снижались независимо от ответа по гематокриту.
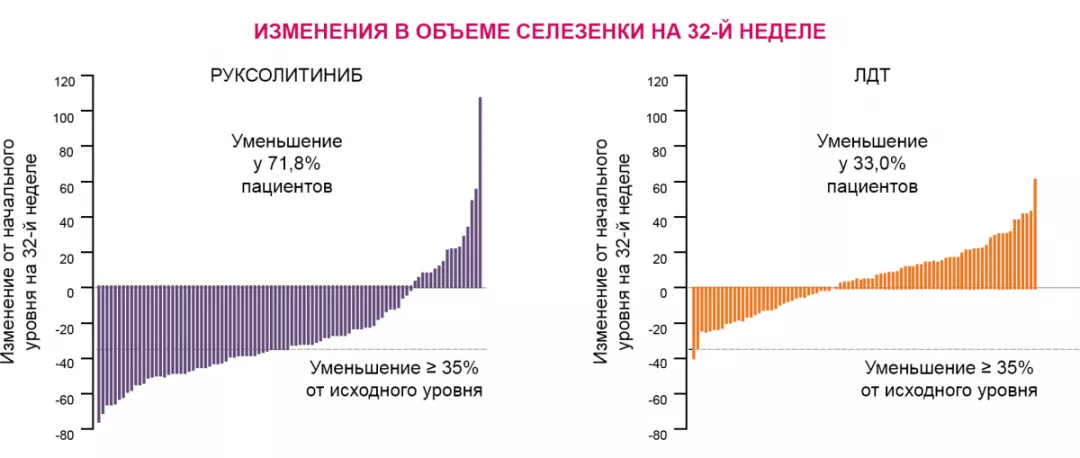
На фоне терапии руксолитинибом 71,8% пациентов достигли уменьшения размеров селезенки5,8
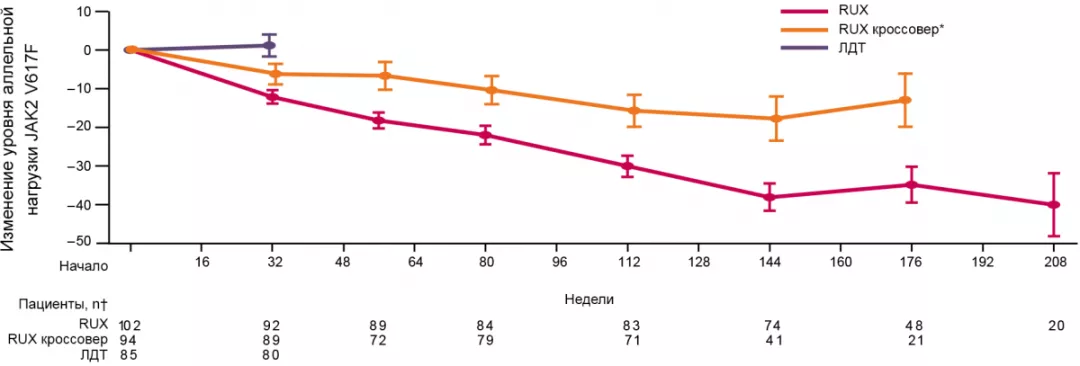
Уменьшение аллельной нагрузки JAK2V617F
Около 30% пациентов с ИП могут достичь снижения уровня аллельной нагрузки JAK2V617F на фоне терапии руксолитинибом, в некоторых случаях снижение сохраняется до 208-й недели.
У 22% пациентов группы кроссовер также отметили снижение аллельной нагрузки JAK2V617F.
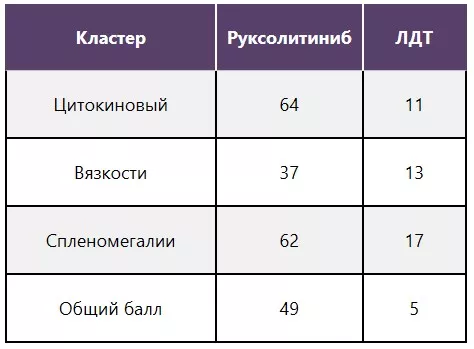
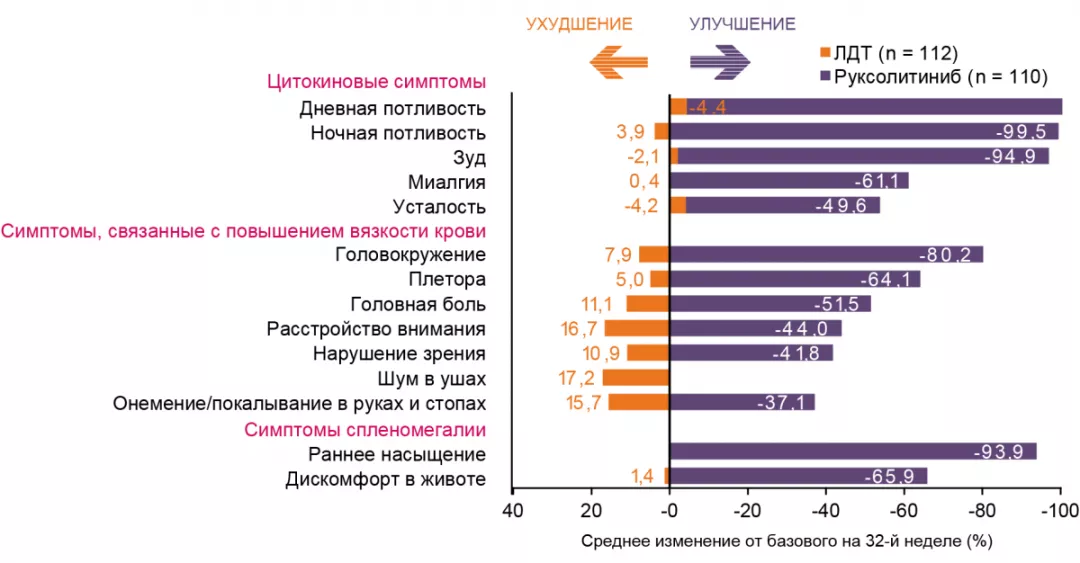
Снижение выраженности симптомов5,11
Снижение выраженности симптомов5,11
У 49% пациентов, принимавших руксолитиниб, отметили ≥ 50% снижение общего балла по шкале оценки симптомов опросника MPN-SAF1*.
Качество жизни пациентов
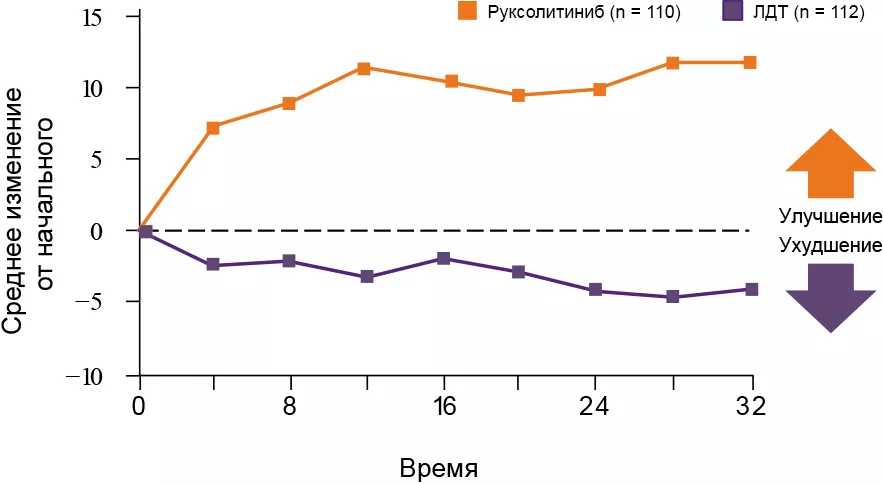
Изменения гематологических показателей3,10
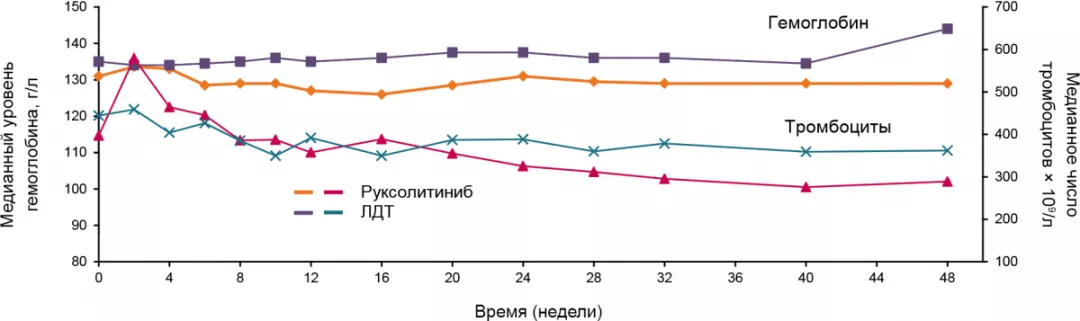
Контроль гематокрита
Гематокрит среди большинства пациентов группы RUX достигал уровня < 45% вне зависимости от начального значения и оставался таковым в течение длительного времени.
Среди больных группы ЛДТ в среднем отмечено ухудшение контроля над гематокритом.
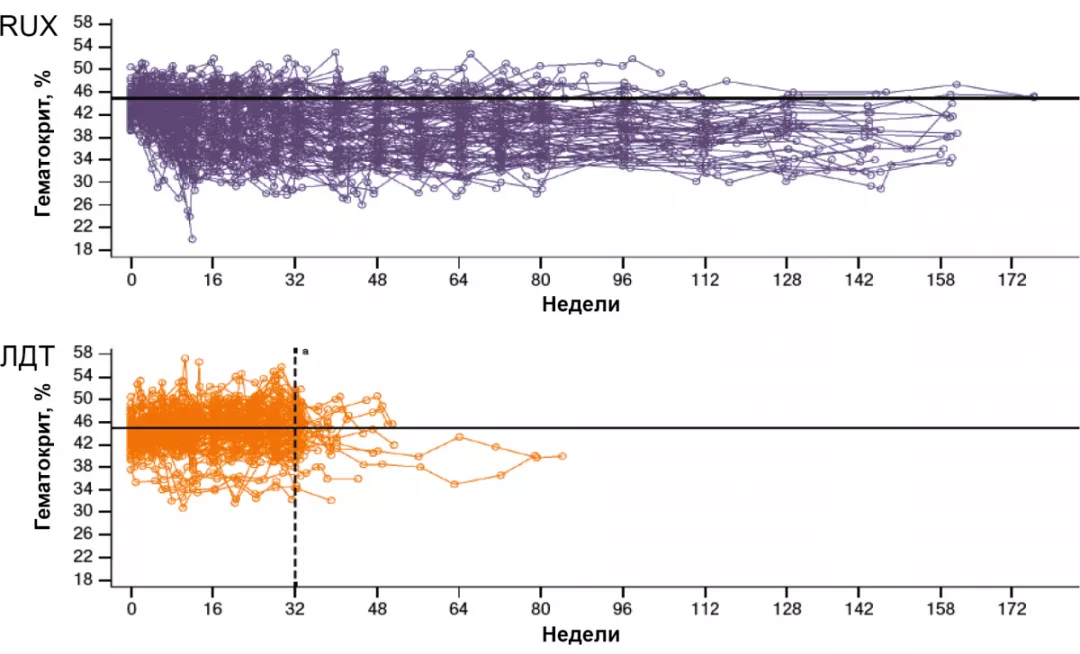
Пунктирная линия на 32-й неделе показывает самое раннее время, когда больные могли перейти на лечение RUX. Данные пациентов после смены терапии в группе ЛДТ исключены.
Негематологическая токсичность3,10,11
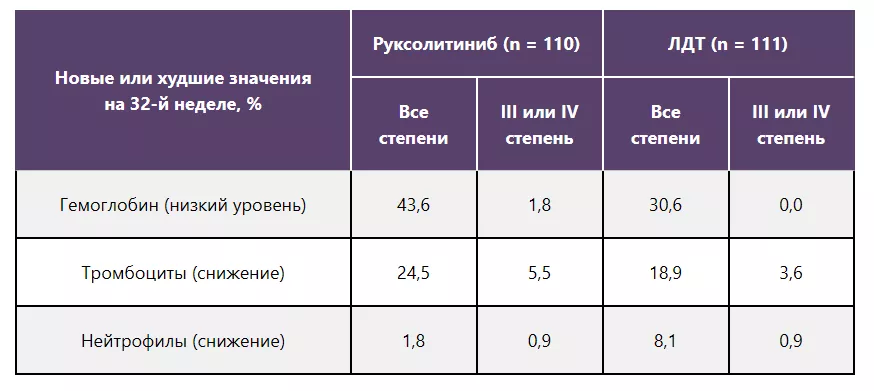
Негематологические НЯ на 32-й неделе
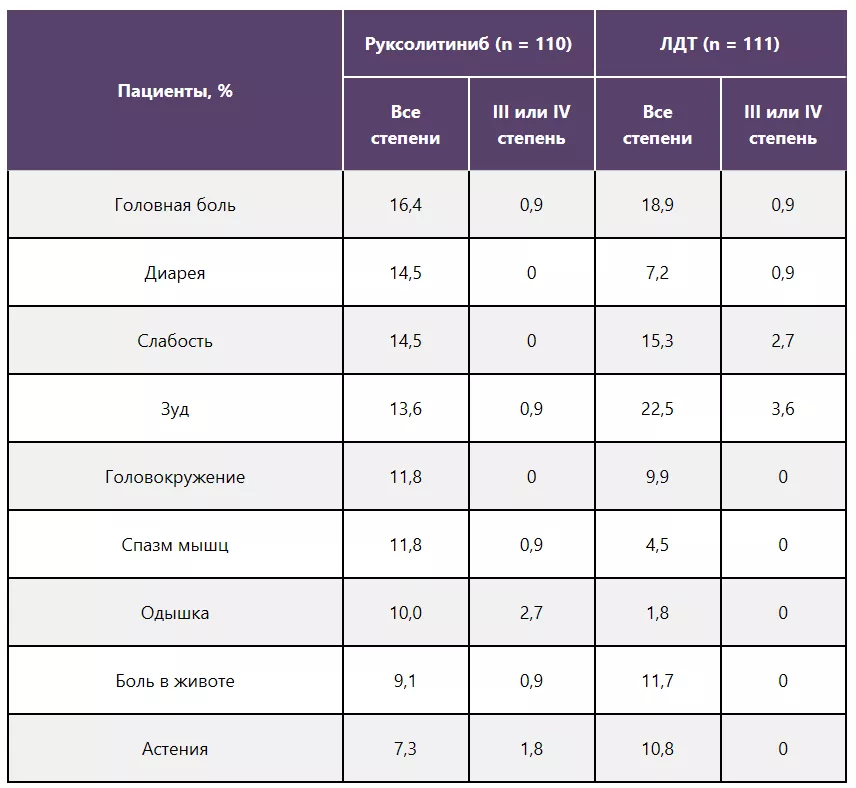
Примечание.
Включены НЯ, развившиеся у ≥ 10% пациентов в любой из групп.
Один пациент из группы ЛДТ отозвал согласие на участие в исследовании и не получал терапию.
Ответ на терапию через 5 лет наблюдения3,10,11
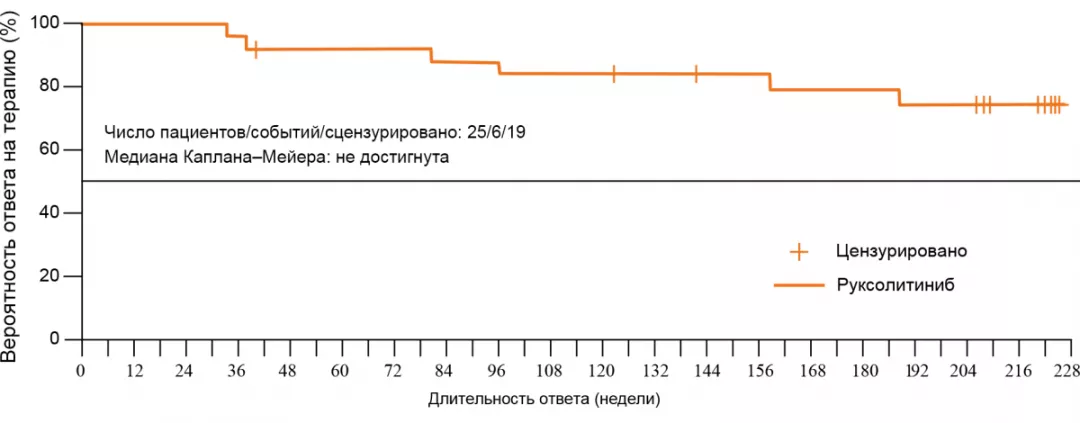
- Среди пациентов, достигших первичного ответа, ответ сохранялся у 74% больных на неделе 224-й. Медиана длительности первичного ответа не была достигнута.
- Около 65%, получавших руксолитиниб, завершили участие в исследовании в соответствии с протоколом, лишь 15% больных выбыли из исследования в связи с НЯ.
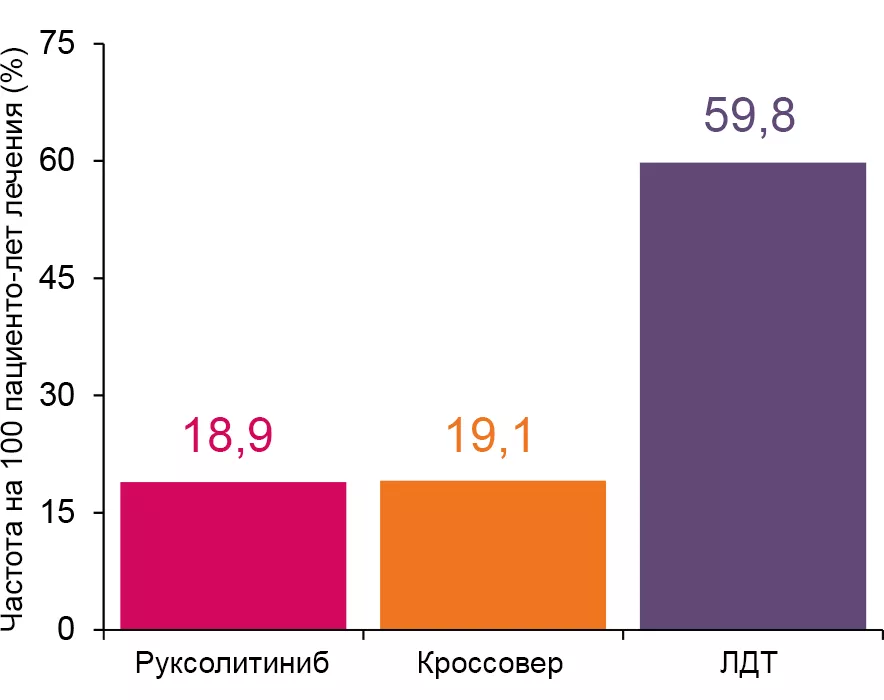
Гематологическая токсичность при длительном наблюдении3,10,11
Негематологическая токсичность при длительном наблюдении3,10,11
Выводы3,10,11
Эффективность
Среди пациентов с ИП, у которых развилась резистентность или непереносимость ГМ, руксолитиниб продемонстрировал преимущества перед ЛДТ в следующем:
- Контроль гематокрита без флеботомии.
- Индукция полной гематологической ремиссии.
- Уменьшение объема селезенки.
- Уменьшение выраженности симптомов.
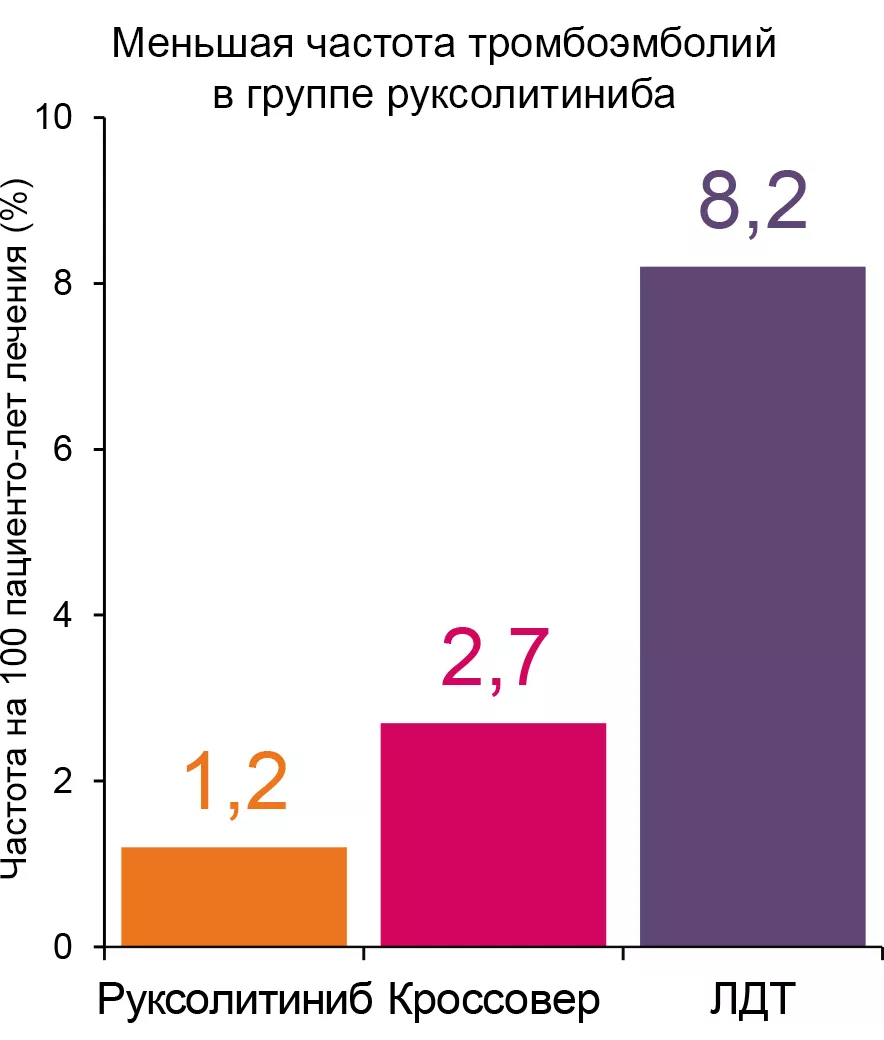
Ответ на руксолитиниб был длительным при низкой частоте тромбоэмболий.
Прогнозируемая пятилетняя ОВ составила 91,9% в группе руксолитиниба в сравнении с 91,0% в группе ЛДТ (ОР 0,95, 95% ДИ 0,38–2,41).
- Объединено с 86% (98/112) группы кроссовера на 32-й неделе или позднее.
Безопасность
Терапия руксолитинибом хорошо переносится:
- При длительном лечении руксолитинибом частота НЯ не увеличилась.
В сравнении с полученными ранее данными из исследования COMFORT (ПМФ).
- Среди пациентов с ИП отметили меньшую частоту цитопений.
Список литературы
- Jakafi Prescribing Information. Wilmington, DE: Incyte Corporation.
- Kiladjian J-J, Zachee P, Hino M, et al. Long-term efficacy and safety of ruxolitinib versus best available therapy in polycythaemia vera (RESPONSE): 5-year follow up of a phase 3 study [published online ahead of print January 23, 2020]. Lancet Haematol. doi.org/10.1016/S2352-3026(19)30207-8.
- Vannucchi AM, Kiladjian JJ, Griesshammer M, et al. Ruxolitinib versus standard therapy for the treatment of polycythemia vera. N Engl J Med. 2015;372(5):426-435.
- ОХЛП лекарственного препарата Джакави ЛП-№(0034004)-(РГ-RU) от 14.08.2024 2024-08-14_131_02001_SmPC_Jakavi_0007_v3.0_Rur.pdf
- Landgren O, et al. Blood. 2008;112:2199-204.
- NCT01243944. Available from: https://clinicaltrials.gov/ct2/show/NCT01243944
- Data on file. RESPONSE Protocol (CINC424B2301) 2014.
- Data on file. JAKAVI (ruxolitinib) Core Data Sheet: Version 2.2. October 2016. Novartis Pharma AG. Basel, Switzerland.
- Verstovsek S, et al. Poster presentation at ASH Annual Congress, 7-10 Dec 2019, [2947].
- Vannucchi, et al. Oral presentation at EHA Annual Congress; June 9-12, 2016. Abstract S454.
- Vannucchi AM, et al. Presentation at EHA 2014. Haematologica. 2014;99:abstract LB2436.
- Messa RA, et al. Leuk Res. 2009;33:1199-203.
- EORTC QLQ -C30 Scoring Manual. Available from: www.еоrtc.be/qol/files/SCManualQLQ-C30.pdf. Last updated 2001.
732635/JAK/webpage/10.23/0