Как выявить пациента с высоким риском развития иммуноопосредованных нежелательных явлений
Введение
Внедрение в клиническую практику иммуноонкологической терапии (ИТ) ингибиторами контрольных точек изменило подход к лечению меланомы, а также многих других видов злокачественных новообразований. Обладая способностью активировать опухолеспецифичный иммунный ответ, эти препараты могут привести к длительному контролю над опухолью. Однако подобная активация иммунной системы пациента может быть небезопасна и привести к развитию иммуноопосредованных нежелательных явлений (иоНЯ), одной из характерных особенностей которых является высокая частота (до 46%1) перехода в хроническую форму2.
Общая частота развития иоНЯ любой степени тяжести в исследованиях, включающих множественные типы солидных опухолей, составляет 72% для монотерапии анти-CTLA-4 препаратами3 и 66% для монотерапии анти-PD-1 препаратами4. В зависимости от первичного заболевания частота отдельных иоНЯ при ИТ может значительно варьироваться (например, при меланоме кожи диарея, зуд, сыпь и колит встречаются чаще, а пневмонит реже, чем при немелкоклеточном раке легких5), но в целом частота развития иоНЯ остается на указанном уровне2, 5.
Возможности по предотвращению иоНЯ весьма ограничены. В настоящее время не существует успешных стратегий их профилактики. В частности, нет убедительных доказательств профилактического использования стероидов или каких‑либо противовоспалительных препаратов у пациентов. Напротив, применение нестероидных противовоспалительных средств может спровоцировать развитие иоНЯ5.
Казалось бы, предсказать вероятность возникновения иоНЯ при проведении ИТ — сложная задача. Однако нельзя не заметить, что у некоторых пациентов иоНЯ развиваются чаще, чем в целом по популяции, что вероятно свидетельствует о существовании определенных факторов риска5.
Выявив пациентов с высоким риском развития иоНЯ, можно с особым вниманием подходить к выбору варианта лекарственной терапии у таких пациентов и тщательно взвешивать возможную пользу от нее и потенциальные риски. Особенно это важно в случае выбора адъювантной терапии после удаления меланомы кожи. Ведь в этом случае пациент чувствует себя здоровым, и развитие иоНЯ существенно ухудшает качество его жизни, возможно на очень продолжительный срок или даже навсегда. При этом для пациентов с BRAF+ меланомой кожи существует опция таргетной терапии6.
Итак, как выявить пациентов, для которых проведение ИТ связано с высоким риском развития иоНЯ?
Факторы, связанные с высоким риском развития иоНЯ
Существует ряд факторов или признаков, которые могут служить своеобразным сигналом тревоги о высокой вероятности иоНЯ. При этом чем больше таких факторов у одного пациента, тем выше риск5.

Как понять, насколько возрастает вероятность развития иоНЯ в случае обнаружения у пациента какого‑либо фактора риска? В научных исследованиях для сравнения рисков развития какого‑либо события обычно используют величину «отношение рисков» (ОР, на англ. — HR от hazard ratio). Если говорить упрощенно, то ОР показывает, во сколько раз риск развития иоНЯ выше у пациента с фактором риска, чем у пациента без такового7. Когда ниже мы будем обсуждать отдельные факторы риска, то будем приводить для каждого из них величину ОР, если такие данные имеются в литературе.
Факторы риска иоНЯ можно поделить на три основные группы5:
- Демографические и социальные факторы
- Заболевания в анамнезе
- Прием лекарственных препаратов
Рассмотрим их подробнее.
Демографические и социальные факторы
Вероятность развития иоНЯ может быть связана с полом, возрастом, функциональным статусом, вредными привычками (например, с курением) и даже с состоянием мышечной и жировой ткани5. В табл. 1 приведены основные демографические и социальные факторы риска развития иоНЯ.
Таблица 1. Основные демографические и социальные факторы риска развития иоНЯ у пациентов с меланомой кожи, получающих ИТ.
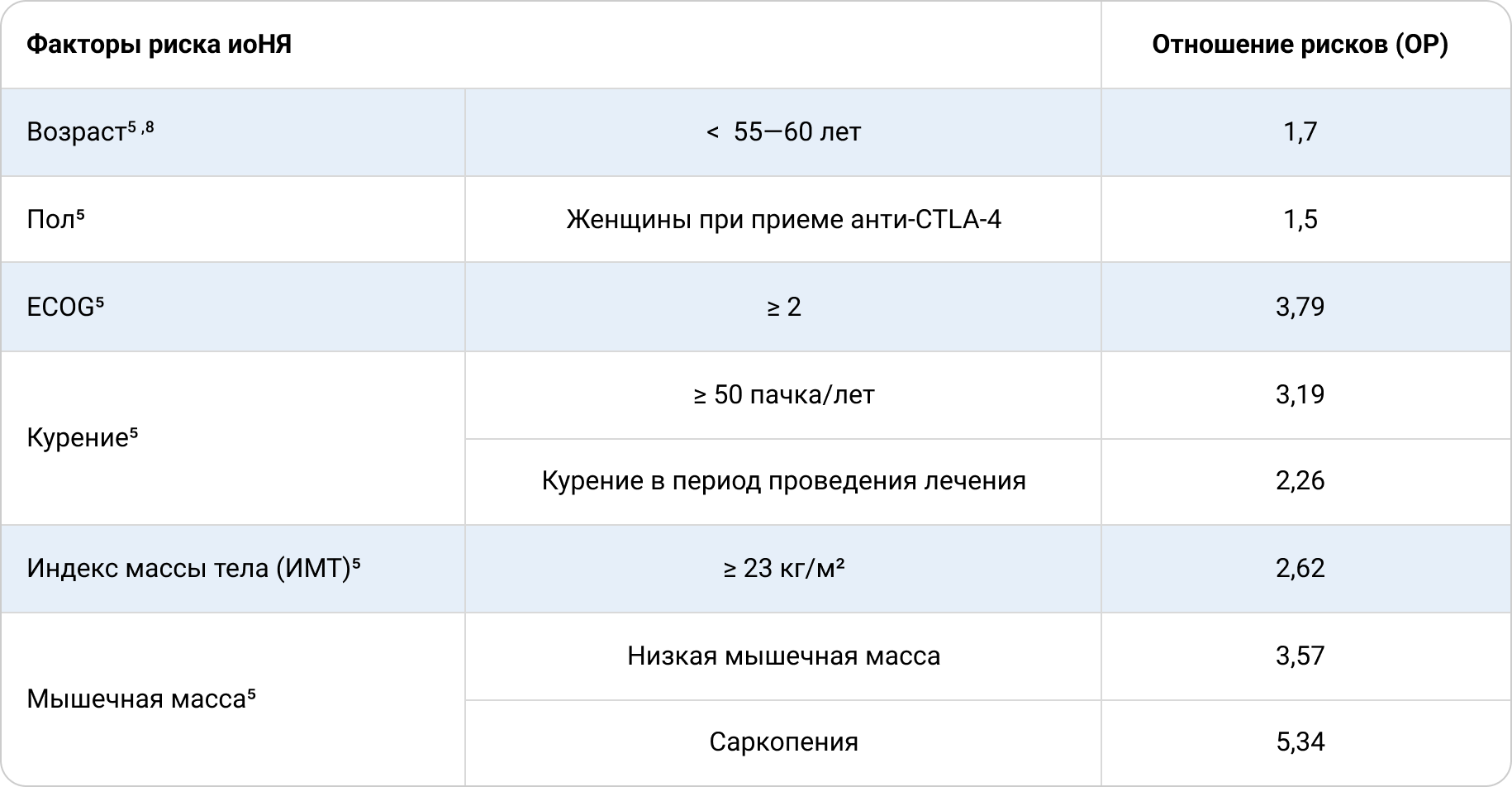
Справедливости ради необходимо отметить, что не все исследования подтверждают причинно-следственную связь рисков иоНЯ с приведенными в табл. 1 факторами5. Однако с учетом того, что в некоторых исследованиях такая связь установлена и подтверждена статистическими тестами5, у пациентов, находящихся в потенциальной группе риска по социальным и демографическим показателям, представляется полезным тщательно оценить возможную опасность от назначения ИТ и рассмотреть возможность применения другой группы лекарственных препаратов (например, ингибиторов BRAF/MEK при меланоме кожи с мутацией в гене BRAF).
Заболевания в анамнезе
У пациентов с хроническими заболеваниями в анамнезе каких‑либо органов или систем (хронические заболевания почек, сердца (сердечная недостаточность, ишемическая болезнь сердца, инфаркт миокарда, артериальная гипертензия) и легких (астма, фиброз легких и хроническая обструктивная болезнь легких)) выше риск развития соответствующих органоспецифических иоНЯ5.
Таблица 2. Заболевания, являющиеся факторами риска развития иоНЯ у пациентов с меланомой кожи, получающих ИТ.

Прием лекарственных препаратов
Отдельного внимания заслуживает влияние приема некоторых лекарственных препаратов на риск развития иоНЯ на фоне ИТ.
В большинстве случаев механизм этого влияния следующий: длительный прием определенных лекарственных препаратов приводит к нарушению функции некоторых органов, а затем при проведении ИТ именно эти органы становятся мишенями для развития иоНЯ5.
Например:
- Прием ингибиторов протонной помпы и нестероидных противовоспалительных препаратов сам по себе может привести к нарушению функции почек. А при проведении ИТ у пациентов, принимающих эти препараты, происходит ухудшение функции почек5.
- Препараты с кардиотоксическим эффектом (ингибиторы рецептора эпидермального фактора роста человека 2 (HER-2), фактора роста эндотелия сосудов (VEGF) и тирозинкиназы) увеличивают риск развития сердечно-сосудистых иоНЯ при проведении ИТ5.
Таблица 3. Прием лекарственных препаратов как фактор риска развития иоНЯ у пациентов с меланомой кожи, получающих ИТ.

Факторы риска развития органоспецифических иоНЯ
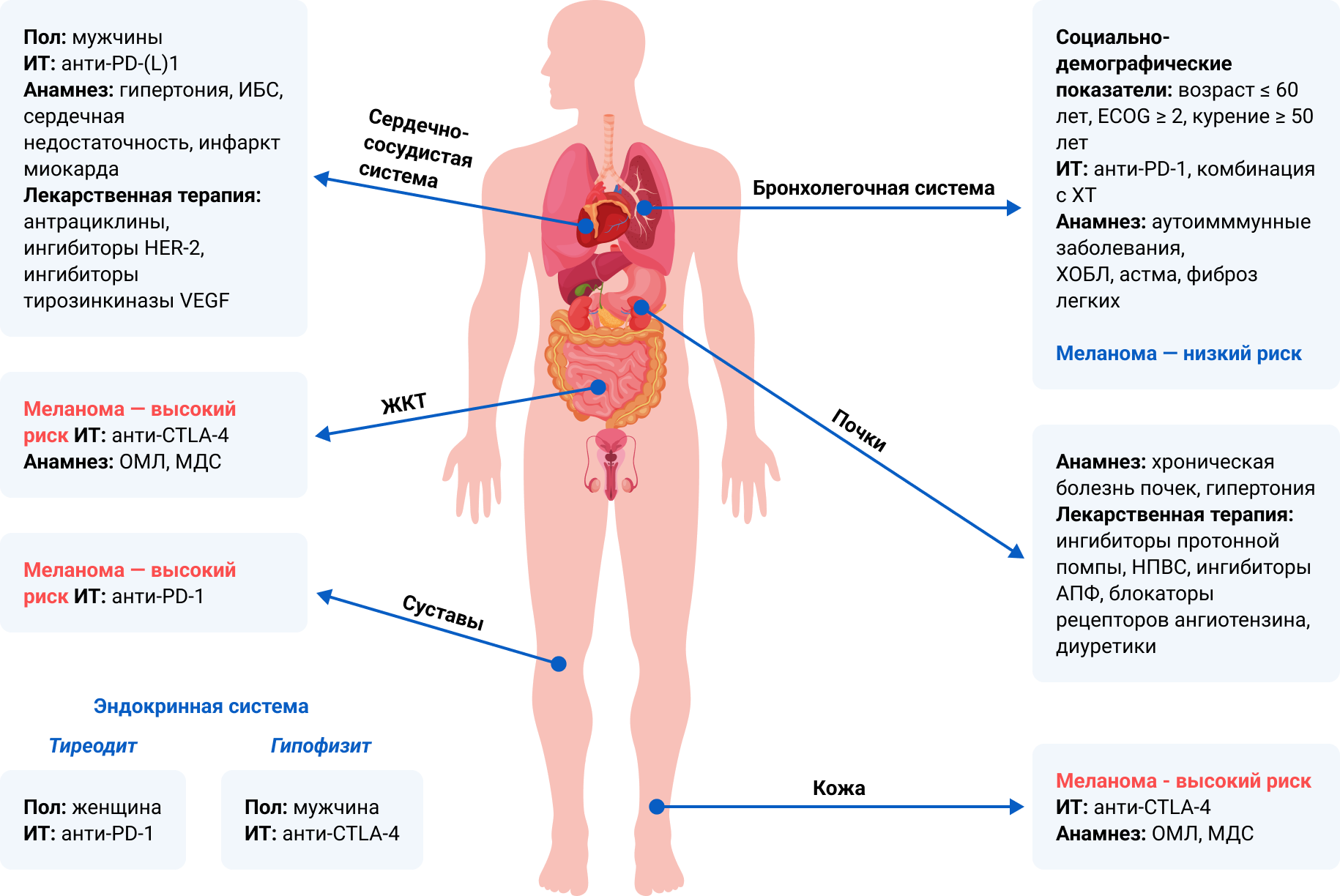
Для каждой группы иоНЯ, связанных с определенными системами органов, могут быть характерны свои факторы риска (рис. 1)5.
Рисунок 1. Факторы риска развития органоспецифических иоНЯ (адаптировано из Chennamadhavuni A. et al.5).
Биомаркеры, ассоциированные с высоким риском иоНЯ
За последние годы определено множество биомаркеров, изменение уровня которых ассоциировано с высоким риском иоНЯ. В этот список входят клетки крови, цитокины, аутоантитела, микроРНК, показатели экспрессии генов и сывороточные белки5. Большинство из указанных маркеров достаточно экзотичны, их не определяют в рутинной клинической практике, и они представляют скорее научный интерес.
Вместе с тем, среди них есть показатели, определение которых входит в стандартный клинический или биохимический анализ крови. Оценка уровня этих маркеров может помочь практикующему врачу в ответе на вопрос, связано ли назначение ИТ конкретному пациенту с повышенным риском развития иоНЯ5.
В различных исследованиях у пациентов, у которых впоследствии развились иоНЯ, были выявлены следующие изменения исходных показателей анализа крови:
Увеличение:
- количества лимфоцитов
(> 2,6 тыс/мкл)11, 12 - количества моноцитов
(> 0,29 тыс/мкл)11 - соотношения нейтрофилов
и лимфоцитов (> 2,3)9, 11 - уровня тиреотропного гормона16—18
- количества эозинофилов
(> 125 тыс/мкл)13 - количества тромбоцитов
(> 146 тыс/мкл)11 - уровня альбумина14, 15
Снижение:
- соотношения тромбоцитов и лимфоцитов (< 180—200)9, 12
Если лечение (ИТ) уже начато, также существуют способы с большой вероятностью предсказать развитие иоНЯ в ближайшее время по изменению в процессе лечения некоторых показателей анализа крови:
Увеличение в процессе лечения по сравнению с исходным уровнем:
- гранулоцитарного колониестимулирующего фактора (Г-КСФ)14
- С-реактивного белка19
Снижение в процессе лечения по сравнению с исходным уровнем:
- лейкоцитов20
- лимфоцитов20
- гамма-интерферона21
Количественное изменение параметров может варьировать от исследования к исследованию5, 9, 11—21, но важно определить, есть ли в принципе у пациента тенденция к изменению (повышение/понижение) указанных показателей анализа крови — даже небольшое отклонение от нормы может быть предвестником развития иоНЯ.
Простые шаги для определения риска иоНЯ
Для выявления пациентов с высоким риском иоНЯ не обязательно проводить сложные дорогостоящие анализы. Достаточно выполнить несколько простых шагов, которые не займут много времени:
Наличие у пациента нескольких факторов риска развития иоНЯ — повод задуматься о соотношении польза-риск от назначения ИТ для такого пациента, особенно когда есть не менее эффективные, но более безопасные опции лечения.
Список сокращений
АПФ — ангиотензинпревращающий фермент;
ИМТ — индекс массы тела;
иоНЯ — иммуноопосредованные нежелательные явления;
ИБС — ишемическая болезнь сердца;
ИТ — иммуноонкологическая терапия;
МДС — миелодиспластический синдром;
НПВС — нестероидные противовоспалительные средства;
ОМЛ — острый миелобластный лейкоз;
ТТ — таргетная терапия;
ХОБЛ — хроническая обструктивная болезнь легких;
ХТ — химиотерапия.
Список литературы
- Goodman R. S. et al. Long-term outcomes of chronic immune-related adverse events from adjuvant anti-PD-1 therapy for high-risk resected melanoma. – 2023.
- Kennedy L. B., Salama A. K. S. A review of immune-mediated adverse events in melanoma // Oncology and Therapy. – 2019. – Т. 7. – №. 2. – С. 101-120.
- Bertrand A. et al. Immune related adverse events associated with anti-CTLA-4 antibodies: systematic review and meta-analysis // BMC medicine. – 2015. – Т. 13. – С. 1-14.
- Wang Y. et al. Treatment-related adverse events of PD-1 and PD-L1 inhibitors in clinical trials: a systematic review and meta-analysis // JAMA oncology. – 2019. – Т. 5. – №. 7. – С. 1008-1019.
- Chennamadhavuni A. et al. Risk factors and biomarkers for immune-related adverse events: a practical guide to identifying high-risk patients and rechallenging immune checkpoint inhibitors // Frontiers in immunology. – 2022. – Т. 13. – С. 779691.
- Клинические рекомендации Министерства здравоохранения РФ “Меланома кожи и слизистых оболочек (взрослые)” (дата обращения к сайту https://cr.minzdrav.gov.ru/schema/546_3 5 июля 2024 г.).
- Реброва О. Ю. Клинические исследования: показатели эффективности медицинских технологий, влияющих на время до изучаемого события // Медицинские технологии. Оценка и выбор. – 2012. – №. 2 (8). – С. 10-15.
- Zhang Z. et al. Incidence and severity of immune-related hepatitis after dual checkpoint therapy is linked to younger age independent of herpes virus immunity // Journal of translational medicine. – 2022. – Т. 20. – №. 1. – С. 582.
- Kartolo A. et al. Predictors of immunotherapy-induced immune-related adverse events // Current Oncology. – 2018. – Т. 25. – №. 5. – С. 403-410.
- Romanski N. A. et al. Characterization of risk factors and efficacy of medical management of immune-related hepatotoxicity in real-world patients with metastatic melanoma treated with immune checkpoint inhibitors // European Journal of Cancer. – 2020. – Т. 130. – С. 211-218.
- Michailidou D. et al. Association of blood biomarkers and autoimmunity with immune related adverse events in patients with cancer treated with immune checkpoint inhibitors // Scientific reports. – 2021. – Т. 11. – №. 1. – С. 9029.
- Manne A. et al. Clinical and hematological predictors of high-grade immune-related adverse events associated with immune checkpoint inhibitors //Journal of Clinical Medicine Research. – 2021. – Т. 13. – №. 5. – С. 268.
- Nakamura Y. et al. Correlation between blood cell count and outcome of melanoma patients treated with anti-PD-1 antibodies //Japanese journal of clinical oncology. – 2019. – Т. 49. – №. 5. – С. 431-437.
- Oyanagi J. et al. Predictive value of serum protein levels in patients with advanced non-small cell lung cancer treated with nivolumab // Lung Cancer. – 2019. – Т. 132. – С. 107-113.
- Shimozaki K. et al. Analysis of risk factors for immune-related adverse events in various solid tumors using real-world data // Future Oncology. – 2021. – Т. 17. – №. 20. – С. 2593-2603.
- Yoon J. H. et al. Characteristics of immune-related thyroid adverse events in patients treated with PD-1/PD-L1 inhibitors // Endocrinology and Metabolism. – 2021. – Т. 36. – №. 2. – С. 413-423.
- Luongo C. et al. Higher baseline TSH levels predict early hypothyroidism during cancer immunotherapy // Journal of Endocrinological Investigation. – 2021. – Т. 44. – С. 1927-1933.
- Brilli L. et al. Baseline serum TSH levels predict the absence of thyroid dysfunction in cancer patients treated with immunotherapy // Journal of Endocrinological Investigation. – 2021. – С. 1-8.
- Abolhassani A. R. et al. C-reactive protein as an early marker of immune-related adverse events // Journal of Cancer Research and Clinical Oncology. – 2019. – Т. 145. – С. 2625-2631.
- Fujisawa Y. et al. Fluctuations in routine blood count might signal severe immune-related adverse events in melanoma patients treated with nivolumab // Journal of Dermatological Science. – 2017. – Т. 88. – №. 2. – С. 225-231.
- Hirashima T. et al. The levels of interferon-gamma release as a biomarker for non-small-cell lung cancer patients receiving immune checkpoint inhibitors // Anticancer research. – 2019. – Т. 39. – №. 11. – С. 6231-6240.
11301866/ONCO/DIG/10.24/0