Острый миелоидный лейкоз
Острый миелоидный лейкоз (ОМЛ) — клональное опухлевое заболевание, связанное с мутацией в клетке-предшественнице гемопоэза, следствием которой становятся блок дифференцировки и бесконтрольная пролиферация незрелых миелоидных клеток1.
Точные причины возникновения ОМЛ неизвестны, считается, что заболевание развивается при сочетании определенных факторов. К немодифицируемым факторам риска развития заболевания относятся генетические особенности, возраст старше 65 лет, мужской пол. Среди модифицируемых факторов риска строгая взаимосвязь с развитием ОМЛ показана для курения, контакта с рядом химических веществ, действия ионизирующего излучения, в том числе при лечении онкологических заболеваний2–4.
Классификация заболевания
Согласно классификации Всемирной организации здравоохранения (ВОЗ) 2016 года выделяют следующие категории ОМЛ5:
Мутации в гене fms-связанной тирозинкиназы 3 (fms-related tyrosine kinase, FLT3) могут проводить к повышенной пролиферации опухолевых клеток и их устойчивости к апоптозу. Несмотря на то, что ОМЛ с мутациями FLT3 (FLT3+) не рассматривается как отдельная категория, скрининг этих мутаций имеет прогностическую значимость. Мутации в гене FLT3 присутствуют примерно у 30% пациентов с впервые выявленным ОМЛ. У большей части пациентов обнаруживается мутация внутреннего тандемного дублирования (ITD), ассоциированная с неблагоприятным прогнозом заболевания и высокой частотой рецидивов, особенно при высоком соотношении (> 0,5) мутантного аллеля и аллеля дикого типа. У части пациентов обнаруживается точечная мутация в домене тирозинкиназы (TKD)6.

Однако прогностическое значение мутаций FLT3-TKD полностью не изучено, так как в ряде случаев у пациентов с такими мутациями наблюдается более низкая кумулятивная частота рецидивов, более высокие уровни безрецидивной выживаемости и общей выживаемости8, в связи с чем влияние данной мутации обсуждается.
Диагностика заболевания
Для подтверждения диагноза ОМЛ рекомендовано проведение следующих лабораторных исследований1,9:
- общий (клинический) развернутый анализ крови;
- цитологическое исследование мазка костного мозга (миелограмма);
- иммунофенотипирование гемопоэтических клеток-предшественниц в костном мозге (ИФТ-исследование);
- цитогенетическое исследование кариотипа аспирата костного мозга;
- скрининг мутаций в генах, ассоциированных с ОМЛ.
Методы лечения ОМЛ
Выбор оптимальной тактики лечения ОМЛ зависит от индивидуальной клинической картины заболевания у пациента. На сегодняшний день главный принцип терапии ОМЛ — максимально эффективное лечение с минимальными нежелательными последствиями для пациента. Эффективность и безопасность терапии ОМЛ зависят от специфичности цитостатического воздействия и достаточного сопроводительного лечения.
Терапия ОМЛ состоит из нескольких этапов1,5,9:

Индукция ремиссии — начальный период лечения, целью которого является максимально быстрое и существенное сокращение опухолевой массы и достижение полной ремиссии.
Консолидация ремиссии — Вторым этапом терапии острого лейкоза (ОЛ) является закрепление достигнутого противоопухолевого эффекта (обычно 1–2 курса). В настоящее время в большинстве случаев консолидация – наиболее агрессивный и высокодозный этап при лечении ОЛ. Задачей этого периода является по возможности еще большее уменьшение числа остающихся после индукции лейкемических клеток1.
Поддерживающее лечение — продолжение цитостатического воздействия в меньших дозах, чем в период индукции/консолидации ремиссии, или иного (таргетного) воздействия на возможно остающийся опухолевый клон1.
Профилактика нейролейкемии необходима при лечении некоторых вариантов ОМЛ — промиелоцитарного с лейкоцитозом > 10 × 109/л, миеломоно- и монобластного, ОМЛ с экстрамедуллярными поражениями, ОМЛ с инициальным лейкоцитозом 30 × 109/л и более. Профилактика нейролейкемии проводится на всех этапах лечения ОМЛ, начиная с индукции ремиссии.
Пациентам групп высокого и промежуточного риска, пациентам с нормальным кариотипом и неблагоприятными молекулярными маркерами рекомендовано проведение аллогенной трансплантации костного мозга (алло-ТКМ) или трансплантации аллогенных гемопоэтических стволовых клеток (алло-ТГСК) на этапе постремиссионной терапии. Пациентам группы благоприятного прогноза также рекомендовано проведение алло-ТКМ/алло-ТГСК при недостижении постоянной ремиссии после 1-го курса индукции1,10.
На рисунках 3 и 4 представлены обобщающие схемы рекомендуемого лечения ОМЛ у разных возрастных групп пациентов в соответствии с клиническими рекомендациями Ассоциации онкологов России и Национального гематологического общества 2020 года1.
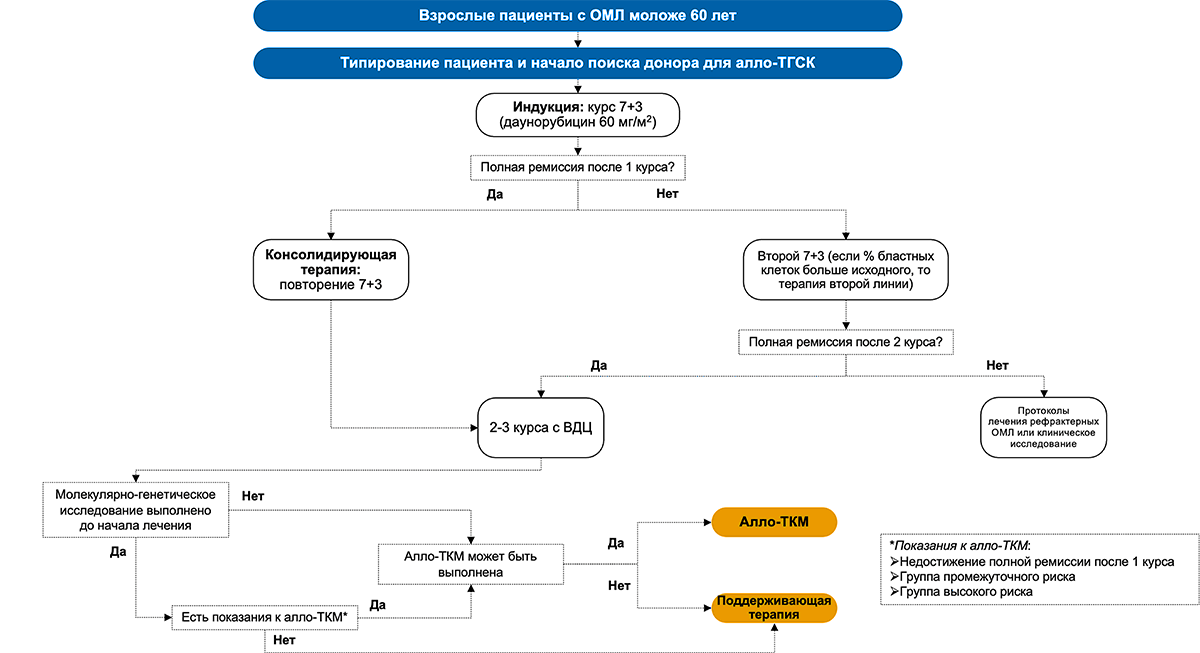
Рисунок 3. Схема лечения ОМЛ у пациентов возрастом до 60 лет
Примечание.
Курс 7 + 3:
1) цитарабин 100 мг/м2 в/в 2 раза в сутки в 1–7-й дни в комбинации с даунорубицином 60 мг/м2 в/в 1 раз в день в 1–3-й дни или митоксантроном 10 мг/м2 в/в 1 раз в день в 1–3-й дни или идарубицином 12 мг/м2 в/в 1 раз в день в 1–3-й дни;
2) цитарабин 200 мг/м2 в/в круглосуточно в 1–7-й дни в комбинации с даунорубицином 60 мг/м2 в/в 1 раз в день в 3–5-й дни или митоксантроном 10 мг/м2 в/в 1 раз в день в 3–5-й дни или идарубицином 12 мг/м2 в/в 1 раз в день в 3–5-й дни.
ВДЦ — высокие дозы цитарабина.
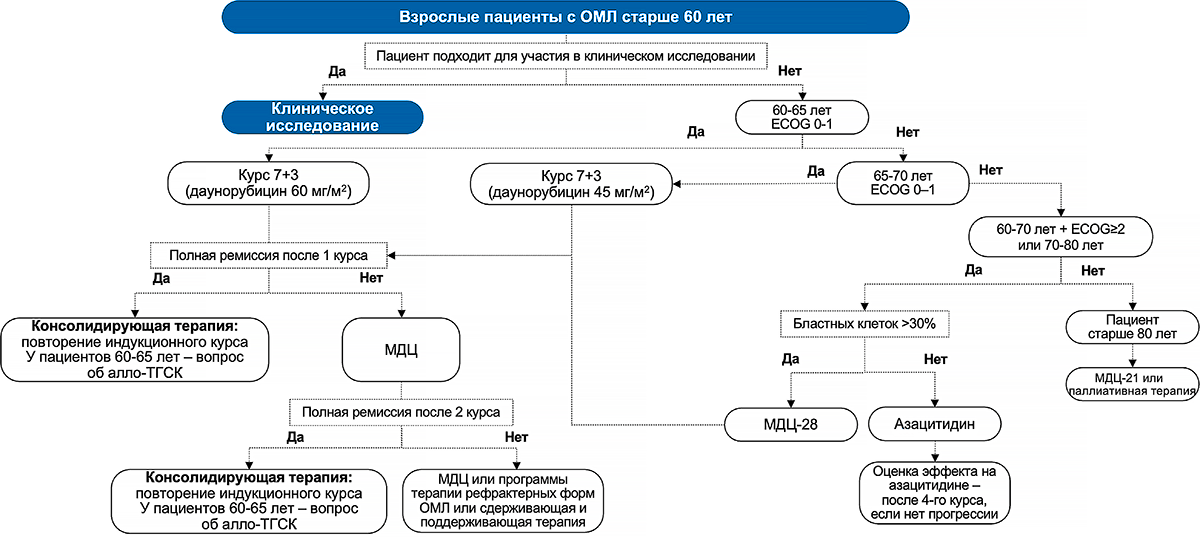
Рисунок 4. Схема лечения ОМЛ у пациентов старше 60 лет
Примечание.
ECOG — Шкала оценки общего состояния пациента Восточной объединенной онкологической группы (The ECOG Scale of Performance Status); МДЦ — малые дозы цитарабина.
Список литературы
- Острые миелоидные лейкозы. Клинические рекомендации Ассоциации онкологов России и Национального гематологического общества. (2020).
- Juliusson G. et al. Prevalence and characteristics of survivors from acute myeloid leukemia in Sweden. Leukemia 31, (2017).
- Shallis R.M., Wang R., Davidoff A., Ma X. & Zeidan A.M. Epidemiology of acute myeloid leukemia: Recent progress and enduring challenges. Blood Reviews 36, (2019).
- Granfeldt Østgård L.S. et al. Epidemiology and Clinical Significance of Secondary and Therapy-Related Acute Myeloid Leukemia: A National Population-Based Cohort Study. Journal of Clinical Oncology 33, (2015).
- Arber D.A. et al. The 2016 revision to the World Health Organization classification of myeloid neoplasms and acute leukemia. Blood 127, (2016).
- Stone R.M. et al. Midostaurin plus Chemotherapy for Acute Myeloid Leukemia with a FLT3 Mutation. New England Journal of Medicine 377, (2017).
- Whitman S.P. et al. FLT3 D835/I836 mutations are associated with poor disease-free survival and a distinct gene-expression signature among younger adults with de novo cytogenetically normal acute myeloid leukemia lacking FLT3 internal tandem duplications. Blood 111, 1552–1559 (2008).
- Mead A. et al. FLT3 tyrosine kinase domain mutations are biologically distinct from and have a significantly more favorable prognosis than FLT3 internal tandem duplications in patients with acute myeloid leukemia. Blood 110, 1262–1270 (2007).
- Döhner H. et al. Diagnosis and management of AML in adults: 2017 ELN recommendations from an international expert panel. Blood 129, (2017).
- Heuser M. et al. Acute myeloid leukaemia in adult patients: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Annals of Oncology 31, (2020).
11213597/RYD/WEB/062024/1