
Фокус на сравнении профилей безопасности таргетной и иммунной адъювантной терапии меланомы кожи

После выполнения радикального хирургического лечения меланомы кожи пациент считает себя практически здоровым, чувствует себя удовлетворительно. Принимая решение о назначении адъювантной терапии (АТ), следует учитывать важность сохранения качества жизни пациента в этот период [1]. Адъювантная терапия должна иметь приемлемый профиль безопасности и не должна вызывать тяжелые и/или необратимые нежелательные явления (НЯ), переходящие в хроническую форму и требующие продолжительной или пожизненной лекарственной терапии.
Сравнение безопасности разных стратегий адъювантной терапии меланомы кожи
Исследования, которые напрямую сравнивали бы безопасность применения иммунной и таргетной терапии в качестве АТ меланомы кожи, не проводились. Профили безопасности данных видов лечения можно сопоставить, оценив данные соответствующих исследований:
CheckMate 238
- Ниволумаб (452 пациента)
- Группа сравнения: ипилимумаб
- Стадии меланомы IIIB-C, IV
- 41% пациентов с BRAF+ меланомой кожи
KEYNOTE-054
- Пембролизумаб (509 пациентов)
- Группа сравнения: плацебо
- Стадии меланомы IIIА-C
- 41% пациентов с BRAF+ меланомой кожи
COMBI-AD
- Дабрафениб + траметиниб (435 пациентов)
- Группа сравнения: плацебо
- Стадии меланомы IIIА-C
- 100% пациентов с BRAF+ меланомой кожи
COMBI-APlus (исследование эффективности адаптированного алгоритма управления пирексией)
- Дабрафениб + траметиниб (552 пациента)
- Группа сравнения: исторический контроль исследования COMBI-AD
- Стадии меланомы IIIA-D (AJCC 8)
- 100% пациентов с BRAF+ меланомой кожи
Частота развития любых НЯ в период проведения адъювантной терапии в целом была сопоставима во всех рассматриваемых исследованиях (93,3–98,0%) [2–5]. Общими НЯ всех выбранных вариантов АТ являлись повышенная утомляемость, диарея, сыпь, тошнота любой степени. Частота их развития, по данным последних исследований, достигала 37%, однако НЯ 3-й степени тяжести и выше развивались не более чем у 1,5% пациентов [2,3,5].
Рассмотрим более подробно НЯ, характерные для каждого варианта адъювантной терапии.
Адъювантная иммунотерапия
Основные осложнения адъювантной иммунотерапии меланомы кожи связаны с развитием иммуноопосредованных НЯ (иоНЯ), их частым переходом в хроническую форму и необходимостью длительного применения глюкокортикостероидов или другой терапии (например, гормонозаместительной при эндокринопатиях) [3,6].
Иммуноопосредованные НЯ
Препараты пембролизумаб и ниволумаб, созданные на основе моноклональных антител, могут вызывать иммуноопосредованные нежелательные явления.
Согласно данным исследования KEYNOTE-054, на фоне приема пембролизумаба с высокой частотой развивались иоНЯ, в первую очередь эндокринные нарушения [3].

Оценка частоты развития впервые выявленных эндокринных нарушений на фоне адъювантной иммунотерапии показала схожие результаты для ниволумаба [2] и пембролизумаба [3,7,8].
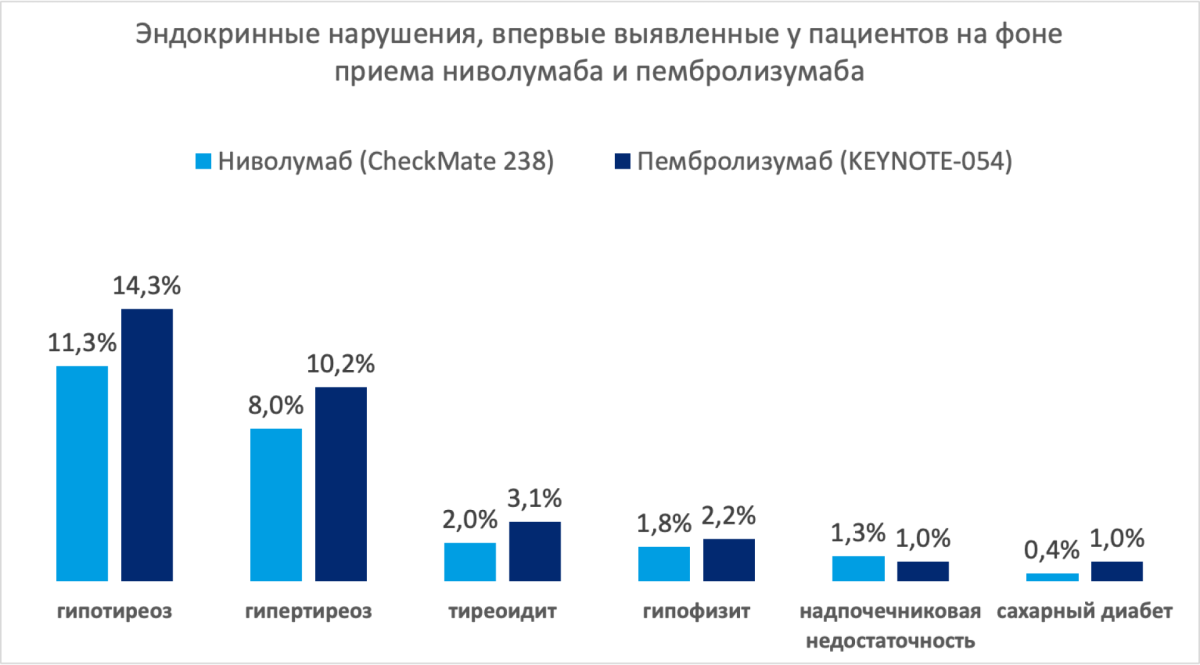
Среди других НЯ, развитие которых, по мнению некоторых исследователей, могло быть связано с действием на иммунную систему, следует выделить [2,3]:
- пневмонит (ниволумаб — 1,3%, пембролизумаб — 3,3%);
- парестезии (ниволумаб — 2,7%);
- периферическую невропатию (ниволумаб — 0,4%);
- аксональную невропатию (ниволумаб — 0,2%).
Кроме того, стали чаще появляться сообщения о случаях такого тяжелого иоНЯ, как аутоиммунный миокардит. Летальность при данном осложнении достигает более 50% и требует тщательного наблюдения за пациентом и слаженной работы врачей разных специализаций [18].
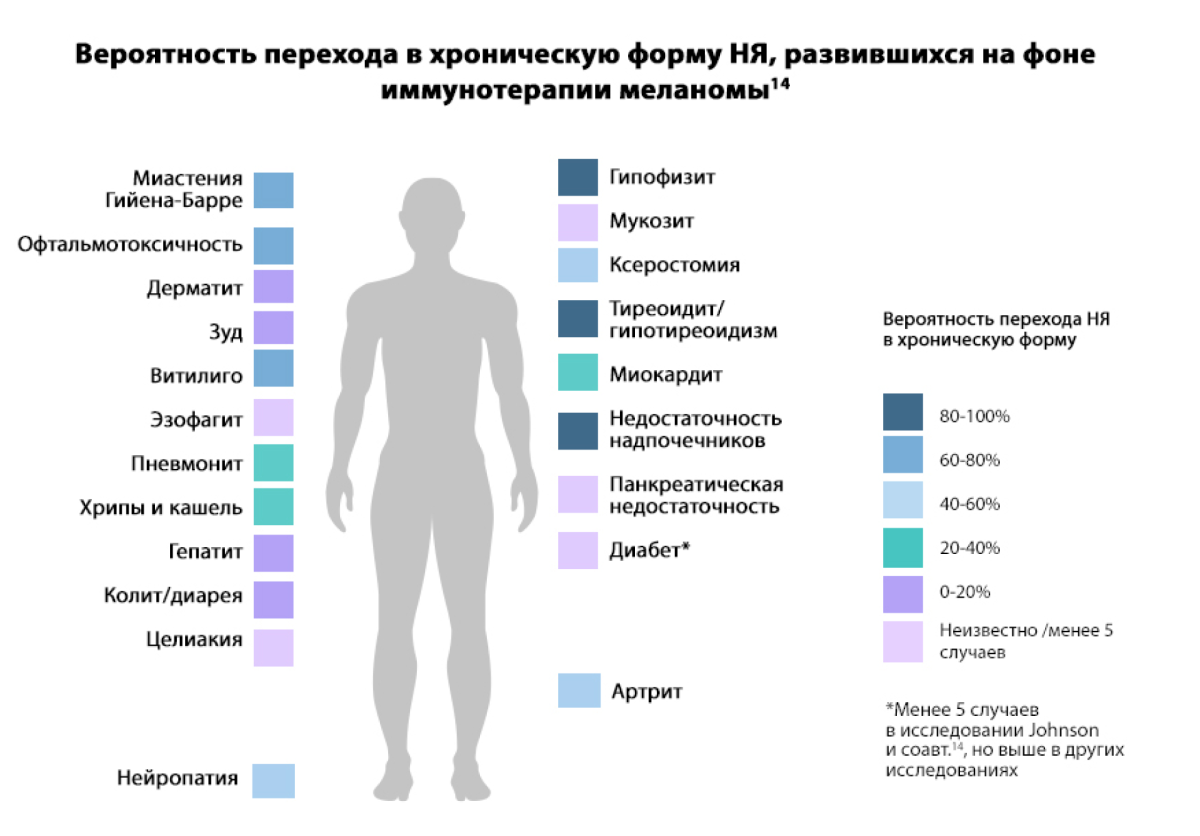
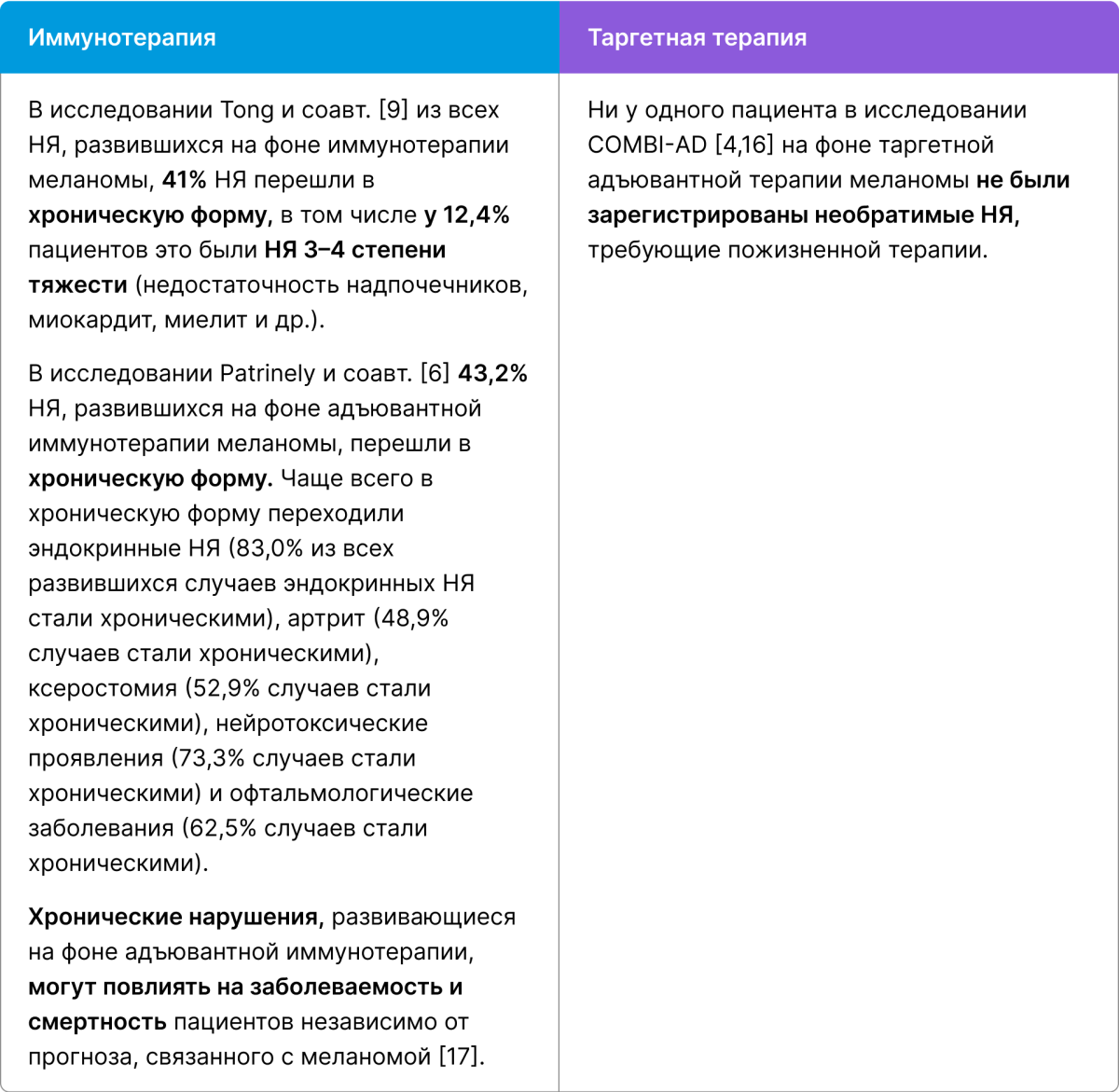
Переход НЯ в хроническую форму
По данным ряда исследований, частота развития хронических НЯ у пациентов на фоне иммунотерапии составила 41–43%, в том числе 12% случаев — 3–4-й степени тяжести. Большинство хронических НЯ были связаны с эндокринными нарушениями (чаще всего гипотиреоз и гипертиреоз), заболеваниями опорно-двигательного аппарата (чаще всего артрит и артралгия), кожными заболеваниями (дерматит) [6,9].
Лекарственная терапия развившихся НЯ
31–49% пациентов из-за НЯ, развившихся на фоне иммунотерапии, потребовалась терапия глюкокортикостероидами [10,11].
Адъювантная таргетная терапия
Основным НЯ при проведении адъювантной терапии комбинацией дабрафениб + траметиниб является лихорадка (пирексия). Согласно данным исследования COMBI-AD, пирексия любой степени тяжести развилась у 63% пациентов, принимавших комбинацию дабрафениб + траметиниб, и явилась причиной прекращения лечения у 8,7% пациентов [4].
В исследовании COMBI-APlus алгоритм управления пирексией был пересмотрен (подробнее о новом алгоритме в статье «COMBI-APlus: новый алгоритм управления пирексией улучшает показатели безопасности и эффективности комбинации дабрафениб + траметиниб»), и это позволило, при той же частоте развития пирексии любой степени тяжести, в несколько раз снизить частоту осложнений, связанных с пирексией [12].
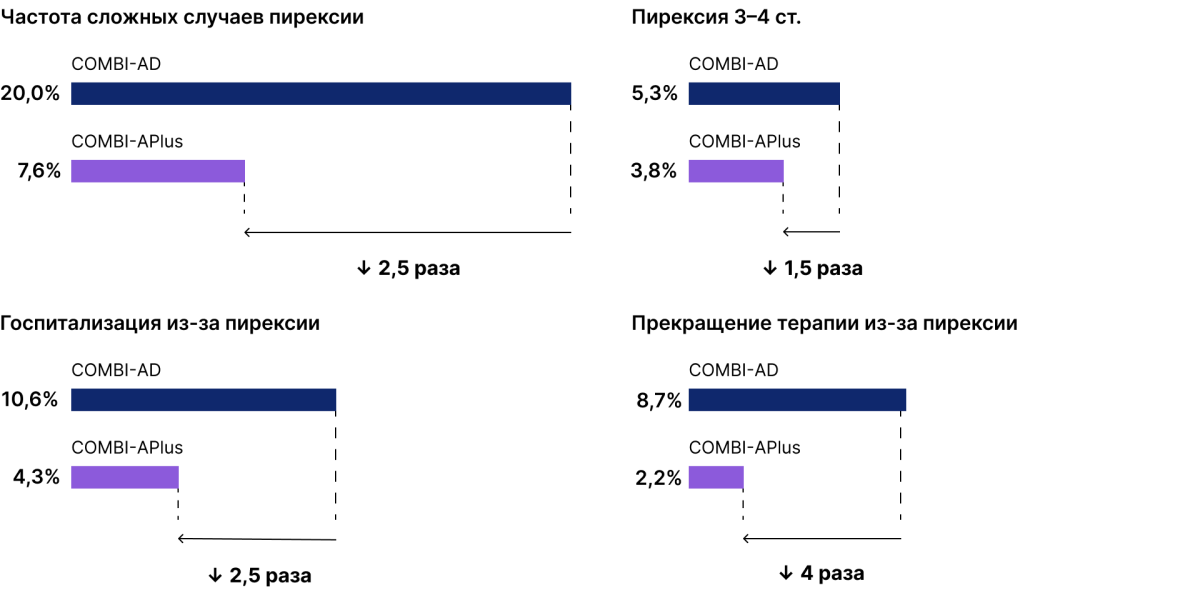
Применение нового алгоритма управления пирексией позволило при сопоставимых значениях средней продолжительности воздействия дабрафениба и траметиниба (11 месяцев в обоих исследованиях: COMBI-AD и COMBI-APlus) снизить количество перерывов в лечении, связанных с пирексией, и сократить число случаев вынужденного снижения дозы дабрафениба и/или траметиниба [5].
Разберем основные вопросы, возникающие при сравнении профилей безопасности таргетной и иммунотерапии:
Каково среднее время разрешения НЯ?
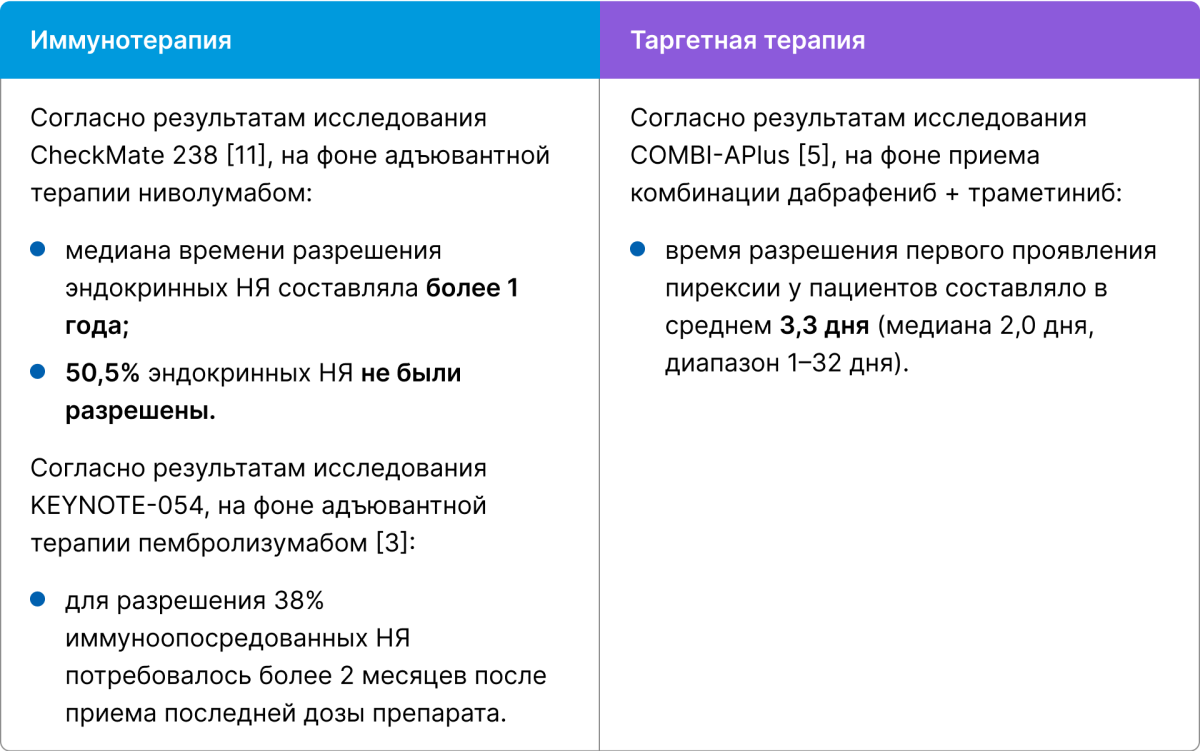
Какую дополнительную лекарственную терапию придется назначить пациенту для разрешения НЯ?

Обратимы ли развивающиеся НЯ?
Список литературы
- Atkinson T.M., Hay J.L., Young Kim S. et al. Decision-Making and Health-Related Quality of Life in Patients with Melanoma Considering Adjuvant Immunotherapy. Oncologist. 2023 Feb 6:oyac266. Doi: 10.1093/oncolo/oyac266. Epub ahead of print. PMID: 36745014.
- Weber J., Mandala M., Del Vecchio M. et al. CheckMate 238 Collaborators. Adjuvant Nivolumab versus Ipilimumab in Resected Stage III or IV Melanoma. N Engl J Med. 2017 Nov 9;377(19):1824-1835. Doi: 10.1056/NEJMoa1709030. Epub 2017 Sep 10. PMID: 28891423.
- Eggermont A.M.M., Blank C.U., Mandala M. et al. Adjuvant Pembrolizumab versus Placebo in Resected Stage III Melanoma. N Engl J Med. 2018 May 10;378(19):1789-1801. Doi: 10.1056/NEJMoa1802357. Epub 2018 Apr 15. PMID: 29658430.
- Long G.V., Hauschild A., Santinami M. et al. Adjuvant Dabrafenib plus Trametinib in Stage III BRAF-Mutated Melanoma. N Engl J Med. 2017 Nov 9;377(19):1813-1823. Doi: 10.1056/NEJMoa1708539. Epub 2017 Sep 10. PMID: 28891408.
- Atkinson V., Robert C., Grob J.J. et al. Improved pyrexia-related outcomes associated with an adapted pyrexia adverse event management algorithm in patients treated with adjuvant dabrafenib plus trametinib: Primary results of COMBI-Aplus. Eur J Cancer. 2022 Mar;163:79-87. Doi: 10.1016/j.ejca.2021.12.015. Epub 2022 Jan 14. PMID: 35042070.
- Patrinely J.R. Jr, Johnson R., Lawless A.R. et al. Chronic Immune-Related Adverse Events Following Adjuvant Anti-PD-1 Therapy for High-risk Resected Melanoma. JAMA Oncol. 2021 May 1;7(5):744-748. doi: 10.1001/jamaoncol.2021.0051. Erratum in: JAMA Oncol. 2021 May 1;7(5):785. PMID: 33764387; PMCID: PMC7995124.
- Eggermont A.M.M., Kicinski M., Blank C.U. et al. Association Between Immune-Related Adverse Events and Recurrence-Free Survival Among Patients With Stage III Melanoma Randomized to Receive Pembrolizumab or Placebo: A Secondary Analysis of a Randomized Clinical Trial. JAMA Oncol. 2020 Apr 1;6(4):519-527. Doi: 10.1001/jamaoncol.2019.5570. PMID: 31895407; PMCID: PMC6990933.
- Eggermont A.M.M., Blank C.U., Mandala M. et al. Longer Follow-Up Confirms Recurrence-Free Survival Benefit of Adjuvant Pembrolizumab in High-Risk Stage III Melanoma: Updated Results From the EORTC 1325-MG/KEYNOTE-054 Trial. J Clin Oncol. 2020 Nov 20;38(33):3925-3936. Doi: 10.1200/JCO.20.02110. Epub 2020 Sep 18. PMID: 32946353; PMCID: PMC7676886.
- Tong J., Kartolo A., Yeung C., Hopman W., Baetz T. Long-Term Toxicities of Immune Checkpoint Inhibitor (ICI) in Melanoma Patients. Curr Oncol. 2022 Oct 20;29(10):7953-7963. doi: 10.3390/curroncol29100629. PMID: 36290906; PMCID: PMC9600354.
- O'Reilly A., Hughes P., Mann J. et al. An immunotherapy survivor population: health-related quality of life and toxicity in patients with metastatic melanoma treated with immune checkpoint inhibitors. Support Care Cancer. 2020 Feb;28(2):561-570. doi: 10.1007/s00520-019-04818-w. Epub 2019 May 14. PMID: 31089820; PMCID: PMC6954131.
- Mandala M., Larkin J., Ascierto P.A. et al. Adjuvant nivolumab for stage III/IV melanoma: evaluation of safety outcomes and association with recurrence-free survival. J Immunother Cancer. 2021 Aug;9(8):e003188. Doi: 10.1136/jitc-2021-003188. Erratum in: J Immunother Cancer. 2021 Nov;9(11): PMID: 34452930; PMCID: PMC8404438.
- M. Del Vecchio et al. Updated toxicity profile and relapse-free survival outcomes using an adapted pyrexia management algorithm in patients with resected stageIII BRAF V600E/K-mutant melanoma treated with adjuvant dabrafenib plus trametinib in COMBI-APlus // #806P Presented at ESMO 2022.
- Buchman A.L. Side effects of corticosteroid therapy. J Clin Gastroenterol. 2001 Oct;33(4):289-94. doi: 10.1097/00004836-200110000-00006. PMID: 11588541.
- Johnson D.B., Nebhan C.A., Moslehi J.J., Balko J.M. Immune-checkpoint inhibitors: long-term implications of toxicity. Nat Rev Clin Oncol. 2022 Apr;19(4):254-267. doi: 10.1038/s41571-022-00600-w. Epub 2022 Jan 26. PMID: 35082367; PMCID: PMC8790946.
- Bai X. et al. Early use of high-dose glucocorticoid for the management of irAE is associated with poorer survival in patients with advanced melanoma treated with anti-PD-1 monotherapy. Clin. Cancer Res. 2021;27:5993–6000.
- Dummer R., Hauschild A., Santinami M. et al. Five-Year Analysis of Adjuvant Dabrafenib plus Trametinib in Stage III Melanoma. N Engl J Med. 2020 Sep 17;383(12):1139-1148. doi: 10.1056/NEJMoa2005493. Epub 2020 Sep 2. PMID: 32877599.
- Lao C.D., Khushalani N.I., Angeles C., Petrella T.M. Current State of Adjuvant Therapy for Melanoma: Less Is More, or More Is Better? Am Soc Clin Oncol Educ Book. 2022 Apr;42:1-7. doi: 10.1200/EDBK_351153. PMID: 35658502.
- Makunts T. et al. Myocarditis occurrence with cancer immunotherapy across indications in clinical trial and post-marketing data //Scientific reports. – 2021. – Т. 11. – №. 1. – С. 17324.
11235394/ONCO/DIG/07.24/0
