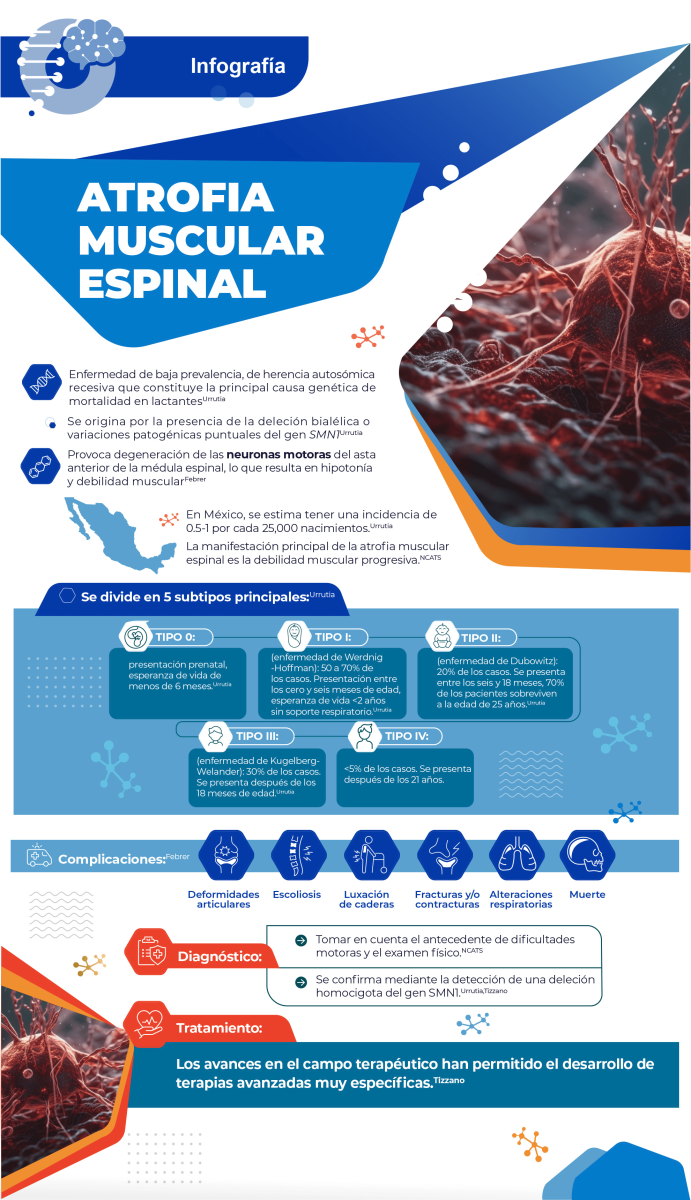
Atrofia muscular espinal
Atrofia muscular espinal: síntomas, tratamientos, diagnóstico
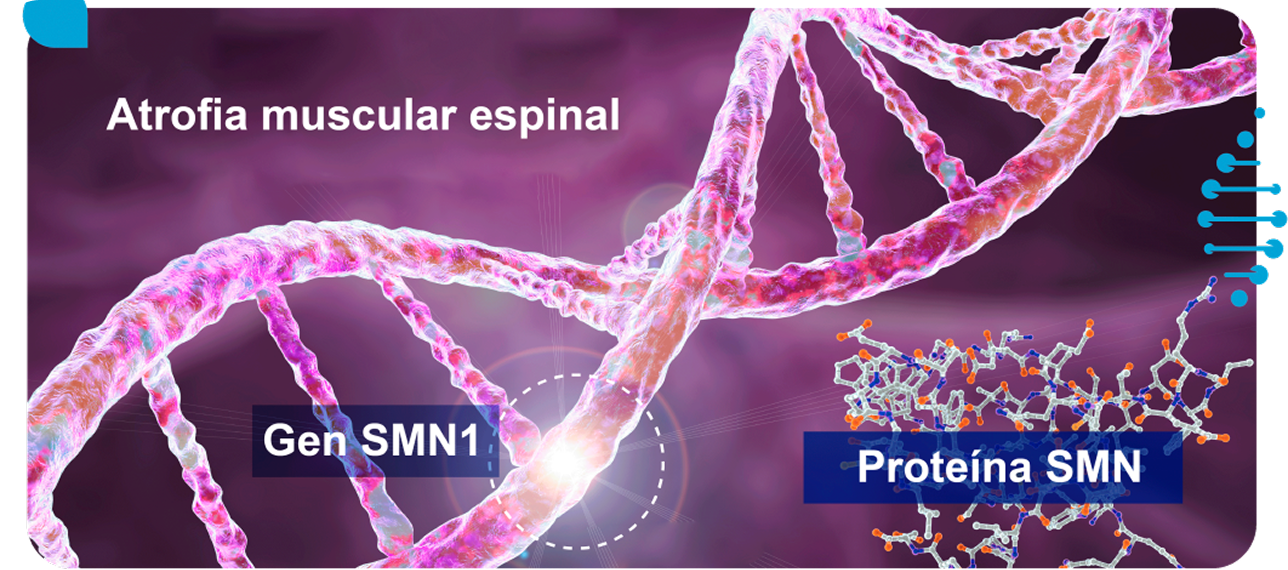
Es una enfermedad autosómica recesiva, causada por mutaciones en el gen SMN1, que conduce a una reducción de la expresión de la proteína de neurona motora de supervivencia (SMN por sus siglas en inglés: Survival Motor Neuron).
Esto provoca una degeneración de las α-motoneuronas en la médula espinal y tronco encefálico, asociada a hipotonía, atrofia muscular progresiva y debilidad de extremidades, tronco y músculos respiratorios/deglutorios (Mercuri et al., 2022, Ogino et al., 2002; Urrutia et al., 2020).
La incidencia mundial de la atrofia muscular espinal menudo se informa como 1 a 2 casos por cada 10,000 personas, con importantes diferencias entre países y una frecuencia de portadores promedio de 1 en 50 (Pearn et al., 1978). Mientras que en México se estima una cifra de 0.5 a 1 por cada 25,000 nacimientos.Urrutia

Etiopatogenia
Los seres humanos tenemos dos genes que codifican para la producción de proteína SMN, llamados SMN1 y SMN2, ubicados en el cromosoma 5q13 (AME 5q). La atrofia muscular espinal es causada por mutaciones bialélicas ocurridas en el gen SMN1. Alrededor del 95% de los pacientes con AME muestra deleciones homocigotas en los exones 7 y 8 o solo en el exón 7 del gen SMN1, independientemente del fenotipo de la enfermedad.
Otros pacientes portan una variación patogénica puntual en SMN1 y una deleción en el otro alelo de SMN1 o, muy raramente, mutaciones bialélicas en cualquiera de los exones de SMN1 (Wirth et al., 2021).
El gen SMN1 es el principal que codifica consistentemente la proteína SMN de longitud completa, que es esencial para la supervivencia de las neuronas motoras, en contraste con que solo el ~10 % de la proteína SMN producida por el gen SMN2 (también conocido como gen “de respaldo”) es funcional.
La alta variabilidad fenotípica en el espectro de la atrofia muscular espinal se atribuye principalmente a la variedad de copias del gen SMN2, al ser un gen homólogo al gen SMN1, excepto por algunos nucleótidos.Schorling El gen SMN2 tiende a presentar un empalme alternativo (alternative splicing) durante la transcripción del ARNm, lo que origina una proteína trunca, poco oligomerizante, y de rápida degradación, con solo el 10% de la proteína SMN completa.Cardona En efecto, numerosos estudios muestran cómo es que a mayor número de copias del gen SMN2, mayor cantidad de proteína SMN de longitud completa y menor severidad en el fenotipo de AME y viceversa. Sin embargo, esta correlación inversa no es absoluta (Calucho et al., 2018).
Mecanismos de daño asociados a la deficiencia de SMN
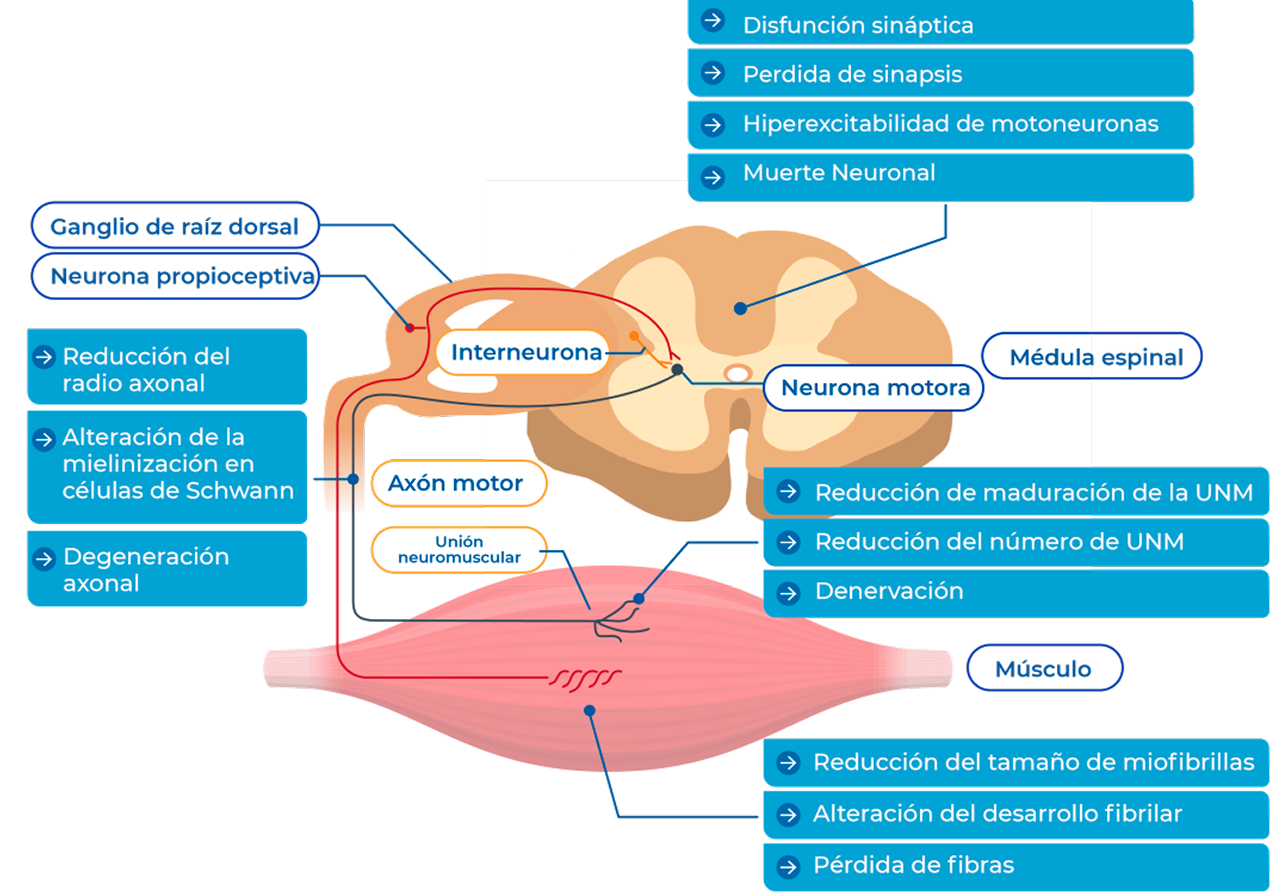
Adaptado de Mercuri E, et a. Nat Rev. Dis. Primers 2022
La proteína SMN tiene una función fundamental en todas las células del organismo y su ausencia total tiene efecto letal in uteroTizzano, ya que la expresión de la proteína SMN es mayor durante el desarrollo neuronal y la localización de la proteína cambia de la región nuclear a la citoplasmática en las neuronas maduras, también cumple funciones en el desarrollo y la maduración de las neuronas en la señalización y transmisión de la unión neuromuscular (Chaytow et al., 2018).
Las neuronas motorasα se conectan a los múculos esqueléticos a través de uniones neuromusculares (UNM) y reciben aferencias sinápticas, incluso de neuronas proploceptivas localizadas en ganglios de la raíz dorsal. La deficiendia de neurona motora de supervivencia (SMN) conduce a múltiples defectos en este circuito y a la degeneración de las neuronas motoras.
Manifestaciones clínicas

Aunque la AME es un continuo de expresión fenotípica, los síntomas de presentación difieren significativamente entre
subtipo (ver tabla 1).
Entre las características comunes a todo el espectro se incluyen la neuropatía motora pura y la axonopatía con arreflexia y fasciculaciones, conservación de la sensibilidad y un patrón típico de debilidad muscular, que es más grave para los músculos proximales y músculos de las extremidades inferiores (Kizina et al., 2021). Cuando no se trata en su forma más grave (Tipo 1), la degeneración de las neuronas motoras inferiores comienza poco antes del nacimiento y aumenta rápidamente, lo que puede ocasionar el uso ventilación permanente o muerte antes de los dos años si no se recibe tratamiento.
Tabla 1. Clasificación original de la atrofia muscular espinal (AME)
| |||||
| |||||
|
|
|
|
| |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
*La supervivencia se definió como ausencia de muerte o ausencia de necesidad de ≥16 h/día de ventilación continua durante ≥2 semanas, en ausencia de enfermedad aguda reversible; n=23 (2 copias de SMN2).9 1. Farrar MA, et al. Ann Neurol. 2017;81(3):355-368. 2. Anderton RS, et al. Expert Rev Neurother. 2015;15(8):895-908. 3. De Sanctis R, et al. Neuromuscul Disord. 2016;26(11):754-759. 4. Zerres K, et al. JAMA Neurology. 1995;52(5):518-523. 5. Ogino S. Eur J Hum Genet. 2004;12(12):1015-1023. 6. Pearn JH & Wilson J. Arch Dis Child.1973; 48(6):425-430. 7. Wang CH, et al. J Child Neurol. 2007;22(8):1027-1049. 8. Farrar MA, et al. J. Pediatr. 2013; 162(1):155-159. 9. Finkel RS, et al. Neurology. 2014;83(10):890-917. 10. Zerres K, et al. J. Neurol Sci. 1997; 146:67-72.
La atrofia muscular espinal se divide en 5 subtipos principales. El tipo 0, en el que solo existe una copia del gen SMN2, tiene presentación prenatal y una esperanza de vida de menos de 6 meses. Los pacientes presentan debilidad severa al nacimiento, hipotonía profunda, arreflexia, insuficiencia respiratoria, contracturas articulares y cardiopatía.Urrutia
El tipo I (enfermedad de Werdnig-Hoffman) es el más frecuente, sumando entre 50 y 70% de los pacientes. El genoma presenta un par de copias del gen SMN2 y en algunos casos se pueden presentar tres copias. Se presenta entre los cero y seis meses de edad e implica una esperanza de vida de menos de dos años, y el riesgo del uso de soporte respiratorio permanente. Se caracteriza por debilidad, hipotonía, fasciculaciones linguales, hiporreflexia o arreflexia, alteración de la succión y deglución e insuficiencia respiratoria.Urrutia
La atrofia muscular espinal de tipo II (enfermedad de Dubowitz) comprende a 20% de los pacientes, que poseen tres copias del gen SMN2. Esta variante se presenta entre los seis y 18 meses. Alrededor de 70% de los pacientes sobrevive a la edad de 25 años, aunque nunca presenta bipedestación ni deambulación. Otras características incluyen la debilidad proximal, hipotonía, temblor postural de manos, hiporreflexia y escoliosis.Urrutia

¿Cómo identificarla a tiempo?
Complicaciones
Durante su evolución, aparecen distintas complicaciones entre las que destacan las deformidades articulares, escoliosis, luxación de caderas, fracturas y alteraciones respiratorias.Febrer
Las deformaciones articulares son una complicación frecuente y aparecen con mayor frecuencia en el tipo II de atrofia muscular espinal. Por otra parte, la escoliosis ocurre de forma muy frecuente, pues tiene una incidencia de entre el 78 y el 100% de los pacientes. En cuanto a las fracturas y contracturas, existe mayor riesgo debido a una importante presencia de osteoporosis por inmovilización y falta de actividad muscular.Urrutia
La principal causa de muerte en niños con atrofia muscular espinal son las alteraciones respiratorias, sobre todo en los tipos más graves de enfermedad. En el tipo III, este tipo de complicaciones son menos frecuentes.Urrutia
Diagnóstico
Históricamente, la electromiografía (EMG) y la biopsia muscular establecían el diagnóstico. Sin embargo, estas pruebas ya no se realizan de forma rutinaria y hoy en día son las pruebas genéticas el paso diagnóstico inicial.
Nuevas recomendaciones sugieren determinar también el número de copias de SMN2, ya que esto proporciona información sobre la gravedad de la enfermedad en pacientes sintomáticos e identifica qué pacientes presintomáticos pueden iniciar un tratamiento (Schorling et al., 2019).

Tratamiento
El cuidado de los pacientes con atrofia muscular espinal requiere del manejo interdisciplinario de los problemas respiratorios, nutricionales, gastroenterológicos, ortopédicos y psicosociales (Schorling).
Antes de 2017, el manejo de los pacientes era de apoyo y se recomendaban más intervenciones invasivas en los pacientes con mayor debilidad.Friedman
Pero ha habido avances en el campo terapéutico gracias al mayor conocimiento en cuanto a las bases moleculares de la enfermedad, lo que ha resultado en terapias avanzadas muy específicas.Tizzano

Para recibir mayor información exclusiva acerca de la AME
Infografía
Referencias
Cardona N, Ocampo SJ, Estrada JM, et al. Caracterización clínica y funcional de pacientes con atrofia muscular espinal en el centro-occidente colombiano. Biomédica 2022;42(Supl.1):89-99.
National Center for Advancing Translation Sciences. Atrofia muscular espinal. Disponible en: https://rarediseases.info.nih.gov/espanol/11864/atrofia-muscular-espinal. Consultado el 21 de julio de 2023.
Tizzano EF. La atrofia muscular espinal en el nuevo escenario terapéutico. Rev Med Clin Condes.2018;29(5):512-20.
Febrer A, Meléndez M. Atrofia muscular espinal. Complicaciones y rehabilitación. Rehabilitación (Madr). 2001;35(5):307-11.
Urrutia-Osorio ME, Ruiz-García M. Perfil demográfico y clínico de pacientes con atrofia muscular espinal: serie de 31 pacientes. Acta Pediatr Méx. 2020;41(2):47-57.
Nicolau S, Waldrop MA, Connolly AM, Mendell JR. Spinal Muscular Atrophy. Semin Pediatr Neurol. 2021 Apr;37:100878.
Mercuri E, Sumner CJ, Muntoni F, et al. Spinal muscular atrophy. Nat Rev. Dis. Primers. 2022;8(1):52.
Ogino S, Leonard DG, Rennert H, Ewens WJ, Wilson RB. Genetic risk assessment in carrier testing for spinal muscular atrophy. Am. J. Med. Genet. 2002;110:301-307.
Pearn J. Incidence, prevalence, and gene frequency studies of chronic childhood spinal muscular atrophy. J. Med. Genet. 1978;15:409-413.
Wirth B. Spinal muscular atrophy: in the challenge lies a solution. Trends Neurosci. 2021;44:306-322.
Chaytow H, et al. Cell Mol Life Sci 2018;75:3877–3894; 2. VrbovaG, et al. NeuromusculDis 2018;28:385–393.
Kizina K, Akkaya Y, Jokisch D, et al. Cognitive impairment in adult patientswith 5q-associated spinal muscular atrophy. Brain Sci. 2021;11(9):1184. https://doi.org/10.3390/brainsci11091184).
Schorling DC, Becker J, Pechmann A, et al. Discrepancy in redetermination of SMN2 copy numbers in children with SMA. Neurology 2019;93:267-269.
Antonaci L, Pera MC, Mercuri E. New therapies for spinal muscular atrophy: where we stand and what is next. Eur J Pediatr. 2023 Jul;182(7):2935-2942. doi: 10.1007/s00431-023-04883-8. Epub 2023 Apr 17. PMID: 37067602; PMCID: PMC10354145.
Calucho M, Bernal S, Alías L, March F, Venceslá A, Rodríguez-Álvarez FJ, Aller E, Fernández RM, Borrego S, Millán JM, Hernández-Chico C, Cuscó I, Fuentes-Prior P, Tizzano EF. Correlation between SMA type and SMN2 copy number revisited: An analysis of 625 unrelated Spanish patients and a compilation of 2834 reported cases. Neuromuscul Disord. 2018 Mar;28(3):208-215. doi: 10.1016/j.nmd.2018.01.003. Epub 2018 Jan 11. PMID: 29433793.