『多発性硬化症・視神経脊髄炎スペクトラム障害診療ガイドライン2023』2017年版からの変更点:DMDを用いたMS治療のポイント解説
監修:新野 正明 先生
多発性硬化症・視神経脊髄炎スペクトラム障害診療ガイドライン作成委員会 委員長
独立行政法人国立病院機構 北海道医療センター 臨床研究部長
『多発性硬化症・視神経脊髄炎診療ガイドライン2017』公開後、多発性硬化症(MS)の診療環境は大きく変化し、『多発性硬化症・視神経脊髄炎スペクトラム障害診療ガイドライン2023』では大幅な改訂が行われました。
今回は、MSに関する2023年版の主な変更点について、2023年版のガイドライン作成委員会の委員長である新野正明先生にご監修をお願いし、2017年版との対比という形でより明確に解説しました。
RRMS患者の治療
RRMS患者の治療について
ポイント
| MSの診断後、速やかにDMDを開始することが推奨されています。また、ガイドライン2023年版では、RRMSにおいて、条件付きで、ナタリズマブまたはオファツムマブで治療を開始することが推奨されています。 |
解説
2017年版では、「再発寛解期においては早期にDMDを開始することを推奨する(1B+、推奨の強さ:1強い、エビデンス総体の総括:B中、+行うことを推奨する)」とされており、IFNβの臨床試験の追跡調査について紹介されていました。
追補版も含めた2017年版には、本邦で6種類のDMDが上市されていましたが、その後、オファツムマブ、シポニモドが登場し、現在では8種類のDMDが使用可能となりました。DMDが増えたことに伴い、特に診断早期のRRMSにどのようにDMDを導入するかは重要な課題となりました。短期的に再発を抑制することはもちろん、長期的な進行や後遺症をいかに軽減するかは、若年成人で発症するMSの治療目標としては重要です。一方で、副作用にも注意を払う必要があり、再発抑制効果の強いDMDを早期から導入するかどうかは議論のあるところでした。
この状況を踏まえ、2023年版では、「診断早期に再発頻度やMRI活動性が高い、さらにはEDSSが高い、脳萎縮が強いなどのRRMS患者においては、ナタリズマブないしオファツムマブで治療を開始することを推奨する(条件付き)。」と掲載されました。その際には、予後不良因子、PMLの発症リスク、患者の生活背景や価値観などを十分勘案する必要があります。
このような改訂の背景には、近年のDMDの開発によって治療選択肢が大幅に増えたためだけではなく、MS治療の考え方に大きな変化があったことが挙げられます。2017年版では、escalation therapyが基本であるとされていましたが、2023年版では、「従来のescalation therapyでは、DMDの効果を最大限に発揮できる機会を逃してしまう可能性があるため、予後不良と考えられる患者では、有効性の高いDMDから開始することが望ましい。」となりました。
2023年版に、従来のescalation therapyと比較して、early intensive therapyのほうが、身体障害の進行を有意に抑制できることがリアルワールドエビデンスで示されたという報告例が複数あります。
一方で、2017年版、2023年版の双方に共通していることは、DMDの開始はMSの診断後、速やかに行う、という点です。MS治療の根幹は、早期の治療介入による再発抑制と進行抑制であることに変わりはありません。
DMDの開始時期別に障害進行リスクを比較した研究によると、MS発症2年以内の早期から治療を開始した患者のほうが、4~6年経過してから開始した患者と比べて、障害進行リスクが有意に減少したことが報告されており、DMDは早期からの開始が有用である可能性が示唆されました(図1)。
図1 DMD開始時期別の障害進行リスク比較(海外データ)
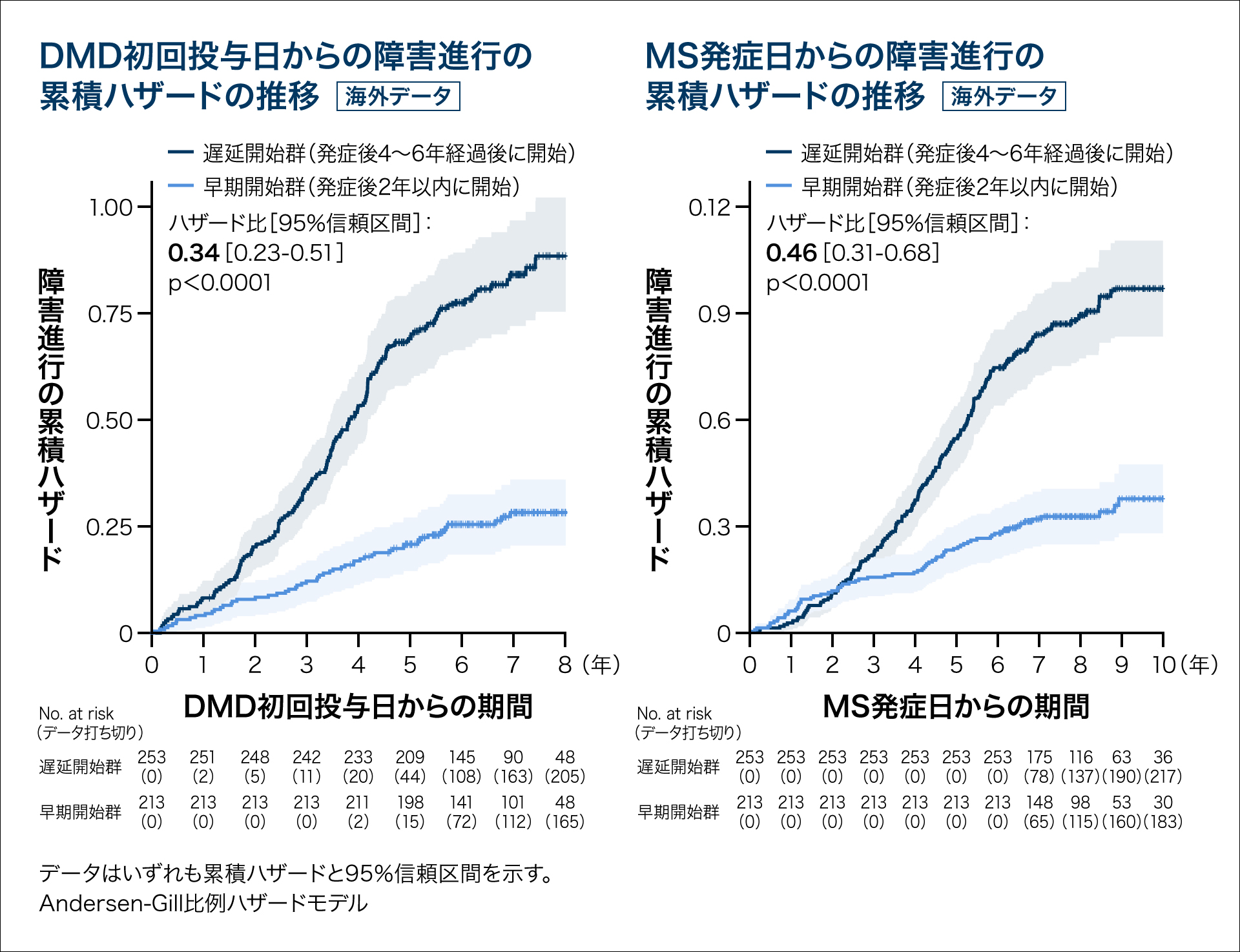
★:日本語表記:MS治療薬としては本邦未承認 英語表記:本邦未承認薬
| 本成績には、本邦未承認薬のデータが含まれています。 |
He A et al:Lancet Neurol 19(4):307-316, 2020
著者には、過去にノバルティスが報酬、研究助成金、講演料、コンサルタント料、旅費などを支払った者、ノバルティスのアドバイザリーボードを務めた者が含まれています。
RRMS:再発寛解型多発性硬化症、MS:多発性硬化症、INF:インターフェロン、DMD:疾患修飾薬、EDSS:総合障害度スケール、GA:グラチラマー酢酸塩、PML:進行性多巣性白質脳症
SPMS患者の治療
SPMS患者の治療について
ポイント
| ガイドライン2023年版では、SPMSにおいてオファツムマブまたはシポニモドで治療を行うことが推奨されており、特に活動性を認めるSPMSに対しては早期からDMDを導入するべきとされています。 |
解説
2017年版では、「SPMSでは、特に再発や画像上の活動性がみられる患者においてはDMDを開始してよい(2B+、推奨の強さ:2弱い、エビデンス総体の総括:B中、+行うことを推奨する) 」、そして、「SPMSにおけるIFNβの有効性に関しては試験ごとの異なる結果が出ている」と記載されています。
2023年版では、「1.SPMS患者に対してはオファツムマブ、シポニモド、いずれも推奨する。2.再発やMRIでの活動性を認めるSPMSにはオファツムマブを推奨する(条件付き)。」と記載され、SPMSの再発予防・進行抑制に承認された2つのDMDが推奨されています。
治療の開始時期に関しては、早期からのDMD導入を行うべきとされています。MSBaseに登録されたSPMS 1,621例を解析した結果、二次性進行期の障害進行は二次性進行期における再発の有無と関係し、二次性進行期に再発のあった患者ではDMD治療を継続することで障害の進行リスクが低下した一方で、再発のなかった患者ではDMD治療による障害進行リスクの低下は明らかでなかったことが報告されています1)。さらに、抗炎症作用を主な作用機序とする既存のDMDでは、SPMSの再発予防効果は期待できても、再発によらない障害の進行抑制は期待できないことも指摘されています2,3)。
「現在、本邦においてSPMSを適応症として承認されたDMDにはオファツムマブとシポニモドがあるが、いずれも主な作用機序は抗炎症作用である。したがって、これらの薬剤の治療効果を最大限に引き出すためには、再発や画像上で活動性を認める早期から使用を開始すべきである。」とされています。
また、いずれの薬剤を使用するかに関しては、「オファツムマブ、シポニモドいずれもSPMSに治療効果が期待できるが、エビデンスの確実性としてはシポニモドのほうが強い。エビデンスには乏しいが、再発やMRIでの活動性を認める場合、海外で使用されている他のCD20抗体の効果から、オファツムマブがより期待できるのではないかと推測される。」とされています。
1)Lizak N et al:JAMA Neurol 77(11):1398-1407, 2020
2)Lorscheider J et al:Neurology 89(10):1050-1059, 2017
3)Roos I et al:Neurology 97(9):e869-e880, 2021
SPMS:二次性進行型多発性硬化症、INF:インターフェロン、DMD:疾患修飾薬
DMDの切り替え
MSのDMDの切り替えについて
ポイント
| ガイドライン2023年版では、DMDの切り替えについて、より詳細な情報が記載されました。 |
解説
2017年版では、「Non-responderと判断した場合、再発予防と進行抑制のために治療薬の変更を行うことを推奨する(1C+、推奨の強さ:1強い、エビデンス総体の総括:C弱、+行うことを推奨する)」でした。Non-responderとは、治療開始後も疾患活動性が持続し、再発や障害度の進行が認められる患者のことですが、治療開始後のどの時点で、どのような基準によってnon-responderと判定するか一定の基準はありませんでした。
「日常診療ではむしろ、治療反応性が不十分なsuboptimal responderをできるだけ早期に見出すことが重要である。そのために、少なくとも治療開始1年後に、再発頻度と障害度の進行、MRI画像の変化によって治療反応性を評価することが重要である。」と記載されていました。
2023年版では、この「治療効果が不十分な場合」に加えて、「副作用により継続できない場合」、「治療継続による副作用が懸念される場合」、「治療継続による感染症(特にPML)の発症リスクや胎児への影響が懸念される場合も切り替えを検討する。」とされており、「治療効果が不十分とは、DMD開始後も再発や障害度の進行が認められる場合や、MRIで新規病変や拡大病変が認められる場合である。ただし、導入初期は効果がまだ現れていない可能性がある。障害度は身体機能のみならず、脳萎縮や認知機能も含めた指標が提唱されている。」と記載されています。
どのようにDMDの切り替えをすべきかについては、「副作用やアドヒアランス低下を理由に切り替えを行う場合、個々の患者背景を考慮して、忍容性が高くアドヒアランスの維持・向上が期待できるDMDを選択することが基本である1,2)。PML発症リスクや挙児希望を理由に切り替えを行う場合、PMLの発症リスクや胎児への影響を考慮してDMDを選択する1,3)。効果不十分を理由に切り替えを行う場合、作用機序が異なる有効性の高いDMDへの切り替えを考慮する1)。」とされています。
「DMD中止後は疾患活動性が再燃するリスクがある。そのため、できるだけ速やかに新たなDMDを開始することが基本」とされています。治療全般の流れは本章資料「CQおよびQ&AをもとにしたRRMSの治療アルゴリズム」を参照してください。
1)Rae-Grant A et al:Neurology 90(17):777-788, 2018
2)Grand‘Maison F et al:Curr Med Res Opin 34(8):1419-1430, 2018
3)Krysko KM et al:Curr Treat Options Neurol 23(4):11, 2021
DMD:疾患修飾薬、MS:多発性硬化症、PML:進行性多巣性白質脳症
RRMSの治療アルゴリズム
RRMSの治療アルゴリズムについて
ポイント
| ガイドライン2023年版では、CQおよびQ&Aに基づき、RRMSの治療アルゴリズムが新しく設定されました。従来のescalation therapyから、有効性の高いDMDから開始するearly intensive therapyへと、MS治療の考え方は大きく変化しつつあります(条件付き)。 |
解説
2017年版では、治療薬の選択は個別に最適化することが重要とされ、その治療薬の選択が難しい場合はMS専門家へ紹介いただくことが記載されていました。すでに「治療薬の効果を最大限に引き出すためにはRRMSのできるだけ早期に治療を開始することが重要である」と記載されていましたが、治療に関しては、ベースライン薬から開始し、治療効果不十分な場合に他のベースライン薬、または、第二選択、第三選択薬に切り替えることを基本とする、escalation therapy が推奨されていました。
2023年版では、診断早期のRRMSに関して、最初に4つの疾患活動性(再発頻度、MRI活動性、EDSS、脳萎縮)にフォーカスし、具体的な治療薬の選択肢を考慮できる治療アルゴリズムが作られています。
治療に関しては、Early top-down、すなわち、疾患活動性が高い場合は、ナタリズマブやオファツムマブを選択する道が示され、それ以外の場合には、IFNβ、GA、DMFから開始する道が示されています。
ガイドラインには、下記のように解説されています。
「診断早期のRRMSにおいては、個々の患者で再発頻度、MRI活動性、診断時のEDSSや脳萎縮を含む予後不良因子、PMLの発症リスク、生活背景や価値観などを考慮して、DMDを選択する。再発頻度やMRI活動性が高い、さらにはEDSSが高い、脳萎縮が強い場合には、ナタリズマブやオファツムマブを選択し、それ以外の場合には、重篤な副作用が出る確率の低いIFNβ、GA、DMFから開始することを考慮してもよい。しかし、これらの薬剤によるQOL低下(IFNβによる精神症候、発熱、IFNβやGAによる皮膚反応、DMFによる皮膚・消化器症候など)や有効性の問題も無視できないことから、有益性とリスクのバランスについて合意を得たうえで、オファツムマブやナタリズマブで開始する選択も考慮される。」
RRMS:再発寛解型多発性硬化症、EDSS:総合障害度スケール、PML:進行性多巣性白質脳症、QOL:生活の質、DMD:疾患修飾薬、MS:多発性硬化症、IFN:インターフェロン、GA:グラチラマー酢酸塩、DMF:フマル酸ジメチル
予後不良因子
MSの予後不良因子について
ポイント
| ガイドライン2023年版では、予後不良因子の具体的な項目について記載されました。 |
解説
2017年版では、「自然経過からみた予後不良を示唆する因子として、PPMSでの発症と二次性進行期の開始が挙げられる。RRMSとSPMSに限れば、①進行期の開始、②高い再発頻度、③発症5年後の障害度の高さ、④2回目の再発までの期間の短さ、⑤多系統の神経機能障害、が予後不良因子として挙げられる。一方、PPMSでは、発症2年後および5年後の障害度の高さが予後不良因子として挙げられる。」とされました。
その後、MSの予後不良因子としてはさまざまなエビデンスが集積し、欧米では患者背景・環境因子、臨床的特徴、MRI画像、バイオマーカーといったそれぞれの項目における予後不良因子が報告されてきました。この海外データをもとに、日本人データも加味して、2023年版に具体的な項目が記載されました。
2023年版では、予後不良因子としてこれらの項目が挙げられています。
- 自然経過における予後不良因子としては、PPMS、SPMSなどの進行型MSがある。
- 人口統計学的および環境的要因として、高年齢、男性、血中ビタミンD濃度低値、喫煙などがある。
- 臨床的要因として、初発時に複数の症状がある、脳幹・小脳・脊髄での発症、初発からの回復が悪い、初発から2回目の再発までの期間が短い、MS診断時のEDSSが高い、再発頻度が高い、発症5年後の障害度が高い、早期に認知機能障害を認める、などが挙げられる。
- MRI所見としては、T2病変が多い、T2病変の容積が大きい、造影病変が存在する、テント下病変や脊髄病変がある、脳萎縮があるなどが挙げられる。
- バイオマーカーとしては、脳脊髄液OB陽性、脳脊髄液・血液でのニューロフィラメント軽鎖高値、光干渉断層計(optical coherence tomography:OCT)での網膜神経線維層(retinal nerve fiber layer:RNFL)の菲薄化などがある。
MSの経過は多様であり、発症後の経過を予測することは困難ですが、予後不良因子を把握することは患者の治療選択に重要となります。
MS:多発性硬化症、PPMS:一次性進行型多発性硬化症、RRMS:再発寛解型多発性硬化症、SPMS:二次性進行型多発性硬化症、EDSS:総合障害度スケール、OB:オリゴクローナルIgGバンド
