ファビハルタの患者像、有効性及び安全性
患者像①:このような患者さんはいらっしゃいませんか?
将来に関して不安を抱くC3腎症患者
「30代で透析を受けたり、腎移植を受けたりしたくありません」
Image
患者像②:このような患者さんはいらっしゃいませんか?
急速に進行しているC3腎症患者
「倦怠感で集中することが難しく、原因がわからず不安でした」
Image

「警告・禁忌を含む注意事項等情報」等はこちらをご参照ください。 |
国際共同第Ⅲ相試験
B12301/APPEAR-C3G試験
社内資料:国際共同第Ⅲ相試験(B12301/APPEAR-C3G試験)(承認時評価資料)
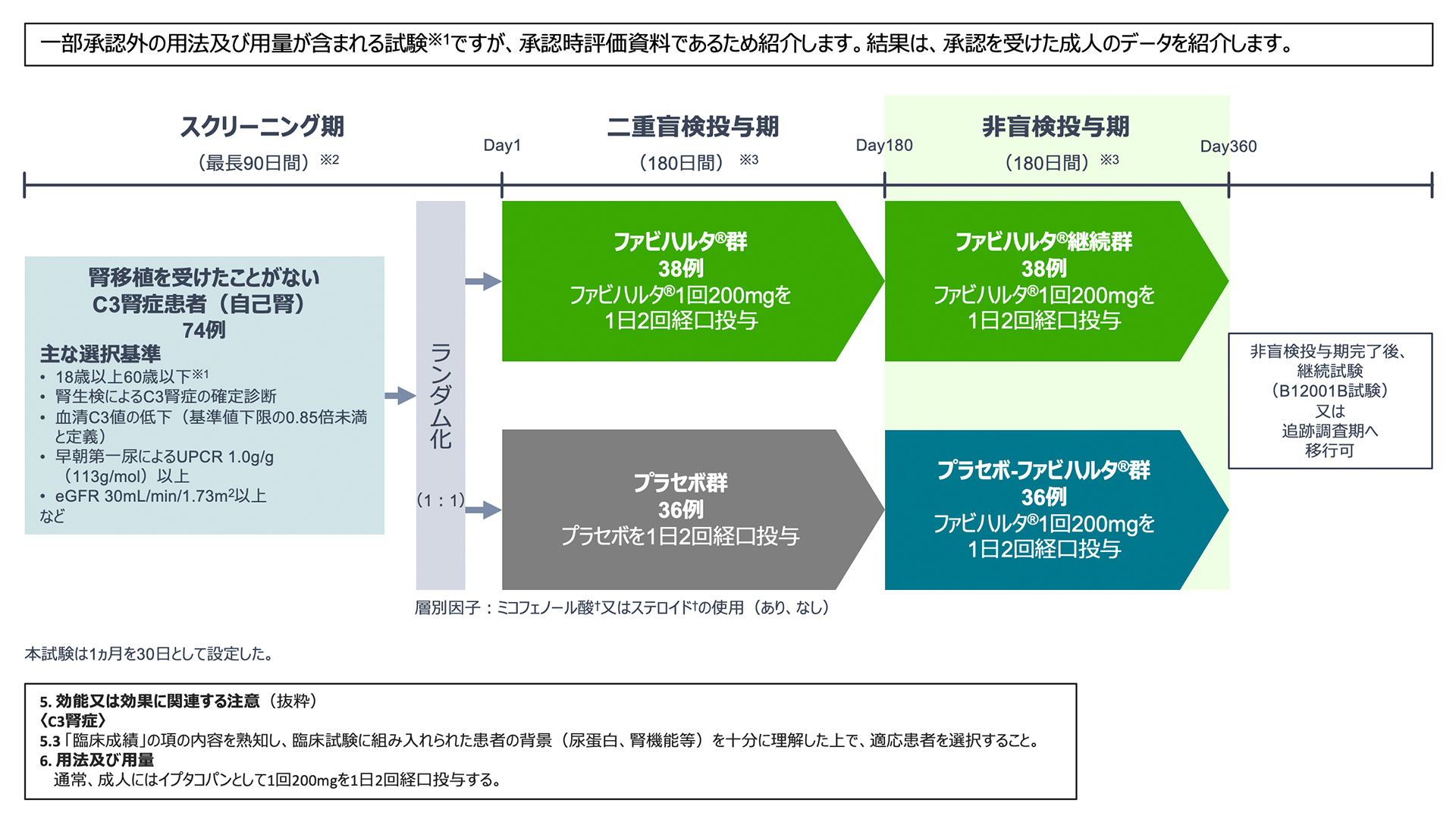
臨床成績(試験概要)
Image
Image

評価項目:
Image

解析計画:
Image

臨床試験(有効性)
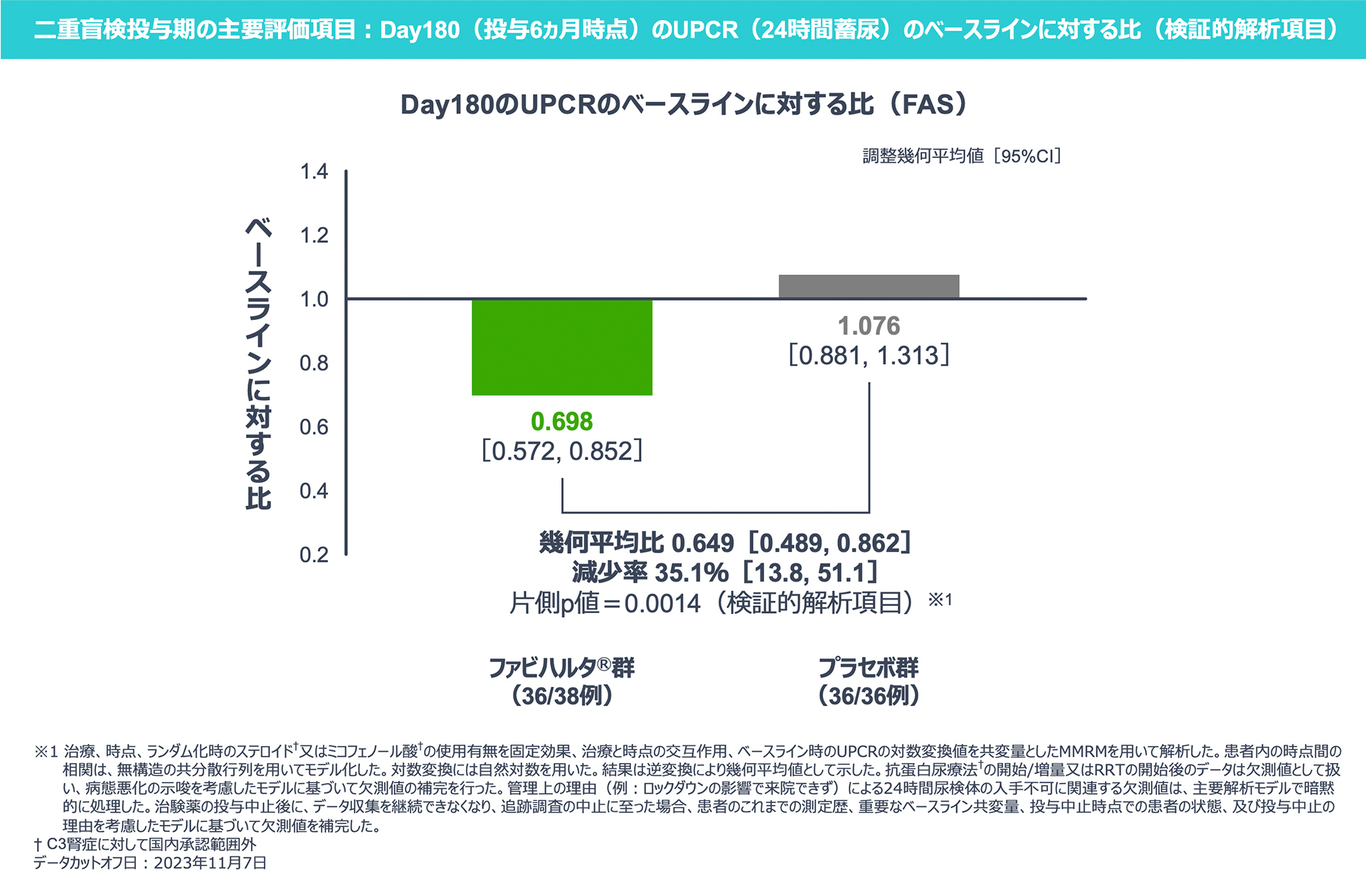
【二重盲検投与期の主要評価項目:検証的解析項目】
Day180のUPCR(24時間蓄尿)のベースラインに対する比は、プラセボ群に対するファビハルタ®群の優越性が検証され、ファビハルタ®群はプラセボ群と比べて35.1%減少しました。
Image
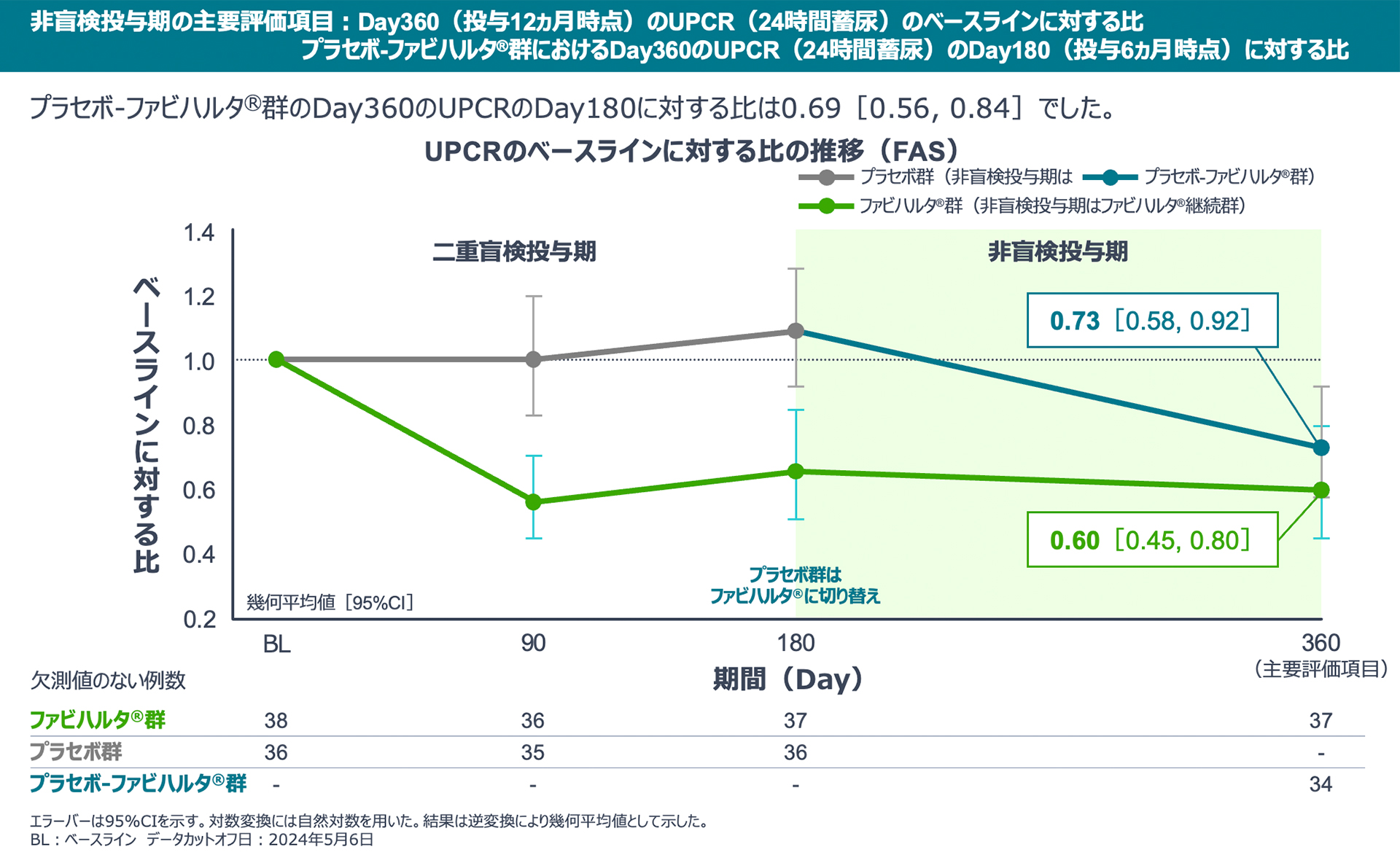
【非盲検投与期の主要評価項目】
Day360のUPCR(24時間蓄尿)のベースラインに対する比は、ファビハルタ®継続群で0.60、プラセボ-ファビハルタ®群で0.73でした。
Image
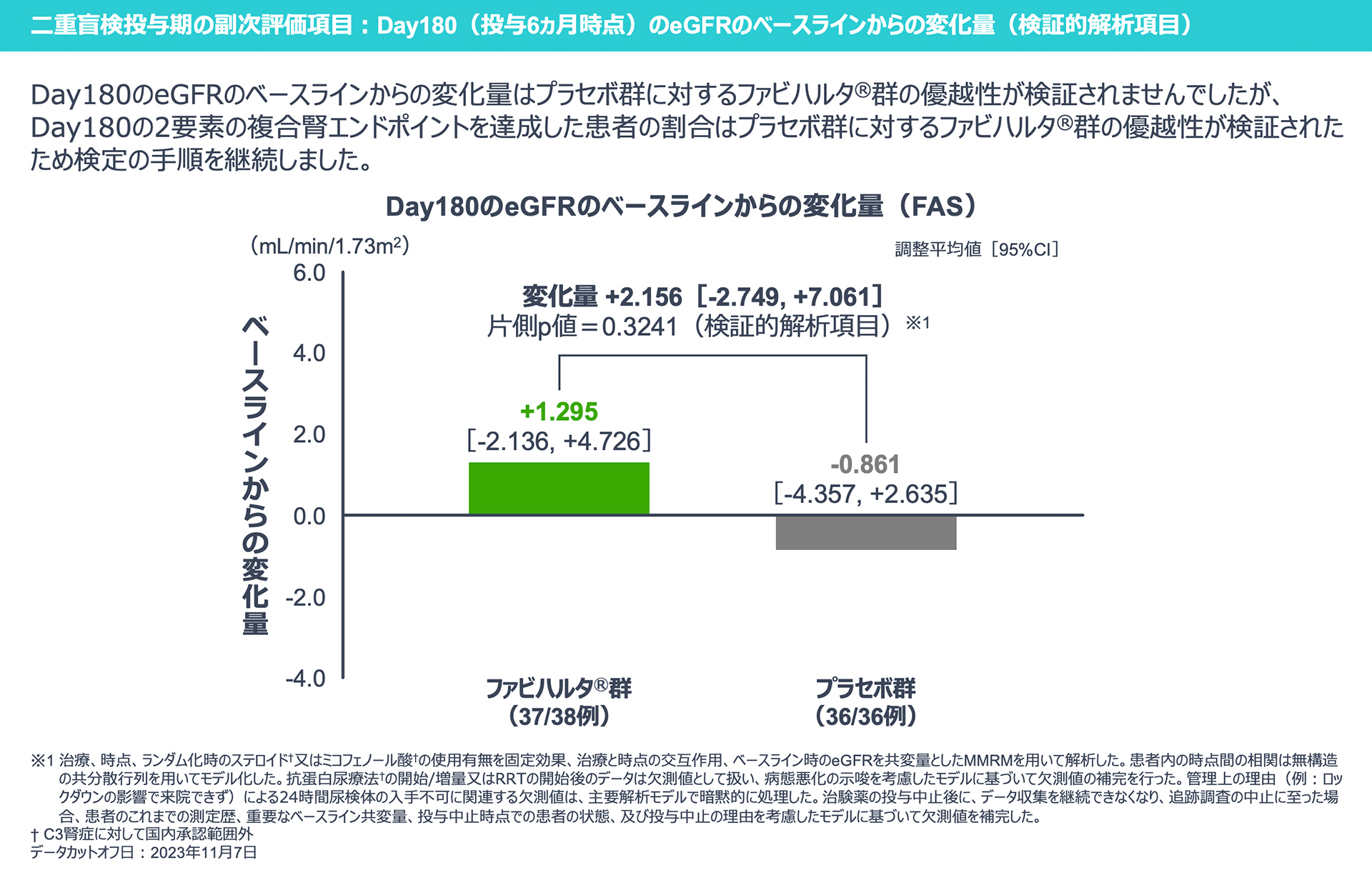
【二重盲検投与期の副次評価項目:検証的解析項目】
Day180のeGFRのベースラインからの変化量は、プラセボ群に対するファビハルタ®群の優越性が検証されませんでした。
Image
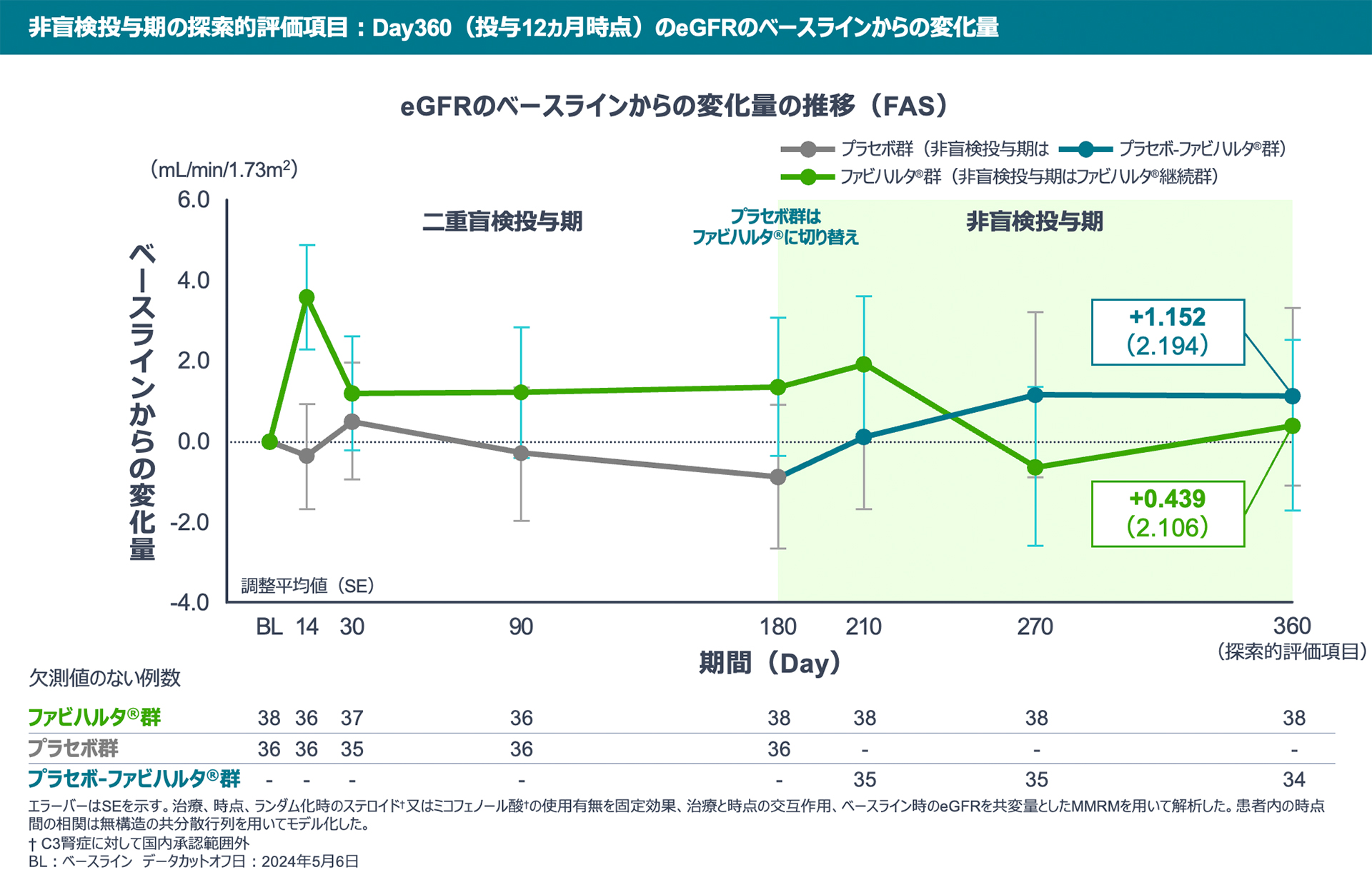
【非盲検投与期の探索的評価項目】
Day360のeGFRのベースラインからの変化量は、ファビハルタ®継続群で+0.439でした。
Image
【二重盲検投与期の副次評価項目】
Day180の2要素の複合腎エンドポイントを達成した患者の割合は、プラセボ群に対するファビハルタ®群の優越性が検証されました。
Image

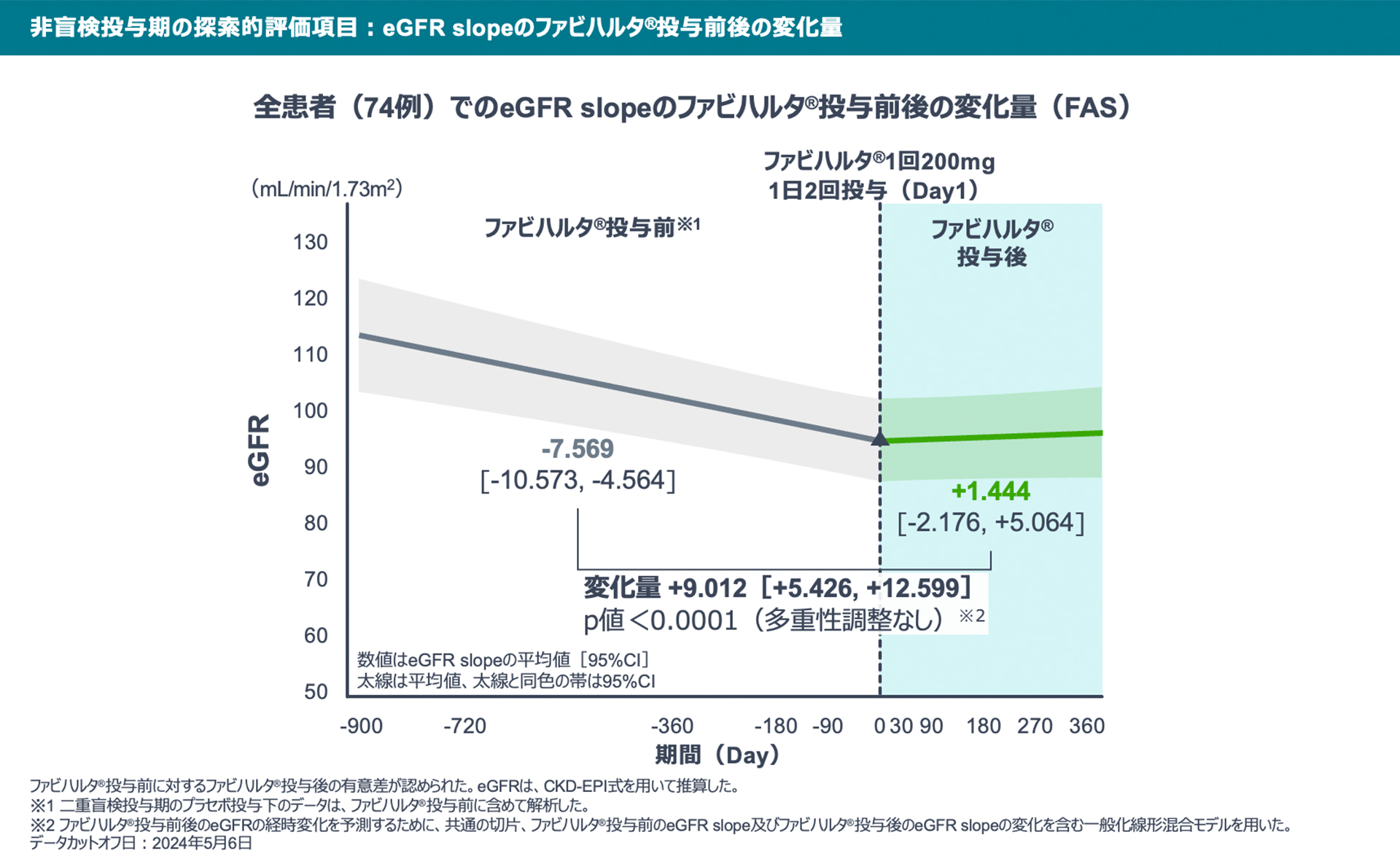
【非盲検投与期の探索的評価項目】
eGFR slopeは、全患者のファビハルタ®投与前で-7.569、ファビハルタ®投与後で+1.444であり、eGFR slopeのファビハルタ®投与前後の変化量は+9.012でした。
Image
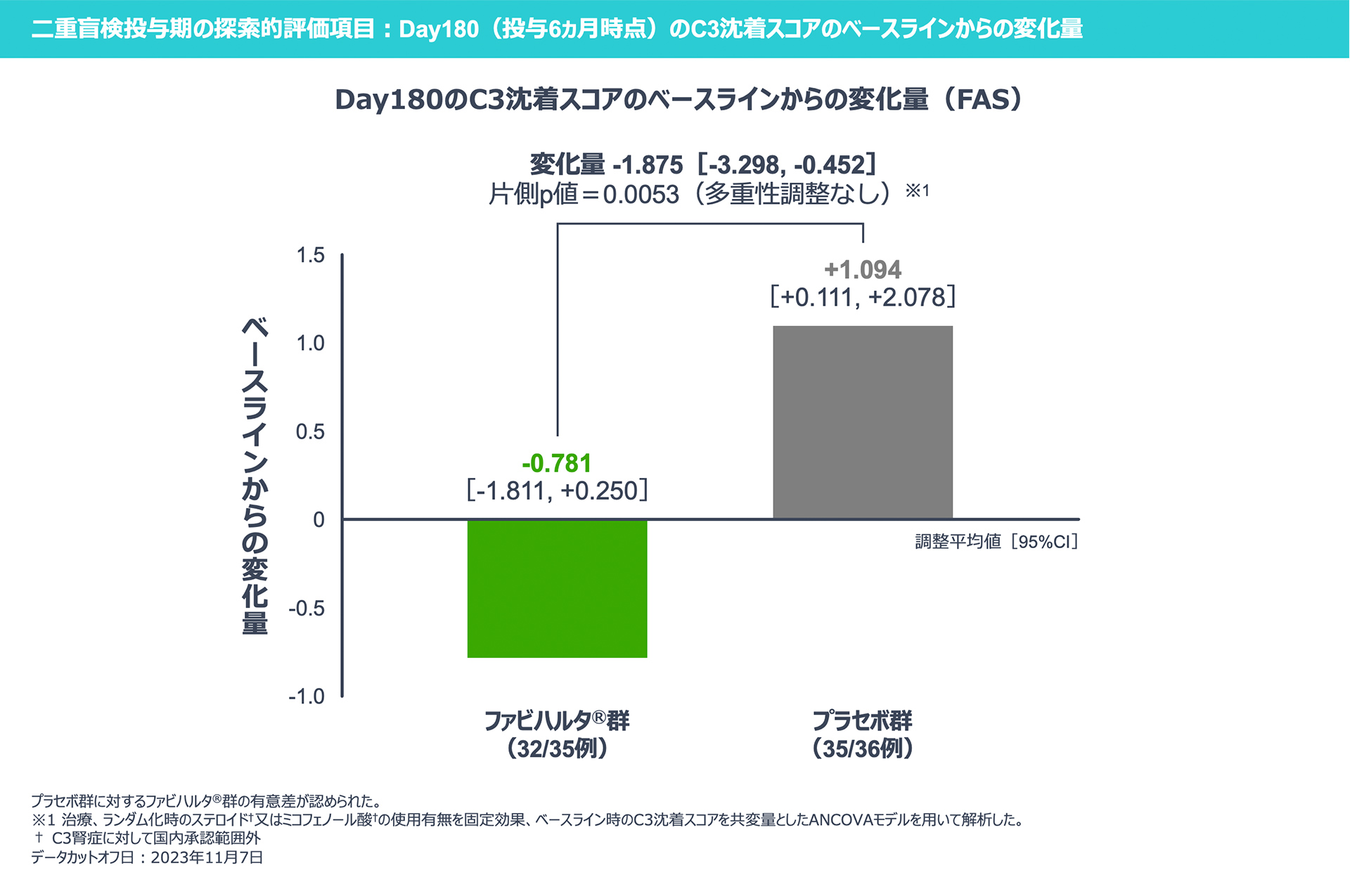
【二重盲検投与期の探索的評価項目】
Day180のC3沈着スコアのベースラインからの変化量は、ファビハルタ®群で-0.781、プラセボ群で+1.094であり、プラセボ群に対する変化量は-1.875でした。
Image
臨床試験(安全性)
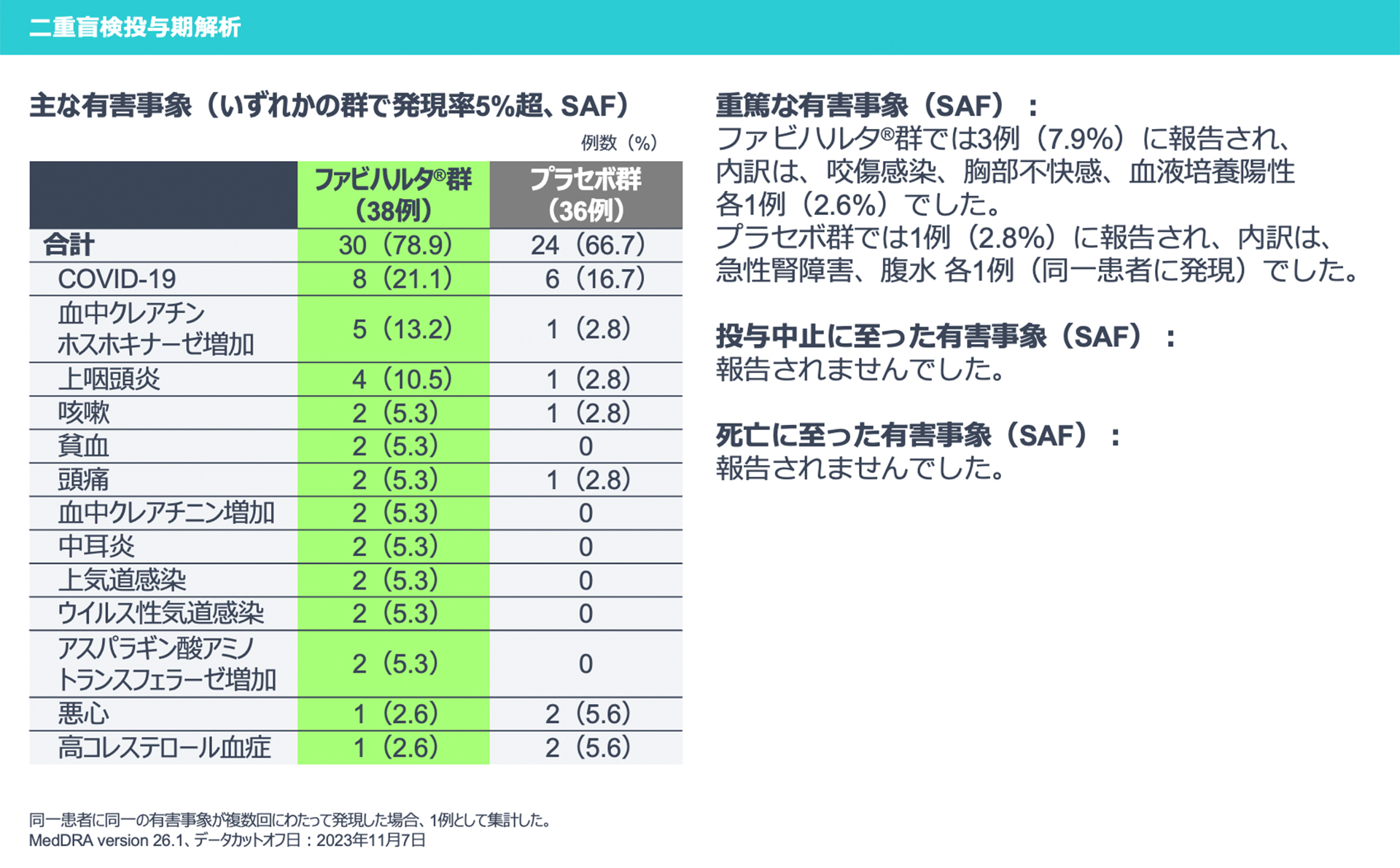
【二重盲検投与期解析】
二重盲検投与期解析における有害事象は、ファビハルタ®群で30例、プラセボ群で24例に報告されました。
Image
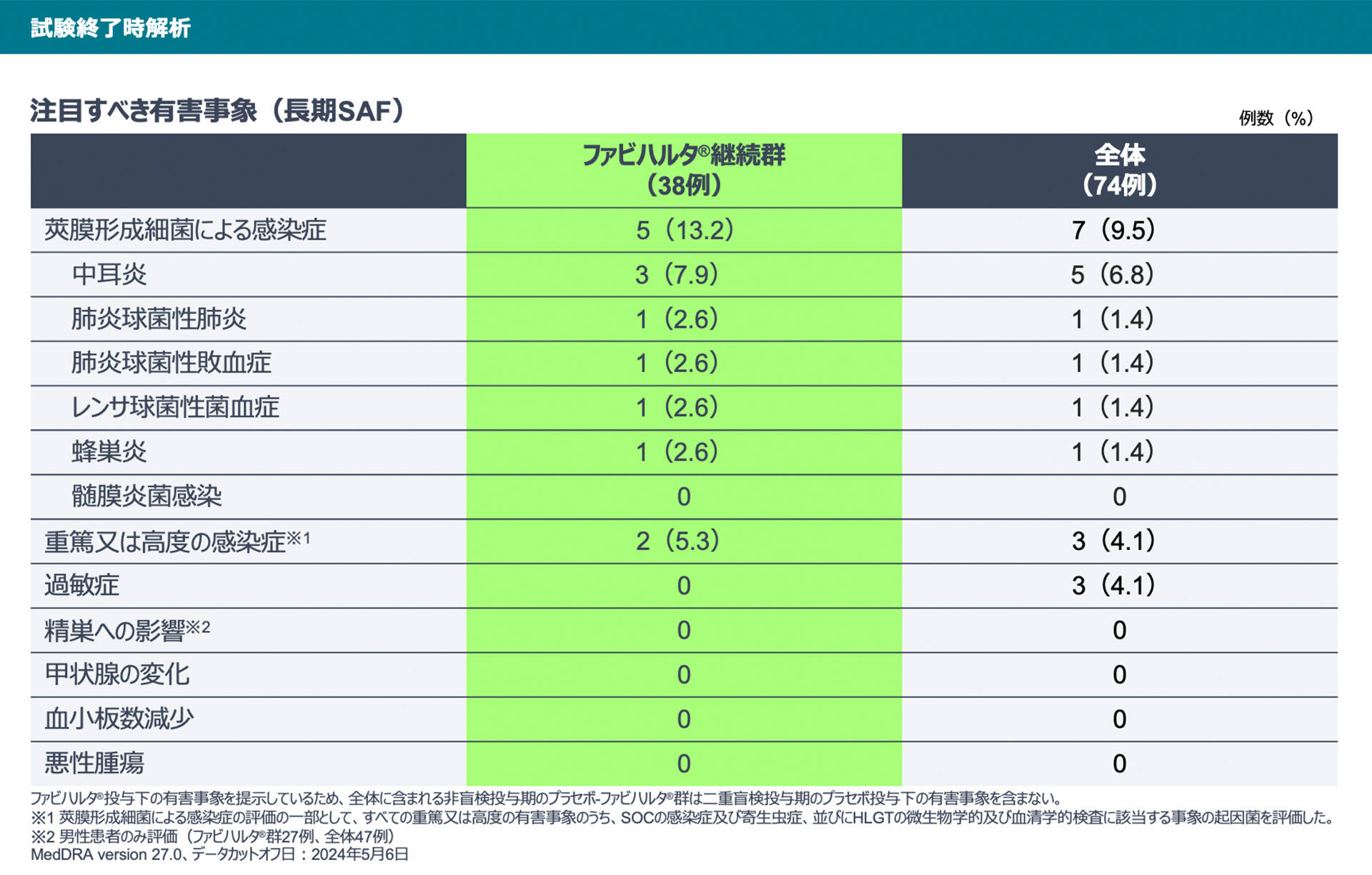
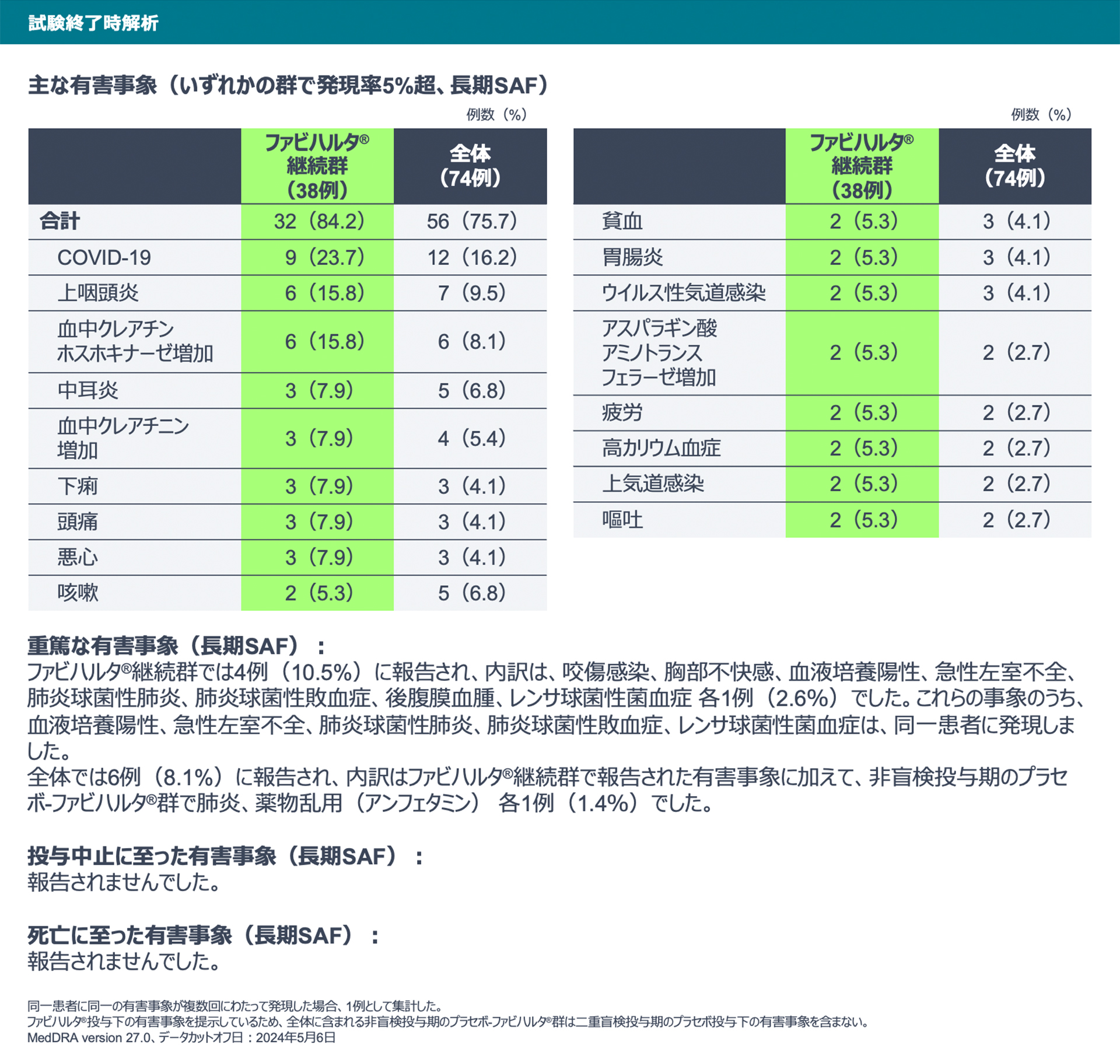
【試験終了時解析】
試験終了時解析における有害事象は、ファビハルタ®継続群で32例、全体で56例に報告されました。
Image
試験終了時解析における注目すべき有害事象として莢膜形成細菌による感染症がファビハルタ®継続群で5例、全体で7例に報告されました。
Image