Fil d'Ariane

Efficacité de Cosentyx® chez les patients de 90 kg et plus
Qu’est-ce que l’étude A2324 ?1,2
L'obésité est l'une des comorbidités fréquentes chez les patients atteints de psoriasis et l'indice de masse corporelle peut influencer la réponse au traitement biologique. En effet, les patients obèses obtiennent plus rarement un blanchissement des lésions que les patients non-obèses. L'étude A2324 a été menée afin d'évaluer les résultats obtenus en augmentant la fréquence d'administration de Cosentyx® chez des patients ayant une masse corporelle de 90 kg et plus.
Il s’agit d’une étude de phase IIIb, multicentrique, randomisée, contrôlée en double aveugle, en groupes parallèles dont l’objectif est de comparer l’efficacité, la sécurité et la tolérance à court terme (16 semaines) et à long terme (52 semaines) d’une administration de Cosentyx® 300 mg toutes les 2 semaines versus Cosentyx® 300 mg toutes les 4 semaines en dose d’entretien chez les patients adultes atteints de psoriasis en plaques modéré à sévère dont le poids corporel est ≥ 90 kg.
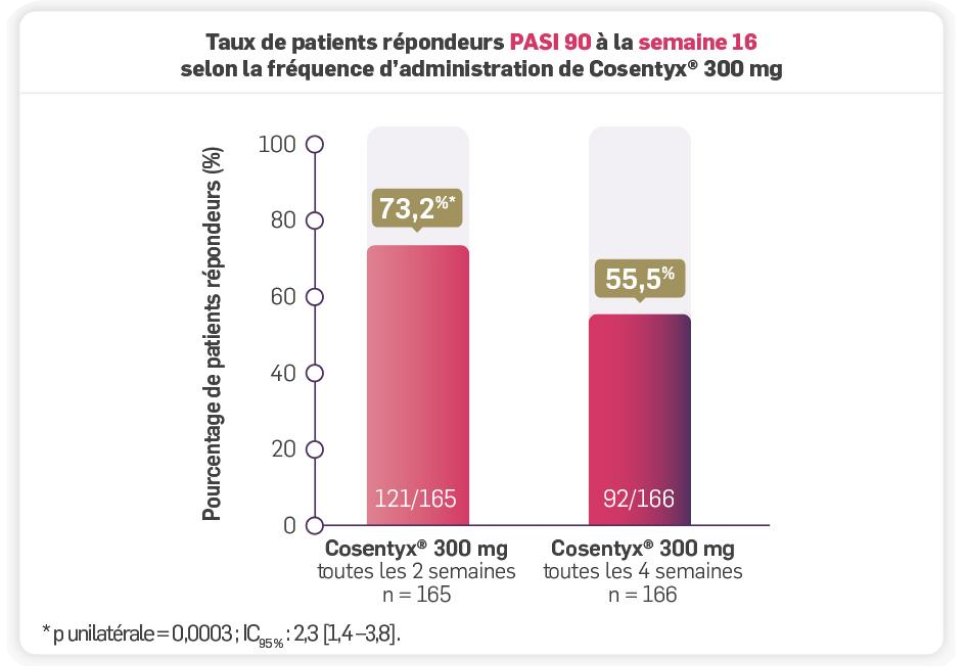
Le critère principal d’évaluation était la proportion de patients atteignant un score PASI 90 à la semaine 16 chez les patients traités par Cosentyx® 300 mg toutes les 2 semaines versus Cosentyx® 300 mg toutes les 4 semaines.
Efficacité selon les fréquences d'administration de Cosentyx® chez les patients avec une masse corporelle importante1,2
Les résultats de l’étude A2324 démontrent une efficacité différente du traitement chez les patients de 90 kg et plus en fonction de la fréquence d'administration de Cosentyx® 300 mg.
Avec Cosentyx® 300 mg toutes les 4 semaines, plus de 5 patients sur 10 atteignent un PASI 90 à la semaine 16. Le taux de réponse PASI 90 à la semaine 16 passe à plus de 7 patients sur 10 quand on augmente la fréquence de l’administration de Cosentyx® 300 mg à toutes les 2 semaines : soit une augmentation de l'efficacité de 17,7 % versus une administration de Cosentyx® 300 mg toutes les 4 semaines.
Cosentyx® est-il bien toléré chez les patients ≥ 90 kg ? 1,2
Dans l’étude A2324, la proportion de patients ayant présenté des évènements indésirables à la semaine 16 est similaire entre les deux groupes de traitement (55,2 % versus 55,8 % avec Cosentyx® 300 mg toutes les 2 et 4 semaines respectivement) et reste comparable à la semaine 52 (77,0 % versus 72,4 % avec Cosentyx® 300 mg toutes les 2 et 4 semaines respectivement).
Les effets indésirables les plus fréquents à S16 sont :
Les rhinopharyngites (9,7 % versus 8,5 % avec Cosentyx® 300 mg toutes les 2 et 4 semaines respectivement)
Les céphalées (5,5 % versus 2,4 % avec Cosentyx® 300 mg toutes les 2 et 4 semaines respectivement)
Les diarrhées (4,2 % versus 4,8 % avec Cosentyx® 300 mg toutes les 2 et 4 semaines respectivement).
Le profil de sécurité global de Cosentyx® dans cette l’étude était conforme au profil de sécurité observé précédemment dans les essais de phase 3 et il n’y a pas eu de signal de sécurité inattendu.
Veuillez consulter le Résumé des Caractéristiques du Produit Cosentyx® pour une information complète sur les effets indésirables.
L’étude A2324 a ainsi démontré une augmentation de l’efficacité de Cosentyx® 300 mg avec une administration toutes les 2 semaines versus une administration de Cosentyx® 300 mg toutes les 4 semaines chez certains patients de 90 kg et plus.
Cet article correspond à une présentation partielle de l’étude A2324, pour en connaître les détails et pour plus d’information sur les résultats et la méthodologie, cliquez ici.
Pour une information complète, se reporter au Résumé des caractéristiques du produit de Cosentyx®.
PASI : Psoriasis Area And Severity Index.
Références
Résumé des Caractéristiques du Produit Cosentyx®.
Augustin M, et al. Secukinumab dosing every 2 weeks demonstrated superior efficacy compared with dosing every 4 weeks in patients with psoriasis weighing 90 kg or more: results of a randomized controlled trial. Br J Dermatol. 2022;186(6):942-54.
