La enfermedad de células falciformes
Conran N, et al. Newer aspects of the pathophysiology of sickle cell disease vaso-occlusion. Hemoglobin. 2009;33(1):1-16.
Steinberg MH. Sickle cell disease and associated hemoglobinopahies. In: Goldman L, Ausiello D, eds, Cecil Medicine, 23rd ed. Philadelphia, PA; Saunders Elsevier; 2009:1217-26.
Piel FB. et al. Sickle cell disease. N Engl J Med. 2017;376(16):1561-73.
Kalpatthi R, Novelli EM. Measuring success: urility of biomarkers in sickle cell disease clinical trials and care. Hematology Am Soc Hematol Educ Program. 2018. 2018;2018(1):482-92.
Ballas SK, et al. Sickle cell pain: a critical reappraisal. Blood. 2012;120(18(:3647-56.
Habara A, Steinberg MH. Genetic basis of heterogeneity and severity in sickle cell disease. Exp Biol Med (Maywood). 2016:241(7):689-96.
Rees DC, et al. Sickle-cell disease. Lancet. 2010;376(9757):2018-31.
Saraf SL, et al. Differences in the clinical and genotypic presentation of sickle cell disease around the world. Paediatr Respir Rev. 2014;15(1):4-12.
Centers for Disease Control and Prevention. Data & Statistics: Sickle Cell Disease.https://www.cdc.gov/ncbddd/sicklecell/data.html. Último acceso: mayo 2020.
Cancho EJB. et al. Update of the Spanish Registry of Haemoglobinopathies in Children and Adults. Med Clin (Barc). 2020; ;S0025-7753(19)30717-1.
Aliyu ZY, et al. Sickle cell disease and pulmonary hypertension in Africa: a global perspective and review of epidemiology, pathophysiology, and management. Am J hematol. 2008;83:63-70.
Huttle A, et al. Sickle cell disease in Latin America and the United States. Pediatr Blood Cancer. 2015; 62(7):1131-6.
Piel FB, et al. Global burden of sickle cell anaemia in children under five, 2010-2015: modelling based on demographics, excess mortality, interventions. PLoS One. 2013;10(7):1-14.
Puri L, et al. State of the art management of acute vaso-occlusive pain in sickle cell disease. Paediatr Drugs. 2018;20(1):29-42.
Zhang D, et al. Neutrophils, platelets, and inflammatory pathways at the nexus of sickle cell disease pathophysiology. Blood. 2016;127(7):801-9.
Kanter J, Kruse-Jarres R. Management of sickle cell disease from childhood through adulthood. Blood Rev. 2013;27(6):279-87.
Kappelmayer J, Nagy B. The interaction of selectins and PSGL-1 as a key component in thrombus formation and cancer progression. Biomed Res Int. 2017;2017(6138145):1-18.
Chirico EN, Pialoux V. Role of oxidative stress in the pathogenesis of sickle cell disease. IUBMB Life. 2012;64(1):72-80.
Grupo de Eritropatología de la Sociedad Española de Hematología y Hemoterapia. Guía de enfermedad de células falciformes. 2021. Disponible en: https://www.profesionalessanitarios.novartis.es/sites/profesionalessanit.... Último acceso mayo 2022.
Sociedad Española de Hematología y Oncología Pediátricas. Enfermedad de células falciformes. Guía de práctica clínica. 2019. Disponible en: http://www.sehop.org/wp-content/uploads/2019/03/Gu%C3%ADa-SEHOP-Falcifor.... Último acceso mayo 2022.
Piel FB, Steinberg MH, Rees DC. Sickle Cell Disease. N Engl J Med. 2017;376(16):1561-1573.
Grupo de Eritropatología de la Sociedad Española de Hematología y Hemoterapia. Guía de enfermedad de células falciformes. 2021. Disponible en: https://www.profesionalessanitarios.novartis.es/sites/profesionalessanit.... Último acceso mayo 2022.
Grupo de Eritropatología de la Sociedad Española de Hematología y Hemoterapia. Guía de enfermedad de células falciformes. 2021. Disponible en: https://www.profesionalessanitarios.novartis.es/sites/profesionalessanit.... Último acceso mayo 2022.
Sociedad Española de Hematología y Oncología Pediátricas. Enfermedad de células falciformes. Guía de práctica clínica. 2019. Disponible en: http://www.sehop.org/wp-content/uploads/2019/03/Gu%C3%ADa-SEHOP-Falcifor.... Último acceso mayo 2022.
Grupo de Eritropatología de la Sociedad Española de Hematología y Hemoterapia. Guía de enfermedad de células falciformes. 2021. Disponible en: https://www.profesionalessanitarios.novartis.es/sites/profesionalessanit.... Último acceso mayo 2022.
Sociedad Española de Hematología y Oncología Pediátricas. Enfermedad de células falciformes. Guía de práctica clínica. 2019. Disponible en: http://www.sehop.org/wp-content/uploads/2019/03/Gu%C3%ADa-SEHOP-Falcifor.... Último acceso mayo 2022.
Grupo de Eritropatología de la Sociedad Española de Hematología y Hemoterapia. Guía de enfermedad de células falciformes. 2021. Disponible en: https://www.profesionalessanitarios.novartis.es/sites/profesionalessanit.... Último acceso mayo 2022.
Sobre la ECF
Esta información va destinada únicamente a profesionales sanitarios; si no lo eres, visita anemiafalciforme.es
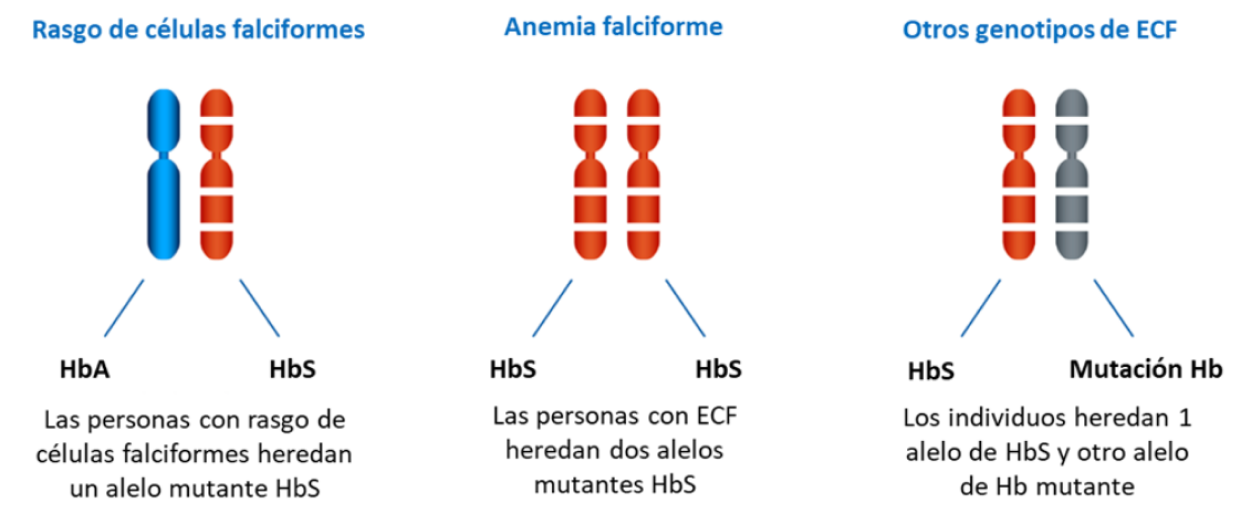
Trastorno genético complejo
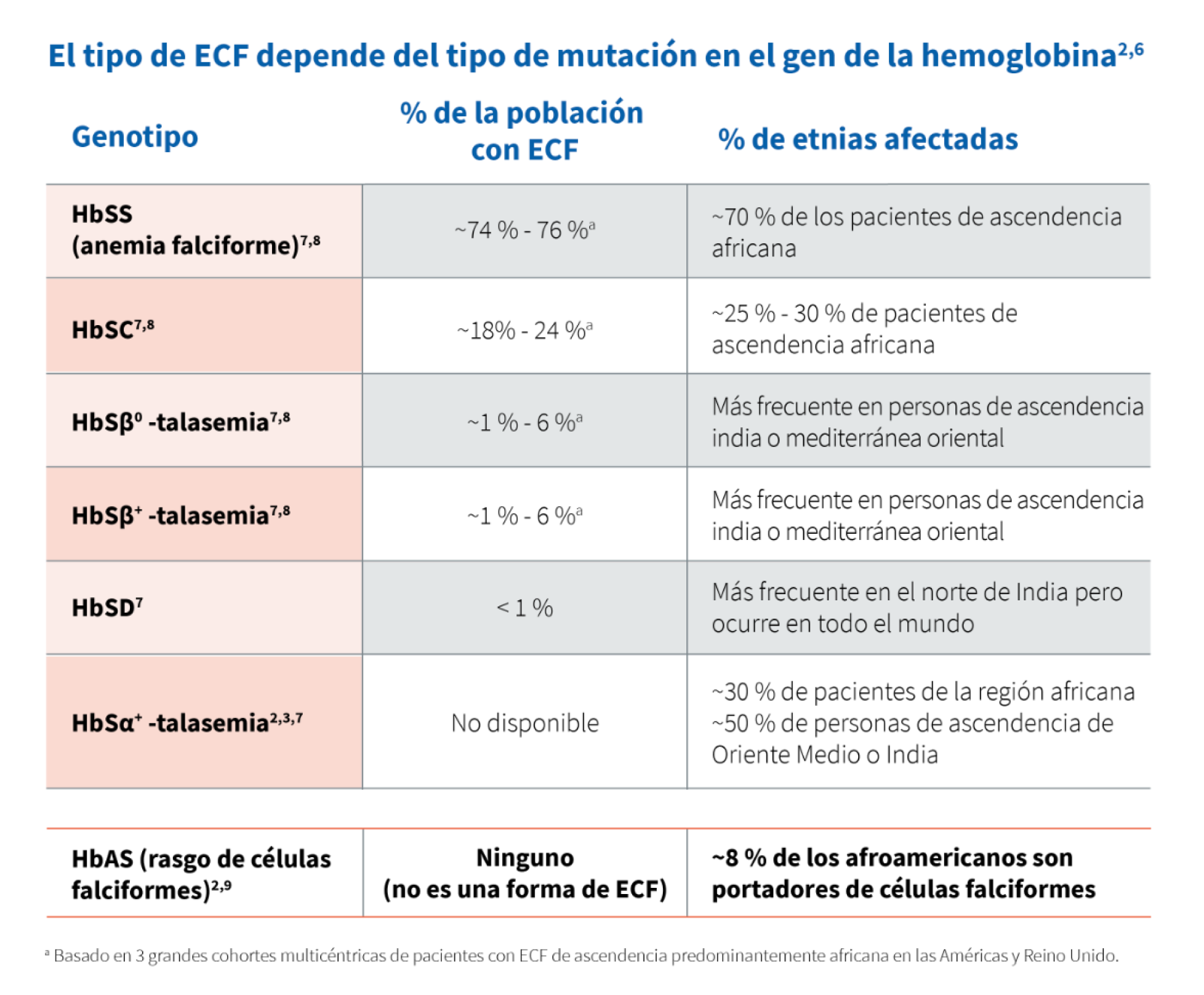
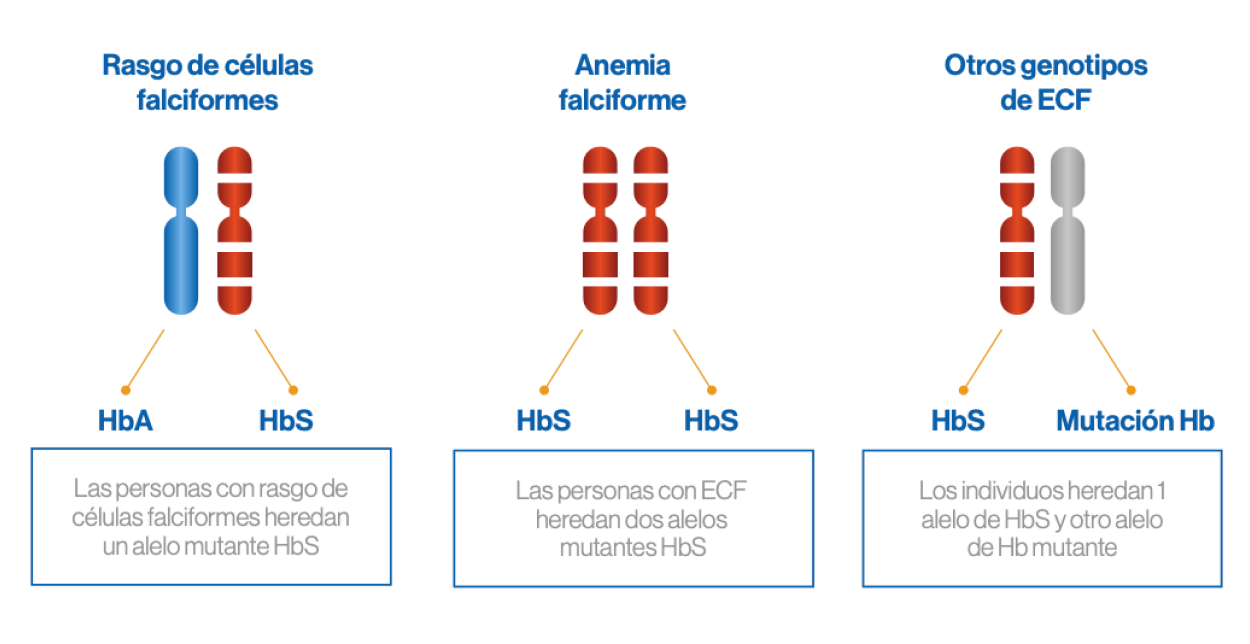
Genotipos comunes
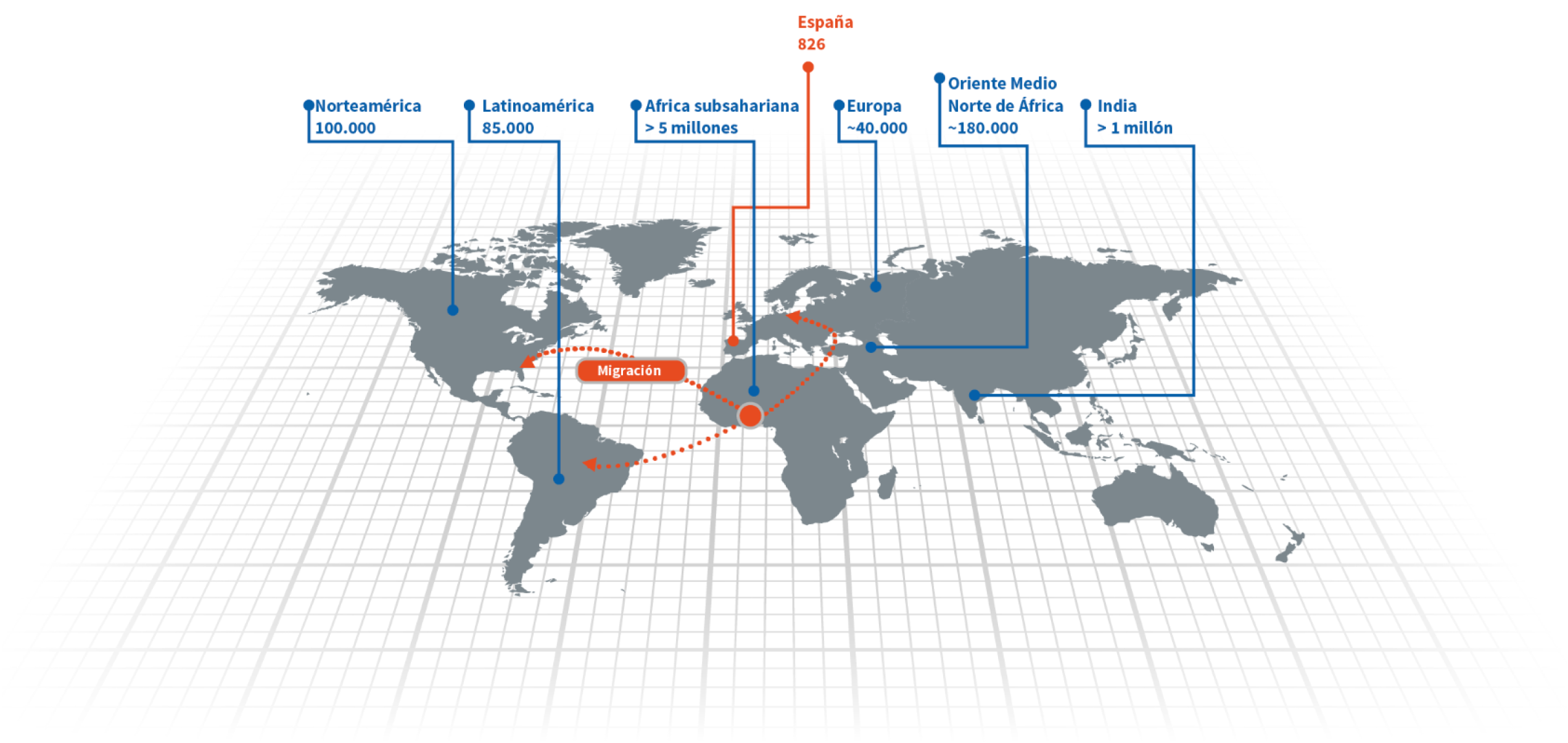
En 2050 se espera que el número de personas nacidas con ECF crezca un 30% en todo el mundo.13
Mecanismos subyacentes
Referencias
Concepto e incidencia
Concepto
Incidencia
Referencias
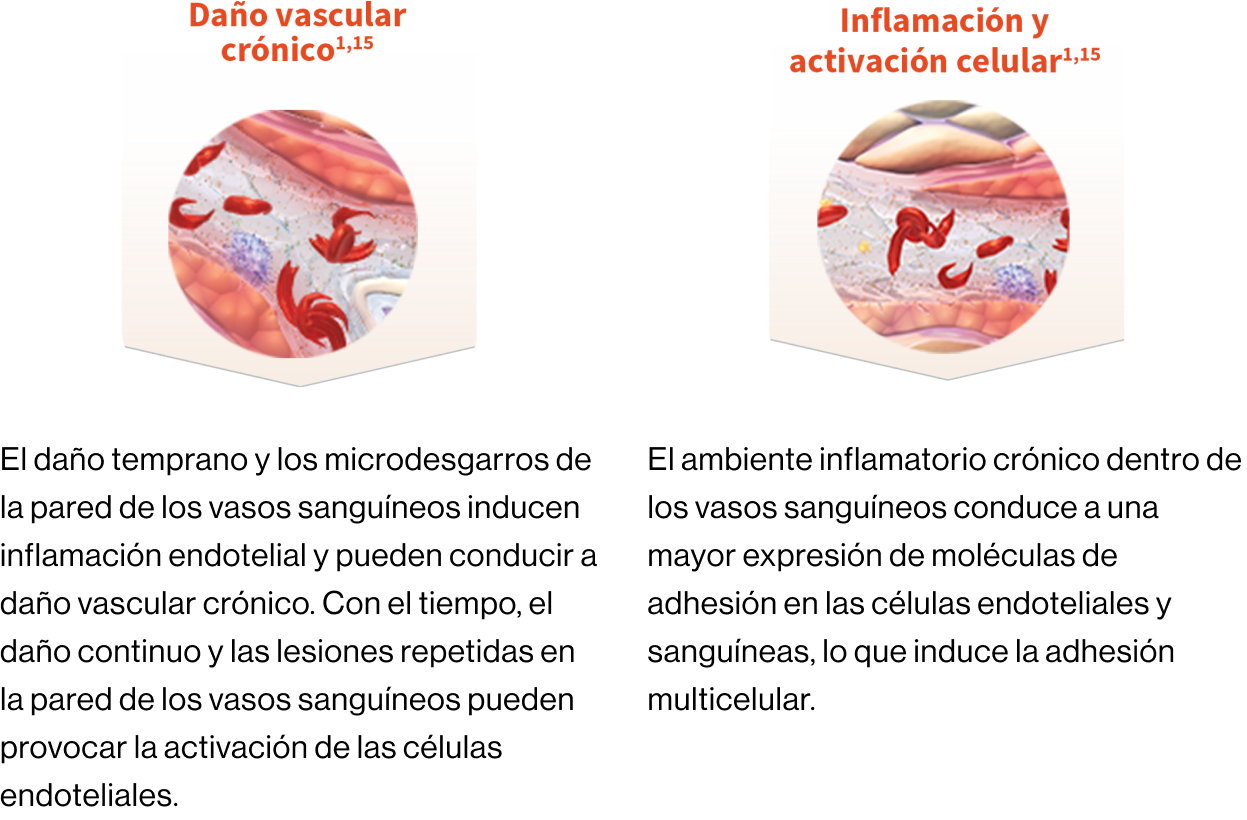
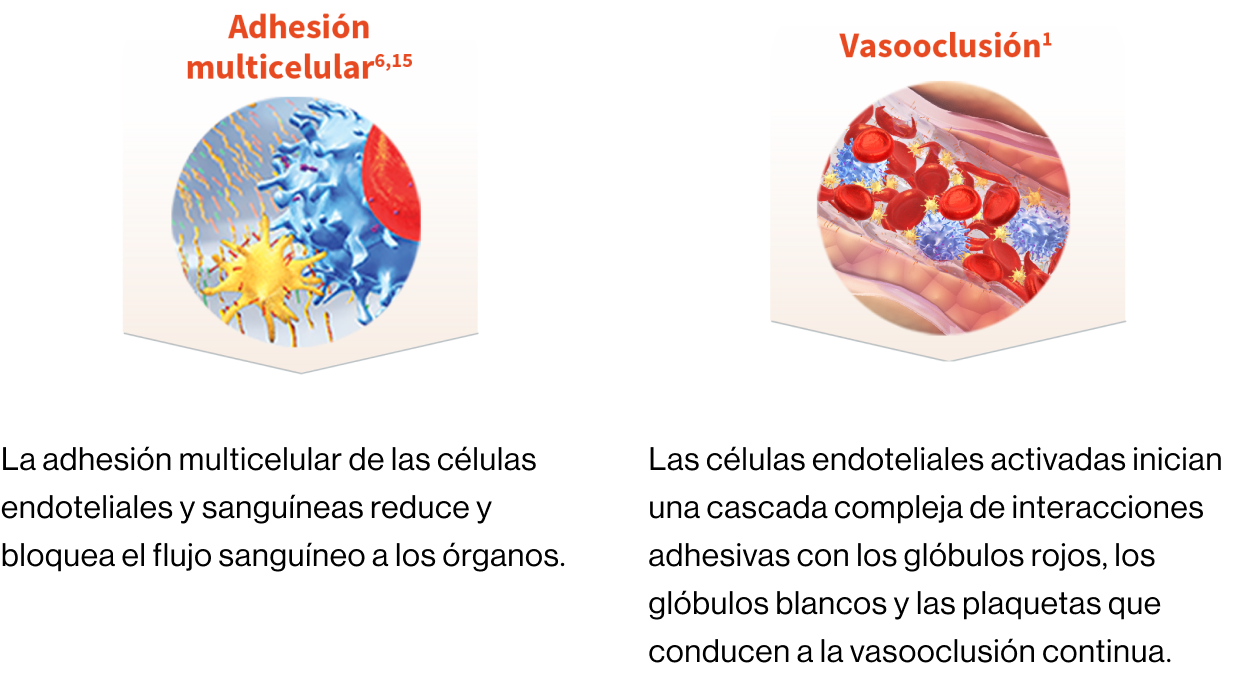
Fisiopatología
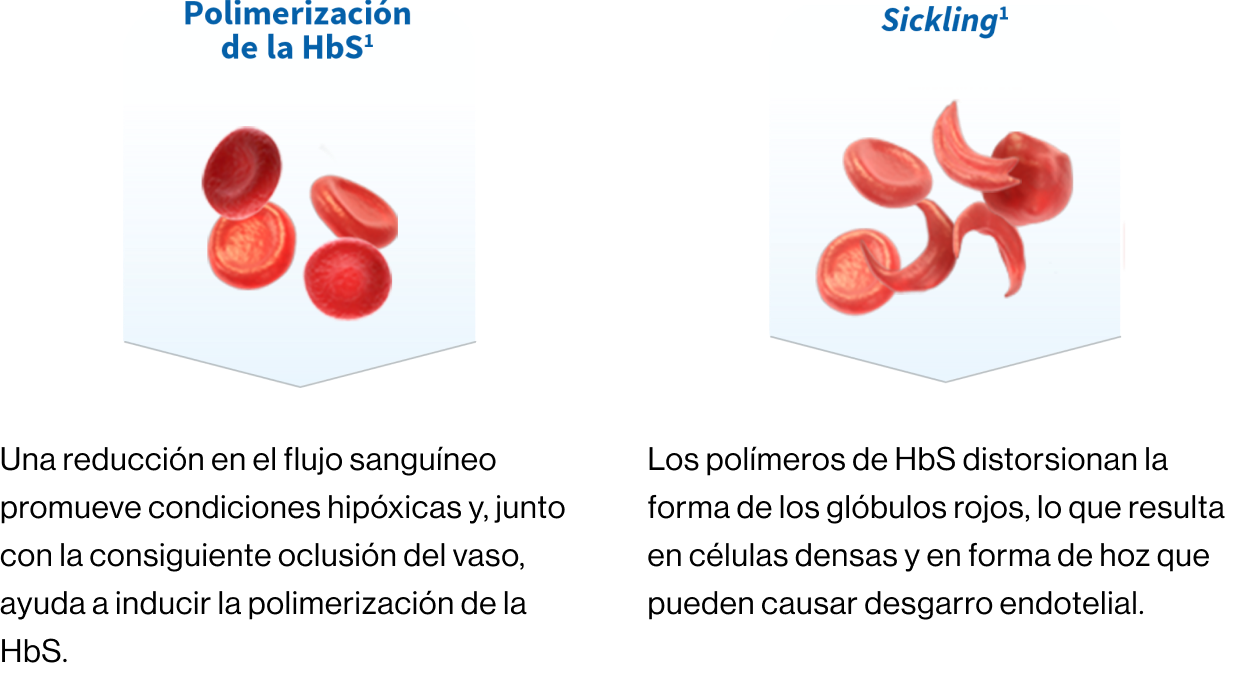
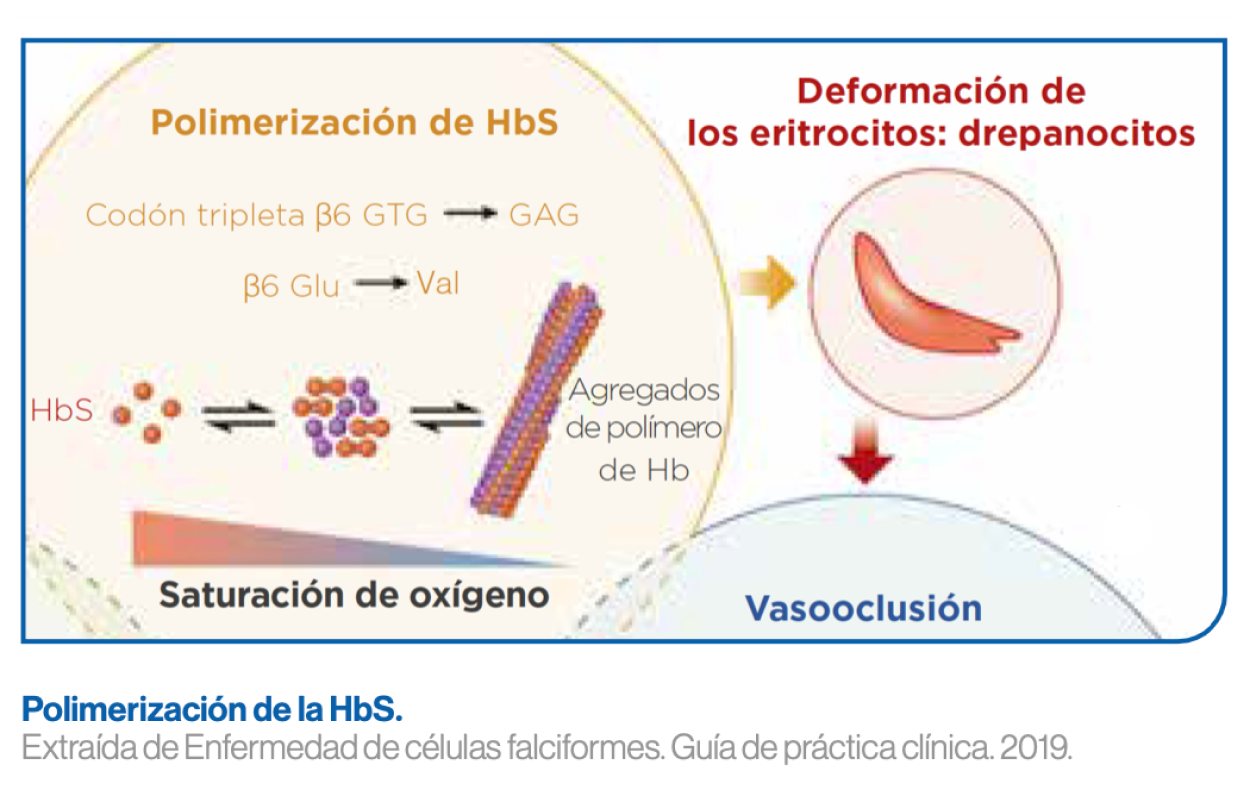
Polimerización de la hemoglobina
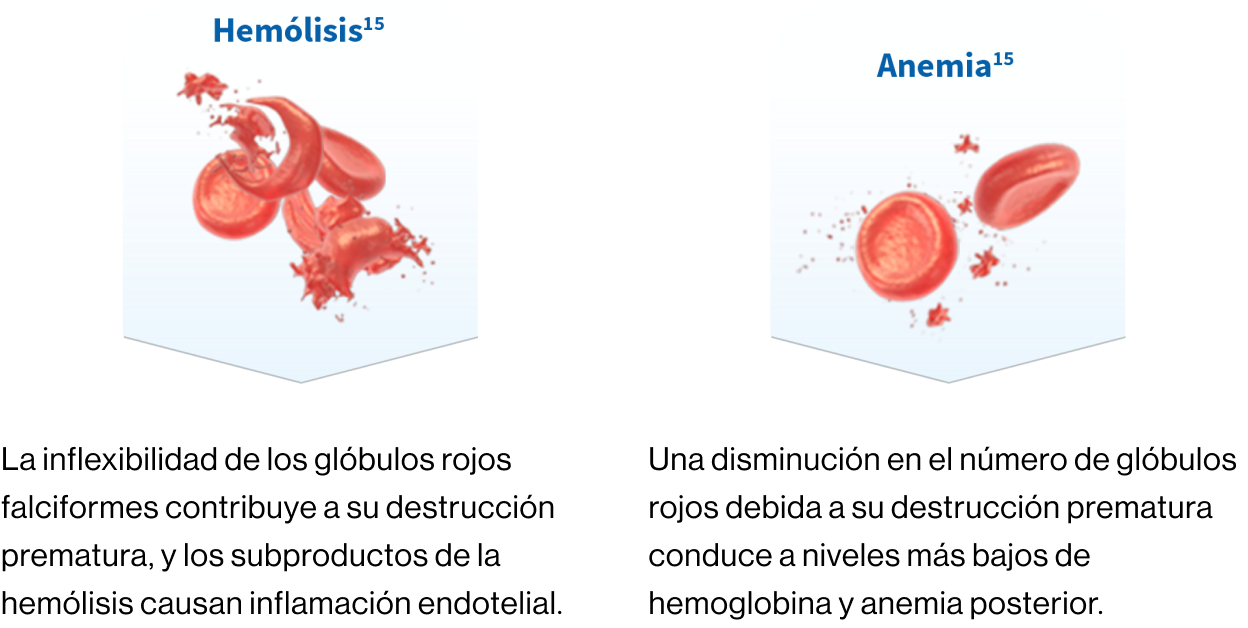
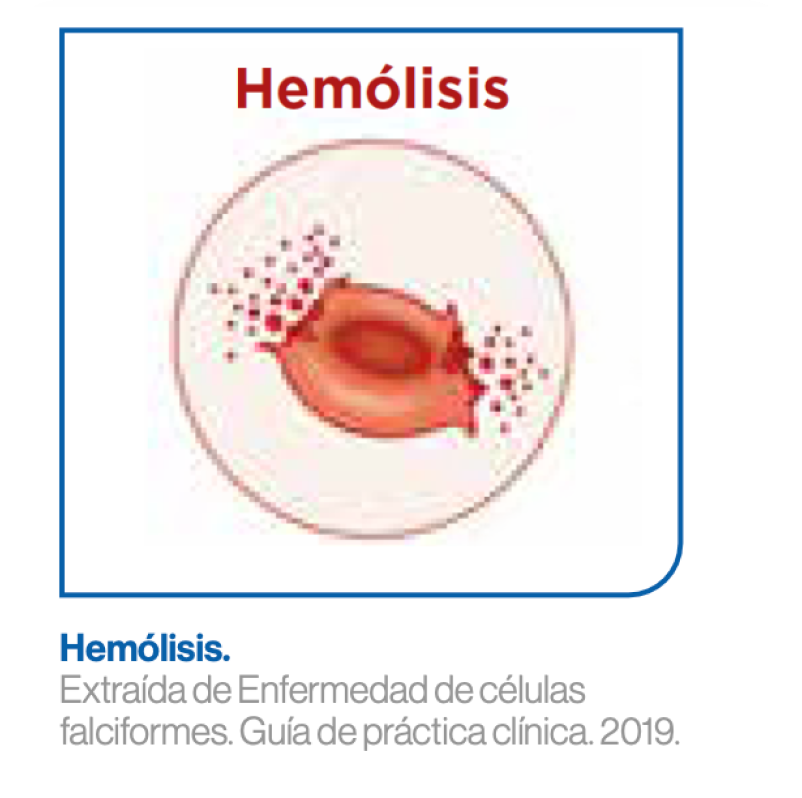
Hemólisis
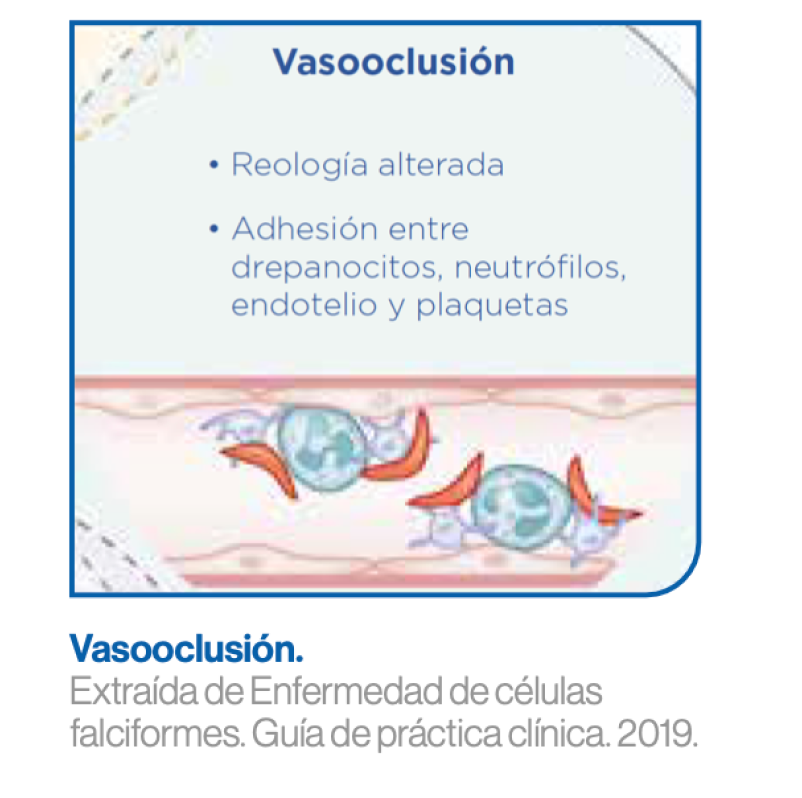
Crisis vasooclusivas
Inflamación crónica y daño endotelial
Referencia
Cribado neonatal
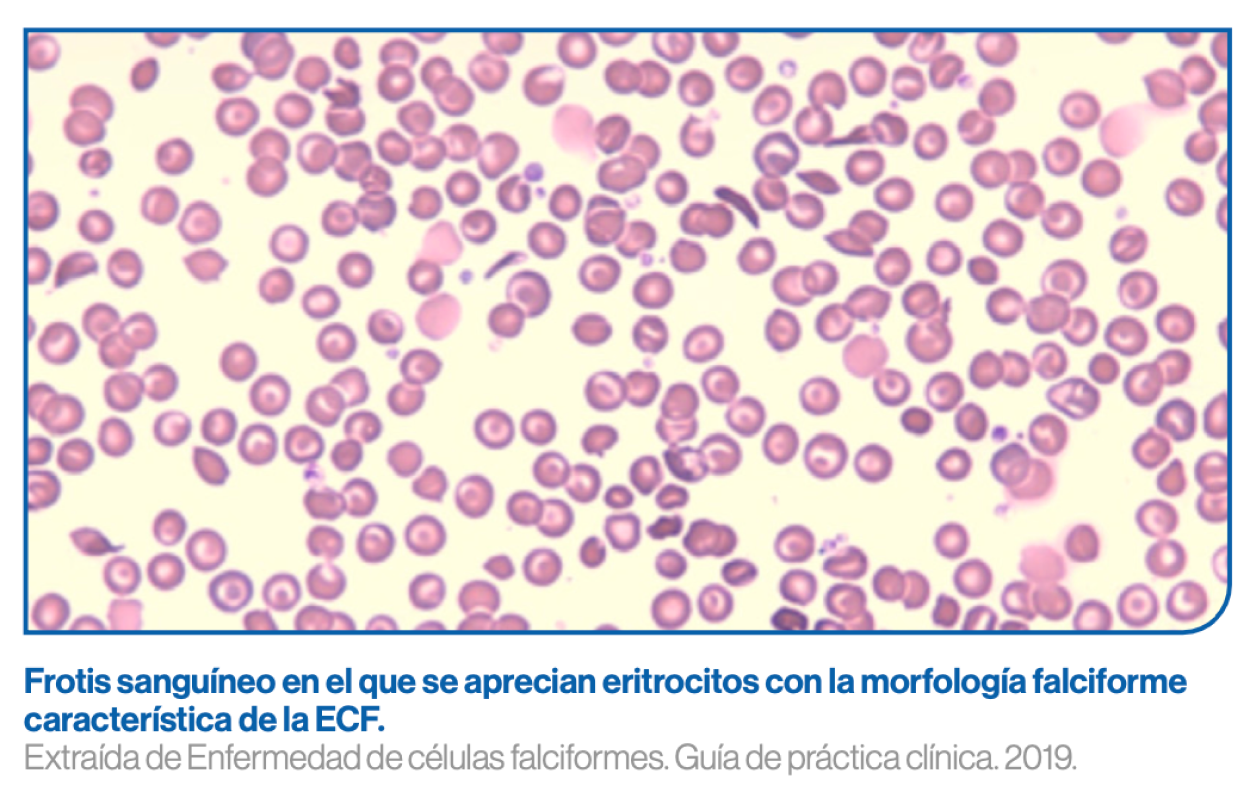
Datos hematimétricos y extensión de sangre periférica
Diagnóstico preciso
Referencias
Referencia
Pronóstico y clasificación
Referencias
Grupo de Eritropatología de la Sociedad Española de Hematología y Hemoterapia. Guía de enfermedad de células falciformes. 2021. Disponible en: https://www.profesionalessanitarios.novartis.es/sites/profesionalessanit.... Último acceso mayo 2022.
Sociedad Española de Hematología y Oncología Pediátricas. Enfermedad de células falciformes. Guía de práctica clínica. 2019. Disponible en: http://www.sehop.org/wp-content/uploads/2019/03/Gu%C3%ADa-SEHOP-Falcifor.... Último acceso mayo 2022.
Sociedad Española de Hematología y Oncología Pediátricas. Enfermedad de células falciformes. Guía de práctica clínica. 2019. Disponible en: http://www.sehop.org/wp-content/uploads/2019/03/Gu%C3%ADa-SEHOP-Falcifor.... Último acceso mayo 2022.
Sociedad Española de Hematología y Oncología Pediátricas. Enfermedad de Células Falciformes - Guía de Práctica Clínica. SEHOP 2019. Disponible en: http://www.sehop.otg/wp-content/uploads/2019/03/Gu%C3%ADa-SEHOP-Falciforme-2019.pdf. Último acceso: abril de 2020.
Heredía Rubio CD. Seguimiento multidisciplinar de los pacientes con enfermedad falciforme. Disponible en: http://scpediatria.cat/docs/ciap/2016/pdf/16_CDiaz-de-Herecia_CIAP2016.pdf. Último acceso: abril de 2020.
Profilaxis infecciosa
Hemoterapia
Hidroxiurea
Nuevos tratamientos
Referencias
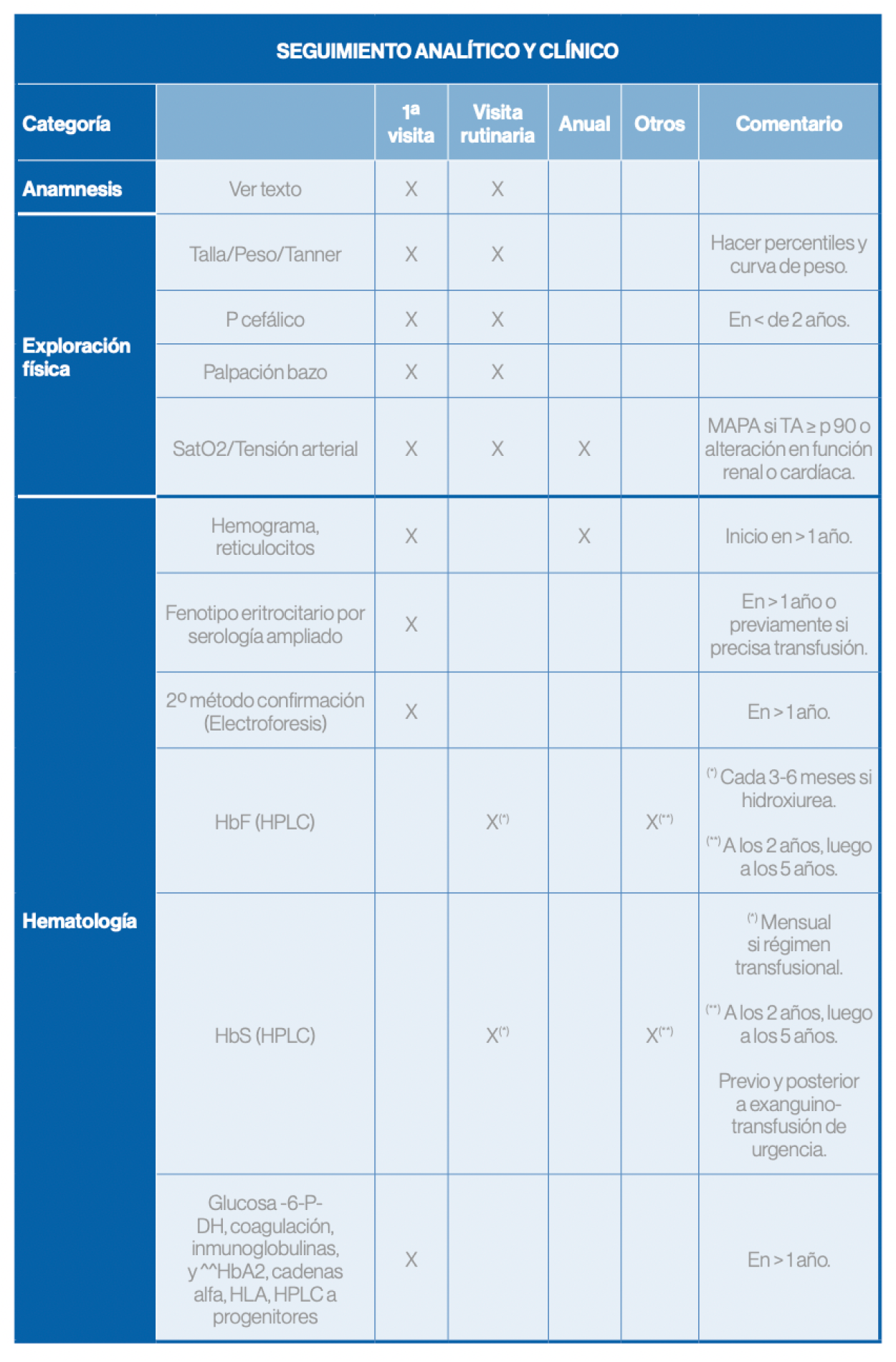
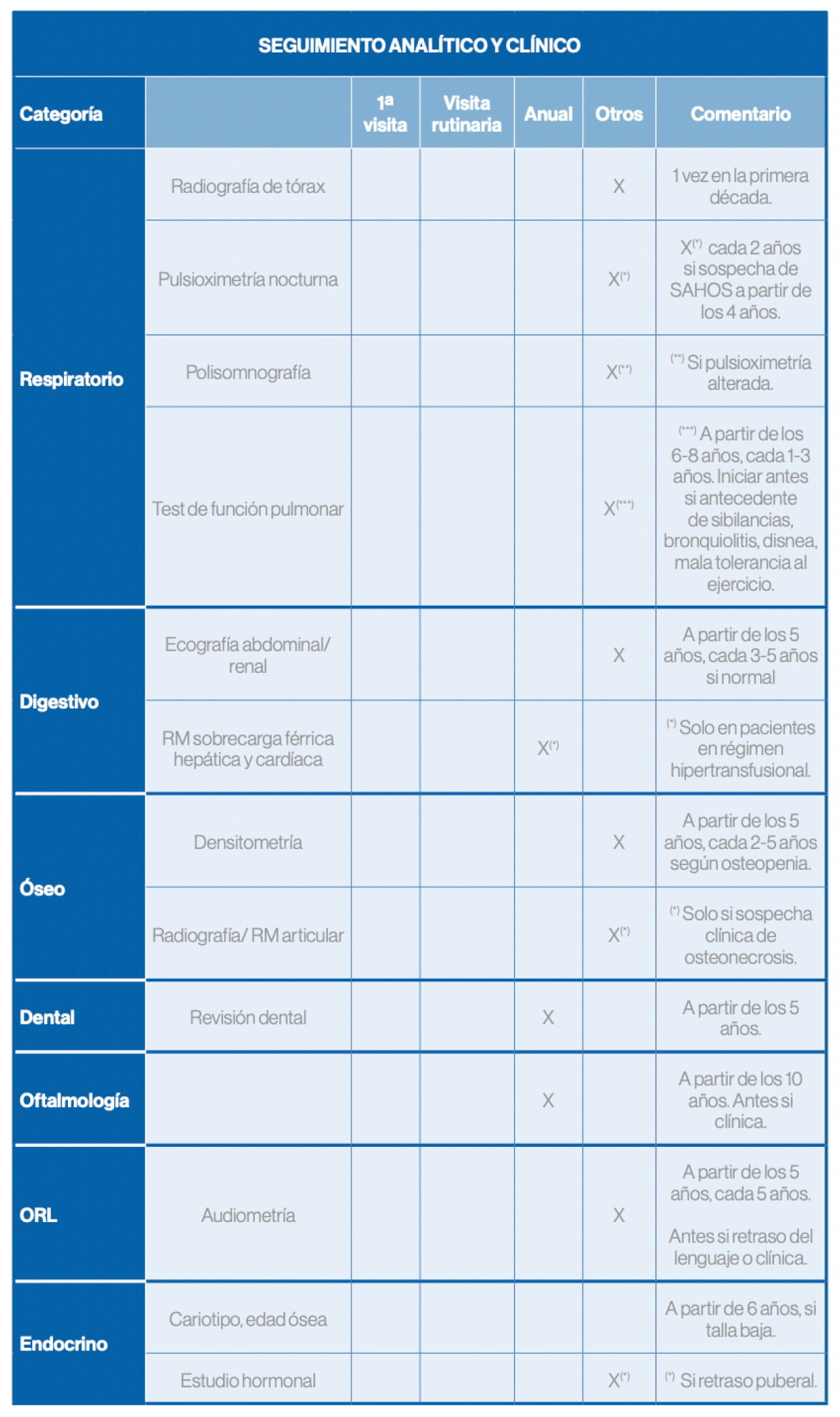
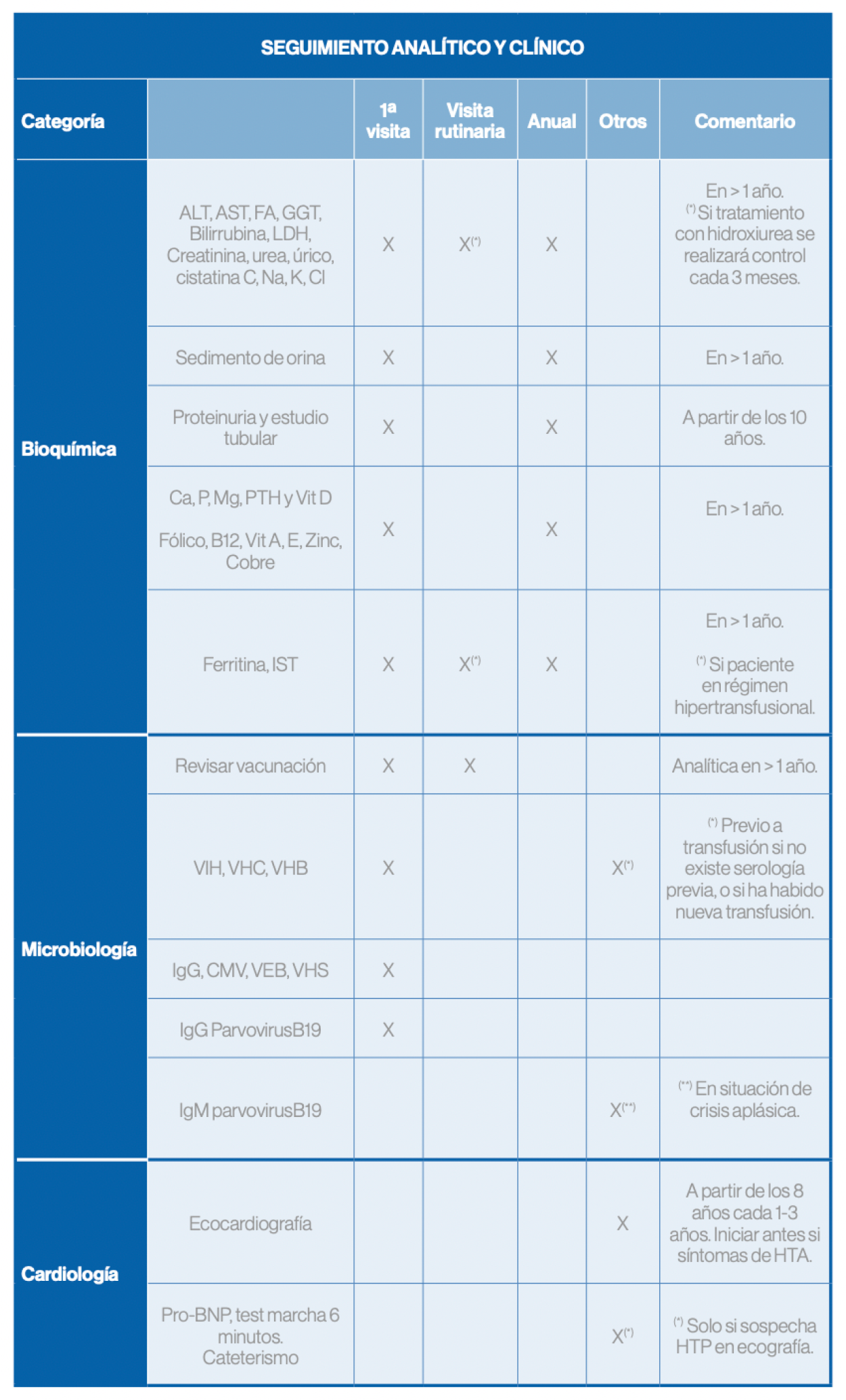
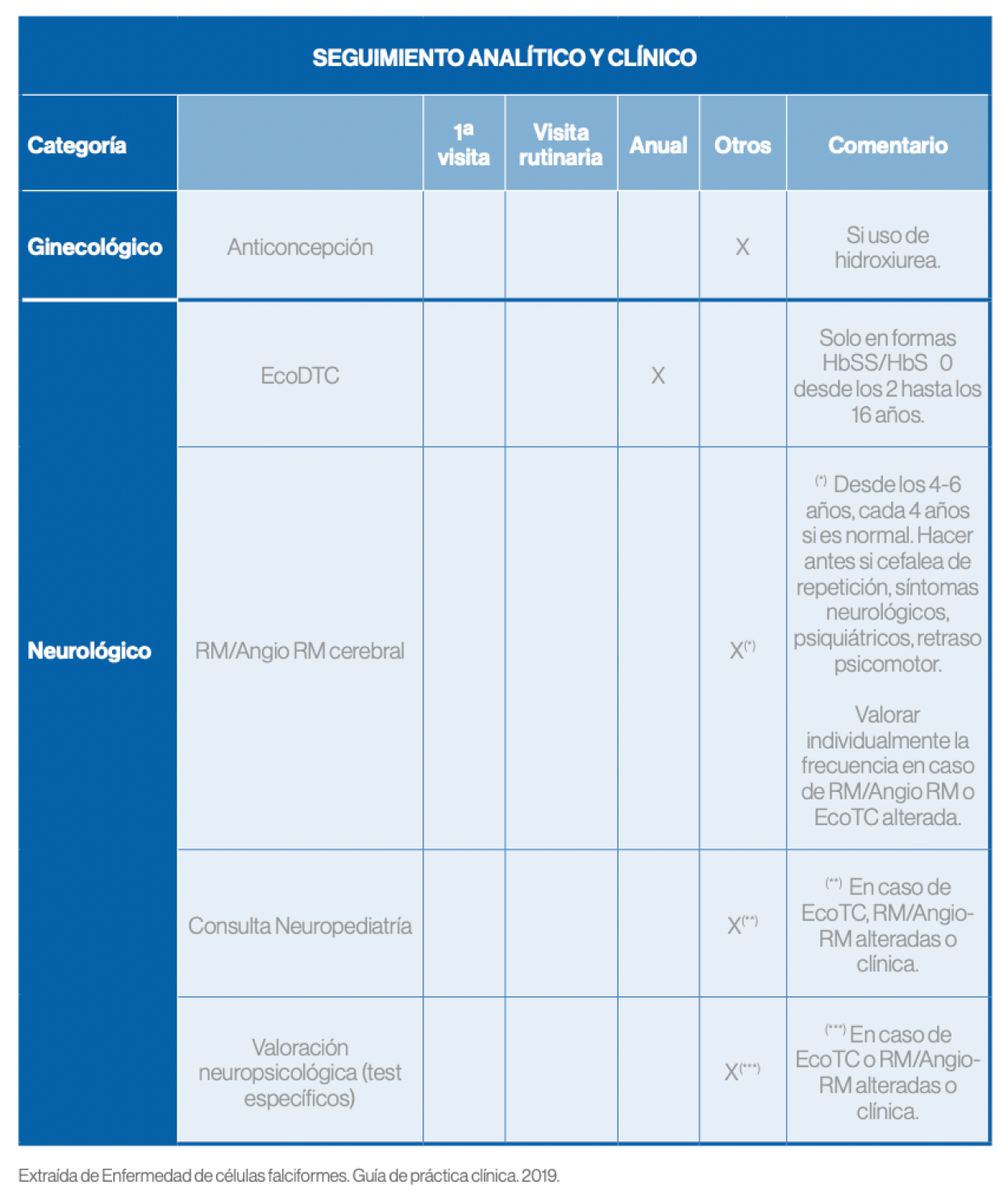
Seguimiento
Referencia
Guías Grupo Eritropatología
Guías ECF SEHOP
Protocolos de transición
Encuesta SWAY
También puede consultar la página web oficial del SWAY:
Recomendaciones para el manejo del paciente con ECF en urgencias
Impacto de la CVOs
Criterios de derivacion
Buscador de EECC
Referencias
Diptico Información ASAFE
Manual para el paciente de la Enfermedad de Células Falciformes
Diario de crisis