
Myelodysplastisches Syndrom
1. Pathophysiologie
2. Epidemiologie und Ursachen
3. Symptome
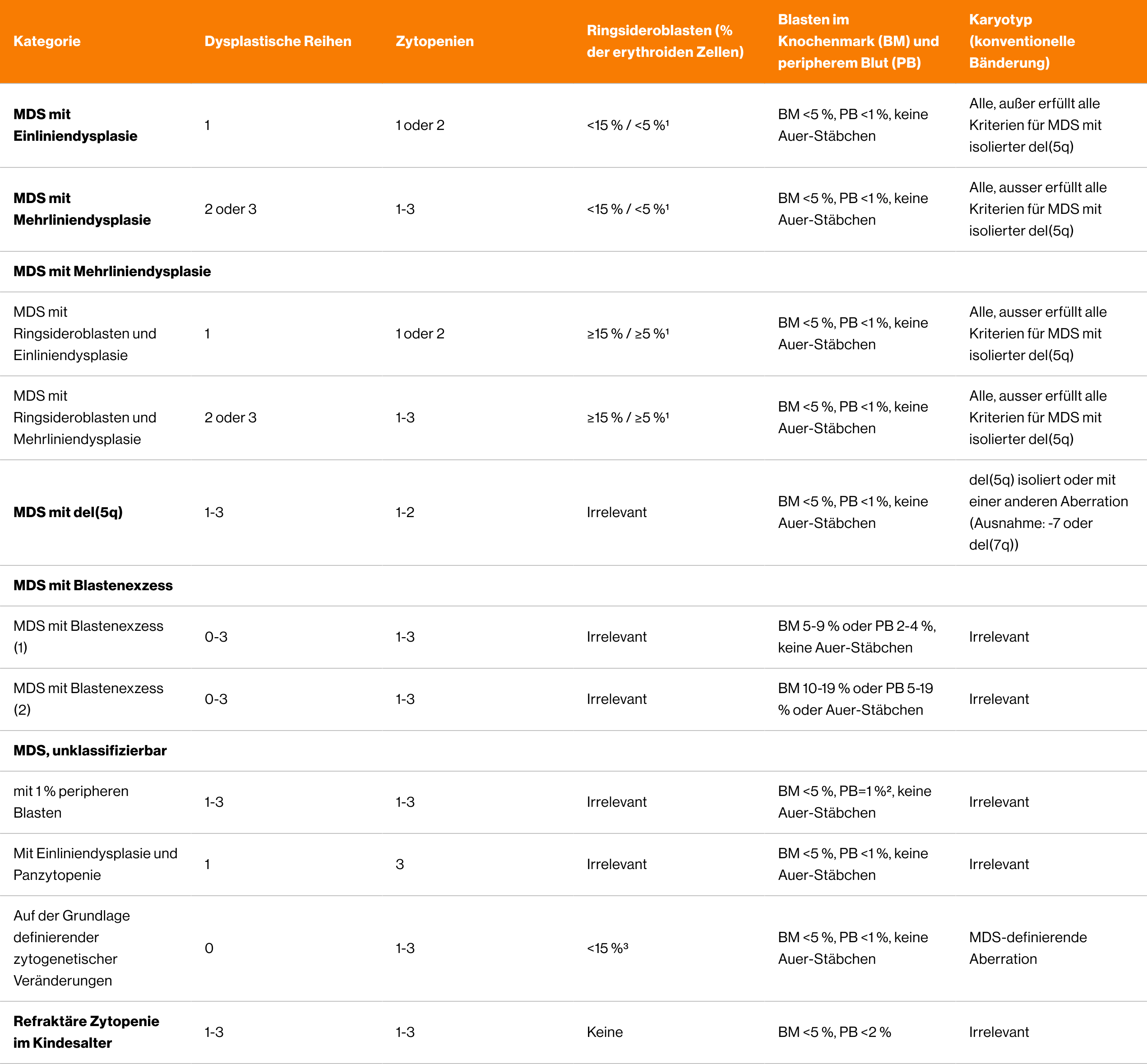
4. Diagnostik

5. Behandlung
Referenzen
Onkopedia Leitlinien. Myelodysplastische Syndrome (MDS). Abrufbar unter: https://www.onkopedia.com/de/onkopedia/guidelines/myelodysplastische-syn...@@guideline/html/index.html#ID0EAE (letzter Zugriff am 07. Februar 2022).
Chanias I, Bonadies N. Current Standard of Care in Patients with Myelodysplastic Syndromes and Future Perspectives. healthbook TIMES Oncology Hematology. 2020;4(6):10-22. doi:10.36000/hbT.OH.2020.06.026
Steensma DP. Clinical Implications of Clonal Hematopoiesis. Mayo Clin Proc. 2018;93(8):1122-1130. doi:10.1016/j.mayocp.2018.04.002
Haferlach T, Nagata Y, Grossmann V, et al. Landscape of genetic lesions in 944 patients with myelodysplastic syndromes. Leukemia. 2014;28(2):241-247. doi:10.1038/leu.2013.336
Bonadies N, Feller A, Rovo A, et al. Trends of classification, incidence, mortality, and survival of MDS patients in Switzerland between 2001 and 2012. Cancer Epidemiol. 2017;46:85-92. doi:10.1016/j.canep.2016.12.005
Swiss MDS Study Group. Was sind Myelodysplastische Syndrome (MDS)?. Abrufbar unter: https://www.mds-switzerland.ch/patienteninformationen/was-ist-mds/.
Kipfer B, Daikeler T, Kuchen S, et al. Increased cardiovascular comorbidities in patients with myelodysplastic syndromes and chronic myelomonocytic leukemia presenting with systemic inflammatory and autoimmune manifestations. Semin Hematol. 2018;55(4):242-247. doi:10.1053/j.seminhematol.2018.05.002
Arber DA, Orazi A, Hasserjian R, et al. The 2016 revision to the World Health Organization classification of myeloid neoplasms and acute leukemia. Blood. 2016;127(20):2391-2405. doi:10.1182/blood-2016-03-643544
Greenberg PL, Tuechler H, Schanz J, et al. Revised international prognostic scoring system for myelodysplastic syndromes. Blood. 2012;120(12):2454-2465. doi:10.1182/blood-2012-03-420489

